小檗堿對H2O2損傷大鼠神經干細胞增殖的影響
孫勝男,劉 欣,佟苗苗,伊舒巖,范樂萌,劉 雙,李昕茹,樊樂琪,張 囡(1.中國醫科大學藥學院,沈陽 1101; .河北醫科大學藥學院,河北 石家莊 050000; .承德醫學院附屬醫院藥學部,河北 承德 067000)
神經干細胞(neural stem cells,NSCs)具有分化神經元和膠質細胞的多向分化潛能[1]。研究發現NSCs具有修復損傷組織的能力,來防治由細胞缺失或損傷引起的多種疾病,如神經系統退行性或損傷性疾病。在中風和缺氧缺血等實驗性的腦損傷模型中,NSCs開始增生和遷移到損傷部位分化為神經元[2 - 3]。腦組織受損后,周圍環境缺血缺氧、氧化應激等炎癥因子等多種不良因素,導致具有增殖、分化功能的NSCs數量有限,難以修復損傷的神經區域[4]。尋找促進體內NSCs增殖的藥物對于治療神經系統疾病具有重要的意義。小檗堿(berberine)是一種異喹啉類生物堿,是黃連和黃柏的主要活性成分,具有抗炎、改善糖脂代謝、治療的腹瀉作用[5 - 6]。此外,小檗堿對腦缺血、阿爾茨海默病、創傷性腦損傷引起的神經損傷具有保護作用[7-9]。本實驗采用細胞培養技術,觀察小檗堿對NSCs增殖的影響,為開發對NSCs具有保護效能的治療藥物以及小檗堿的臨床應用提供理論依據。
1 材料和方法
1.1 實驗動物
SPF級24 h內新生SD大鼠,雌雄不限,購自河北醫科大學實驗動物中心[SCXK (冀) 2017-1-003]。無菌手術在實驗動物中心進行[SYXK (冀) 2017-0012]。動物實驗經由實驗動物管理委員會批準(2017-0083),實驗動物使用按照3R原則給予人道的關懷照顧。
1.2 主要試劑與儀器
DMEM/F12培養基,B27添加劑為美國Gibco公司產品;堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF),表皮生長因子(epidermal growth factor,EGF)為美國Peprotech公司產品;多聚賴氨酸,小鼠抗大鼠Nestin抗體,兔抗大鼠Ki67、兔抗大鼠Notch1、兔抗大鼠Hes1抗體,FITC-標記兔抗鼠二抗、Cy3-標記羊抗兔二抗,DAPT均為美國CST公司產品;CCK8試劑盒為北京莊盟有限公司產品。倒置熒光顯微鏡購自日本Olympus公司;DYY-12型電泳儀、DYCZ-24DN型電泳槽、DYCZ-40B型轉印電泳儀購自北京六一儀器廠。
1.3 實驗方法
1.3.1 NSCs的分離
將出生24 h內的新生SD大鼠脫頸處死后置于體積分數為75%乙醇消毒5 min,無菌條件下取出全腦,置于盛有冷PBS緩沖液的培養皿中去除小腦、腦干、血管和腦膜,取出大腦皮層并去除軟腦膜,PBS緩沖液漂洗兩次,轉移至離心管加入一定量冷PBS緩沖液吹打均勻,過200目篩網,1000 r/min離心5 min棄上清,全培養基(2% B27,20 μg/L bFGF,20 μg/L EGF的DMEM/F12)重懸,以每毫升1.4 × 106個細胞的密度接種于6孔板中,每2~3 d半量換液,5~9 d傳代一次。收集原代培養的神經球,離心,重懸細胞,調整細胞密度為每毫升1 × 105個,放入37℃,5% CO2孵箱中培養3~7 d后進行實驗處理。本研究所用的NSCs均為傳1代的細胞。
1.3.2 NSCs鑒定
將生長狀況良好的第1代NSCs接種到預先經過多聚賴氨酸處理的96孔培養板中,37℃、5% CO2培養箱中培養3~4 d后取出,去掉完全培養基,PBS緩沖液清洗2次,每次2 min。4%多聚甲醛室溫固定15 min,PBS緩沖液清洗2次,每次2 min。0.5% Triton X-100細胞通透5 min,PBS緩沖液清洗2次,每次2 min。正常牛血清(10%)室溫封閉30 min。吸出血清,加入兔抗鼠Nestin(1∶200),4℃過夜,PBS緩沖液洗滌細胞2次,每次3 min。在黑暗中孵育熒光標記的二次抗體,37℃避光孵育1 h,PBS緩沖液漂洗3次,DAPI染核1 min;再用PBS緩沖液漂洗2次,體積分數0.5%甘油封片,倒置熒光顯微鏡照相。
1.3.3 實驗分組及CCK8法檢測NSCs活力
將培養的NSCs用胰酶消化為單個NSC,以每孔2 × 105個細胞、200 μL的體積加入96孔板中,培養至第3天。正常組,繼續培養12 h;H2O2組,給予終濃度為30 μmol/L H2O2處理12 h;小檗堿組,H2O2和不同終濃度小檗堿(0.5、1、5、20 μmol/L)孵育12 h;DAPT(Notch信號通路阻斷劑)組,H2O2、小檗堿(5 μmol/L)、DAPT共同孵育12 h。實驗結束后,向每孔加入10 μL CCK8溶液,將培養板在培養箱內孵育2 h,用酶標儀測定在450 nm處的吸光度。細胞活力(%)=(A實驗孔-A空白孔)/(A對照孔-A空白孔) × 100%。
1.3.4 測量NSCs球平均直徑
NSC單細胞懸浮液鋪于96孔板,密度為每孔2 × 105個細胞,體積為每孔200 μL,培養至3 d。設置正常對照組、H2O2組和小檗堿組(5、10 μmol/L),處理NSCs結束后,顯微鏡下任選5個視野觀察神經球數量和直徑大小。
1.3.5 Ki67染色檢測NSCs增殖
正常對照組、H2O2組、小檗堿組(5 μmol/L)、DAPT組收集NSCs,棄去培養液,PBS緩沖液洗滌3次,每次5 min,體積分數4%多聚甲醛室溫下固定15 min行免疫熒光染色。每組在顯微鏡下隨機計數5個視野下Ki67陽性細胞數,計算陽性細胞率(%)=Ki67陽性細胞數/DAPI細胞數× 100%。
1.3.6 Western blot檢測蛋白表達
蛋白裂解液處理各組樣品,使用超聲破碎,離心(4℃,12 000 r/min,10 min),每孔上樣量50 μg,SDS-PAGE分離,轉PVDF膜上,5%脫脂牛奶封閉2 h,加入Ki67(1∶1000)、Notch1(1∶1000)、Hes1(1∶1000)、β-actin(1∶1000)抗體4℃冰箱過夜,棄掉一抗,TBST緩沖液洗膜5 min,3次,室溫孵育二抗(1∶10 000)2 h,棄掉二抗,TBST緩沖液洗膜5 min,3次;ECL發光顯色,采用β-actin作為內參,Image J軟件分析相對灰度值。實驗重復3次。
1.4 統計學方法
2 結果
2.1 NSCs的鑒定
24 h后,可在普通光顯微鏡下看到許多小懸浮神經球。神經球的直徑隨時間的增加而增加,形狀變圓,培養72 h后,光鏡下可見細胞聚集形成的細胞團。免疫熒光化學染色檢測NSCs的特征性蛋白Nestin的表達。結果顯示,在神經球細胞團中有大量Nestin表達陽性,提示形成的神經球為NSCs。
2.2 小檗堿對NSCs活力影響
正常對照組和H2O2組細胞活力分別為(100.0±1.3)%和(58.6±4.5)%,差異有顯著性(P< 0.05);與H2O2組相比,小檗堿0.5 μmol/L和1 μmol/L細胞活力升高,分別為(64.8±2.6)%和(65.9±4.2)%,但差異無顯著性;小檗堿5、10及20 μmol/L細胞活力分別為(72.4±6.1)%、(74.8±4.5)%、(75.6±3.9)%,與H2O2組相比,差異有顯著性(P< 0.05)。
2.3 小檗堿對NSCs大小影響
對照組NSCs球平均直徑為(82.1±12.1) μm,H2O2組為(54.2±7.8) μm,與對照組比較,差異有顯著性(P< 0.01)。小檗堿組(5 μmol/L)神經球直徑為(67.1±9.6) μm,小檗堿組(10 μmol/L)神經球直徑為(70.2±10.4) μm,與H2O2組相比,差異有顯著性(P< 0.01)。見圖1。
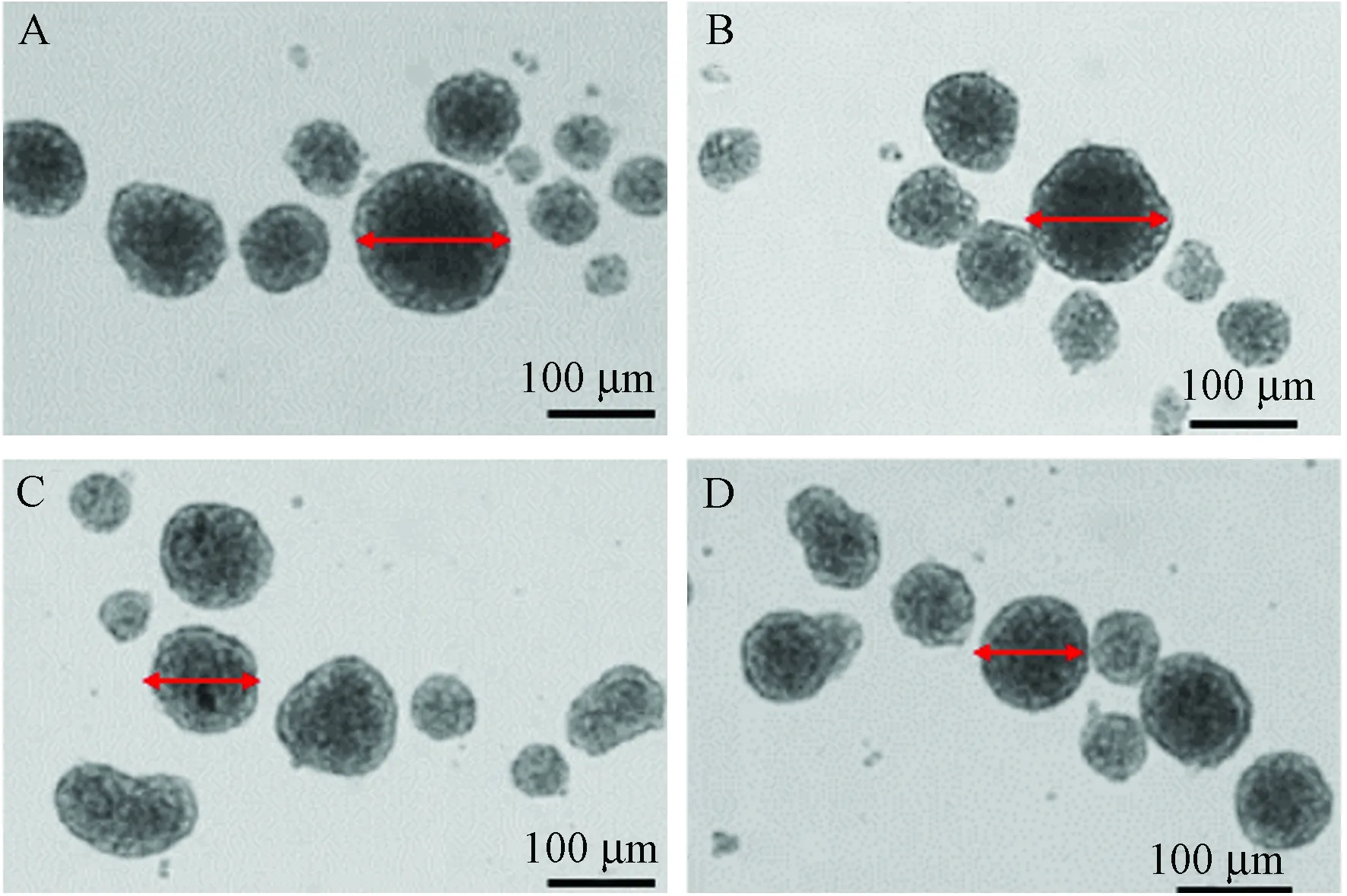
注:A:對照組;B:H2O2組;C:小檗堿5 μmol/L組;D:小檗堿10 μmol/L組。圖1 小檗堿對NSCs增殖的影響Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: Berberine group (10 μmol/L).Fig.1 Effect of berberine on neural stem cell proliferation
2.4 小檗堿對NSCs增殖率影響
與正常對照組相比,H2O2組Ki67陽性百分率明顯降低(50.3%比21.3%,P< 0.01);小檗堿(5 μmol/L)處理12 h后相比H2O2組Ki67陽性細胞的比例明顯增加(38.3%比21.3%,P< 0.01);DAPT組與小檗堿組相比,Ki67陽性細胞的比例下降(21.9%比38.4%,P< 0.01)。
2.5 小檗堿對NSCs中Notch通路相關蛋白的表達影響
Western blot結果顯示,與對照組比較,H2O2處理后NSCs中Ki67、Notch1、Hes1蛋白表達水平明顯減少(P< 0.01);與H2O2組比較,小檗堿組(5 μmol/L)細胞Ki67、Notch1、Hes1蛋白表達水平明顯增加(P< 0.01)。小檗堿組加入Notch通路抑制劑DAPT后,與小檗堿組相比,Ki67、Notch1、Hes1蛋白表達水平顯著降低(P< 0.01),說明DAPT拮抗小檗堿神經保護作用。
3 討論
抗氧化系統與氧化系統的失衡,參與神經退化、缺血性腦損傷的進程。H2O2是氧化過程中具有很高活性的分子,可以引起細胞膜破壞及細胞的凋亡和壞死。成年哺乳動物腦損傷后,激活中樞神經系室管膜下層和海馬的顆粒下層NSCs再生能力,通過促進神經再生替代死亡的神經元,從而促進組織重建和神經功能修復已成為臨床治療的重要方向[9]。但是內源性神經前體細胞遷移到病變區域進行增殖和分化的能力有限,不能使喪失的腦功能完全恢復,需要進行藥物干預[10]。同時,外源性NSCs移植途徑通過分泌高濃度的生長因子,有助于內源性神經再生,但是病灶區域長期炎癥、缺乏營養、氧化攻擊等損傷關系導致內源性NSCs增殖能力下降和外源性NSCs存活率低,極大的阻礙了大腦自身修復能力[10]。促進神經再生及分化和減少損傷區腦細胞的凋亡是促進腦損傷后神經功能恢復的關鍵[10 - 11]。
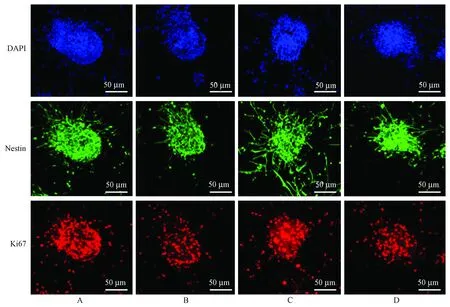
注:A:對照組;B:H2O2組;C:小檗堿5 μmol/L組;D:DAPT組。圖2 小檗堿對NSCs增殖蛋白的影響Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: DAPT group.Fig.2 Effect of berberine on the neural stem cell proliferation protein
表1 各組蛋白表達情況Tab.1 Comparison of Ki67, Notch1, and Hes1 protein expression in each group
注:與對照組相比,*P< 0.05,**P< 0.01;與H2O2組相比,#P< 0.05,##P< 0.01;與小檗堿組相比,&P< 0.05,&&P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01. Compared with the H2O2group,#P< 0.05,##P< 0.01. Compared with the berberine group,&P< 0.05,&&P< 0.01.
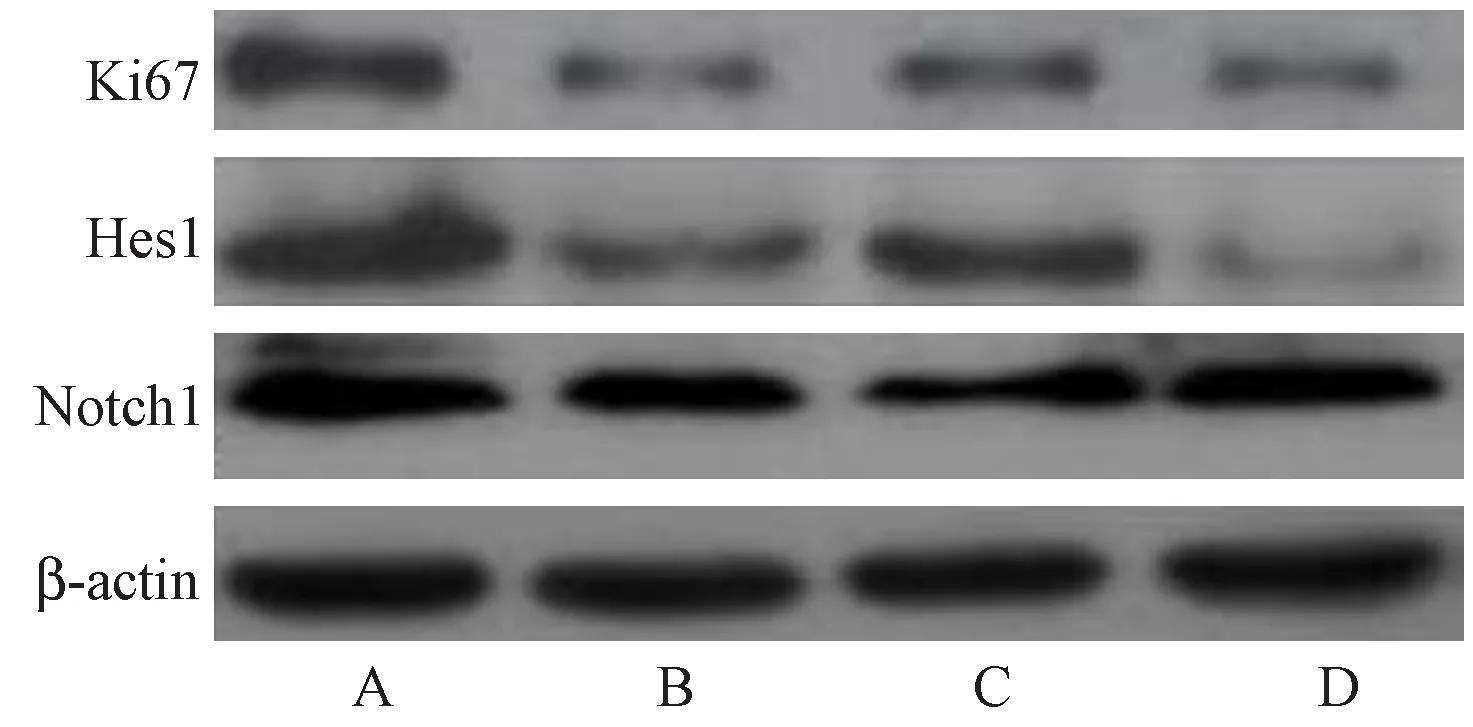
注:A:對照組;B:H2O2組;C:小檗堿5 μmol/L組;D:DAPT組。圖3 小檗堿對NSCs中Notch通路相關蛋白的表達影響Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: DAPT group.Fig.3 Effect of berberine on expression of Notch pathway-related proteins in neural stem cells
小檗堿對神經系統疾病具有潛在的治療價值,有抗氧化、抗炎、降低神經元凋亡的作用[12]。在本研究中,采用不同濃度小檗堿(0.5、1、5、10、20 μmol/L)處理,當濃度增加到5 μmol/L時,小檗堿可以增強H2O2損傷的NSCs活力,而且隨著小檗堿濃度的增加,細胞活力無顯著變化。神經球被視為自由浮動的一束束NSCs,神經球的形成是NSCs不斷增殖的直接體現,因此,可用神經球平均直徑反映NSCs的增殖能力。本實驗結果提示5 μmol/L小檗堿處理可以改善損傷細胞的形態,改善H2O2產生的增殖抑制作用。
Ki67是與細胞增殖有關的核抗原,通過Western blot方法,與正常對照組比較,H2O2組Ki67蛋白表達顯著降低,小檗堿處理可以顯著提高Ki67蛋白表達,說明小檗堿能顯著拮抗H2O2導致的Ki67蛋白表達的下降。NSCs的自我維持和增殖功能是受Notch信號途徑的調控。將Notch通路的抑制劑DAPT運用于NSCs的體外培養中,鏡下可見NSCs數量明顯減少,NSCs生長過程中所形成的神經球的直徑也明顯減小;過表達Notch1、Hes1和Hes5能夠促進神經前體細胞的增殖和自我更新[13 - 14]。本實驗結果顯示,H2O2可以抑制Notch1和Hes1蛋白表達,小檗堿處理后可增強Notch1和Hes1蛋白表達;而在小檗堿組加入10 μmol/L Notch通路阻斷劑DAPT后,Ki67表達以及Notch1和Hes1蛋白表達均下降,說明DAPT可抵消小檗堿的促增殖作用,初步確認了小檗堿發揮促增殖的作用可能是通過調節Notch信號通路。
參考文獻:
[1] Gincberg G, Arien-Zakay H, Lazarovici P, et al. Neural stem cells: therapeutic potential for neurodegenerative diseases [J]. Br Med Bull, 2012, 104: 7-19.
[2] 薛金龍, 石淑先, 孫芳玲, 等. Wnt信號通路及相關神經因子對神經再生的影響 [J]. 中國比較醫學雜志, 2013, 23(9): 80-86, 79.
[3] Felling RJ, Snyder MJ, Romanko MJ, et al. Neural stem/progenitor cells participate in the regenerative response to perinatal Hypoxia/Ischemia [J]. J Neurosci, 2006, 26(16): 4359-4369.
[4] Shen CC, Lin CH, Yang YC, et al. Intravenous implanted neural stem cells migrate to injury site, reduce infarct volume, and improve behavior after cerebral ischemia [J]. Curr Neurovasc Res, 2010, 7(3): 167-179.
[5] Wu YH, Chuang SY, Hong WC, et al. Berberine reduces leukocyte adhesion to LPS-stimulated endothelial cells and VCAM-1 expression bothinvivoandinvitro[J]. Int J Immunopathol Pharmacol, 2012, 25(3): 741-750.
[6] Di Pierro F, Villanova N, Agostini F, et al. Pilot study on the additive effects of berberine and oral type 2 diabetes agents for patients with suboptimal glycemic control [J]. Diabetes Metab Syndr, 2012, 10(5): 213-217.
[7] 張玲玲, 黃瀾, 徐艷峰, 等. 小檗堿對2型糖尿病ICR小鼠模型的治療作用 [J]. 中國比較醫學雜志, 2010, 20(1): 23-27.
[8] Zhu F, Qian C. Berberine chloride can ameliorate the spatial memory impairment and increase the expression of interleukin-1β and inducible nitric oxide synthase in the rat model of Alzheimer’s disease [J]. BMC Neurosci, 2006, 1(7): 78.
[9] Madri JA. Modeling the neurovascular niche: implications for recovery from CNS injury [J]. J Physiol Pharmacol. 2009, 60(Suppl 4): 95-104.
[10] Miyamoto N, Maki T, Pham LD, et al. Oxidative stress interferes with white matter renewal after prolonged cerebral hypoperfusion in mice [J]. Stroke, 2013, 44(12): 3516-3521.
[11] 李峰, 蔡光先. 腦缺血后神經再生及其治療的研究進展 [J]. 中華中醫藥雜志, 2016, 31(2): 578-581.
[12] Chen CC, Hung TH, Lee CY, et al. Berberine protects against neuronal damage via suppression of glia-mediated inflammation in traumatic brain injury [J]. PLoS One, 2014, 9(12): e115694.
[13] Ahmed T, Gilani AU, Abdollahi M, et al. Berberine and neurodegeneration: a review of literature [J]. Pharmacol Rep, 2015, 67(5): 970-979.
[14] Hu YY, Zheng MH, Cheng G, et al. Notch signaling contributes to the maintenance of both normal neural stem cells and patient-derived glioma stem cells [J]. BMC Cancer, 2011, 11: 82.

