西紅花提取物對局灶型腦缺血/再灌注大鼠線粒體分裂融合的影響
張業昊,姚明江,叢偉紅,劉建勛
(中國中醫科學院西苑醫院基礎醫學研究所,中藥藥理北京市重點實驗室,北京 100091)
短暫性腦缺血發作(transient ischemic attack , TIA)是由于頸動脈或椎-基底動脈系統發生短暫性血液供應不足,致使產生了神經系統的功能障礙,一般持續時間少于24 h。多數情況下,缺血后再灌注可使器官功能得到恢復,損傷的結構得到修復;但有時缺血后再灌注不僅不能使組織、器官功能恢復,反而加重組織、器官的功能障礙和結構損傷。這種在缺血基礎上恢復血流后組織損傷反而加重,甚至發生不可逆性損傷的現象稱為缺血/再灌注(ischemia/reperfusion,I/R)損傷。近年大量研究表明,腦缺血后由于恢復供氧產生自由基和炎性反應等原因引發再灌注損傷,最終導致神經細胞損傷,凋亡、最終壞死。其中,線粒體是I/R損傷的最關鍵環節,自由基連鎖反應是腦I/R損傷的核心環節,而細胞內鈣超載則可能是導致神經元死亡的最后通路[1]。線粒體是一種高度動態的管狀網絡細胞器,可通過頻繁的融合分裂形成網狀結構,并通過與細胞骨架的相互連接來維持其正常功能與形態,這種動態的變化稱為線粒體分裂融合(mitochondrial fission and fusion),也稱為線粒體動力學[2-3]。近年大量研究發現,線粒體動力學紊亂可以致多種疾病發生,如神經降解性疾病、肥胖、糖尿病、癌癥等[4]。因此,探討腦I/R后線粒體分裂融合的變化以及尋找干預手段,抑制線粒體分裂融合失衡,減輕其導致的二次損傷,對腦I/R后的治療具有重要意義。西紅花(saffron,拉丁名CrocussativusL.)別名藏紅花、番紅花,是鳶尾科番紅花屬的多年生花卉,藥用部位為花的干燥柱頭。西紅花是我國傳統中藥材,也是一種常見的香料。其主要分布于南歐、伊朗等地,我國有少量栽培。傳統中醫藥認為西紅花具有疏經活絡、通經化淤、散郁開結、消腫止痛的功效,主要用于治療憂思郁結、胸膈痞悶、月經不調、產后瘀血、跌打損傷等。現代藥理學研究證明,西紅花可以明顯提高大鼠空間認知能力[5],并且能有效抑制G蛋白偶聯受體激酶2(G protein-coupled receptor kinase 2,GRK2)的轉運,限制降低細胞外調節蛋白激酶(extracellular regulated protein kinase 1/2,ERK1/2)的磷酸化[6],從而抑制腦缺血造成的大鼠腦部損傷。因此,本研究探索大鼠腦I/R后線粒體形態的改變及線粒體分裂融合的異常,并從抑制線粒體動力學異常的角度,探討西紅花提取物治療腦I/R、改善記憶障礙的可能機制,對相關中藥治療腦缺血疾病具有借鑒意義。
1 材料與方法
1.1材料
1.1.1實驗動物 SD大鼠,♂,體質量(190~210) g,購自維通利華實驗動物技術有限公司,許可證號:SCXK(京)2012-0001。
1.1.2試劑 BCA蛋白定量試劑盒、RIPA裂解液(強)、PMSF,均購自碧云天生物技術公司;動力蛋白相關GTP酶1(dynamin-like protein GTPase1,Drp1)抗體、COXIV抗體購自CST公司;視神經萎縮蛋白(optical atrophy-1,Opa1)抗體購自Santa Cruz公司;線粒體/胞質制備試劑盒購自普利萊基因技術有限公司;蛋白Marker、ECL發光液購自Thermo公司;西紅花總提取物由神威藥業集團提供并鑒定,其中西紅花總苷含量達51.5%,批號090914;金納多(銀杏葉提取物片)由德國威瑪舒培博士藥廠生產,批號1650711。
1.1.3儀器 Sh1倒置顯微鏡(Olympus);SYNERGYTM 4酶標儀(BioTek);IEC低溫冷凍離心機(美國Thermo公司);奧豪斯AR2130型電子天平(美國OHAUS公司)。
1.2方法
1.2.1分組及給藥 40只大鼠,隨機分為4組:模型組、假手術組、西紅花提取物組(3 mg·kg-1)、金納多組(28.8 mg·kg-1),給藥體積2 mL·kg-1,于MCAO術后十二指腸給藥。
1.2.2大鼠局灶性腦I/R損傷模型(栓線法)的制備 大腦中動脈栓塞法(middle cerebral artery occlusion,MCAO)手術當天,大鼠3.5%的水合氯醛(0.1 mL·kg-1)腹 腔 注 射 麻 醉,頸部備毛、消毒,做正中切口,分離右側頸總動脈(CCA)、頸內動脈(ICA)及頸外動脈(ECA),結扎ECA與CCA,用動脈夾夾閉ICA遠心端后,迅速于ECA與ICA分叉處作一切口,插入一端加熱成光滑球形并涂多聚賴氨酸的尼龍線(直徑為0.25 mm),插入深度為(18 ± 1)mm,實現大腦中動脈阻塞導致腦缺血。結扎入口處,留線,縫合皮膚,同時經大鼠十二指腸給予相應的藥物。1.5 h后,輕輕提拉所留線頭至略有阻力,實現大腦中動脈再灌注,造模完成。模型成功的標志:動物麻醉清醒后出現缺血側Horner's征及對側前肢為主的偏癱,術后回籠飼養。在缺血1 h和再灌注1 h內注意維持大鼠的體溫在36.5~37.5 ℃。
1.2.3神經功能缺陷評分 按照隨機盲法原則對實驗大鼠進行2次評分,大鼠腦I/R術后清醒2 h,進行第1次評分;再灌注24 h后進行第2次評分。參照Longa等5分制評分標準,0 分:正常,無神經學征象;1分:動物不能完全伸展左前肢;2分:動物左側肢體癱瘓,行走時向左側轉圈,出現追尾現象;3分:動物行走向左側跌倒,或動物不能站立或打滾;4分:無自發活動,有意識障礙。神經功能缺陷評分在1~3分為造模成功。除假手術組外,各組0分(模型不成功)和4分(損傷過于嚴重,24 h內死亡)予以剔除,在后續試驗中補充剔除組的動物,以保證每組的動物數。
1.2.4透射電鏡檢查 MCAO手術后24 h,大鼠3.5%的水合氯醛(0.1 mL·kg-1)腹腔注射麻醉,鼠左心室灌注生理鹽水后,再灌注4%多聚甲醛,開顱取腦,于皮層距缺血中心外側緣1 mm處取一小塊組織,大小約 1 mm3。戊二醛固定,1%鋨酸后固定,系列丙酮脫水,環氧樹脂原位包埋,超薄(厚60 nm)切片,雙鉛染色,電鏡觀察照相。
1.2.5常規HE染色 大鼠3.5%的水合氯醛(0.1 mL·kg-1)腹腔注射麻醉,鼠左心室灌注生理鹽水后,再灌注4%多聚甲醛,開顱取腦,在固定液中固定24~48 h,脫水、透明、包埋、切片,進行常規HE染色。
1.2.6免疫熒光檢測神經元、星形膠質細胞形態 大鼠接3.5%的水合氯醛(0.1 mL·kg-1)腹腔注射麻醉,鼠左心室灌注生理鹽水后,再灌注4%多聚甲醛,開顱取腦,在固定液中固定24~48 h,脫水、透明、包埋、切片、脫蠟,封閉30 min,孵育目的蛋白,制好的切片4℃保存,在激光共聚焦顯微鏡下觀察。
1.2.7Western blot檢測蛋白水平 MCAO手術后24 h,大鼠3.5%水合氯醛(0.1 mL·kg-1)腹腔注射麻醉,斷頭處死大鼠。于皮層、海馬齒狀回和紋狀體距缺血中心外側緣1 mm 處取材,提取的腦組織按線粒體/胞質制備試劑盒說明書提取線粒體,裂解線粒體后BCA法測定蛋白含量,并定質量濃度至10 mg·L-1,進行蛋白表達檢測。蛋白含量測定后,進行聚丙烯酰胺凝膠電泳,采用相關抗體進行Western blot檢測。
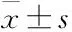
2 結果
2.1西紅花對大鼠局灶性腦I/R后2、24h神經行為學評分的影響與模型組比較,西紅花提取物可明顯降低I/R大鼠神經行為評分的分值,見Tab 1。

Tab 1 Neurological score of rats after
*P<0.05,**P<0.01vsmodel
2.2西紅花對大鼠局灶性腦I/R后缺血周邊半暗帶線粒體超微結構的影響如Fig 1所示,正常組鏡下可觀察到大量線粒體,雙層膜結構完整,線粒體嵴正常排列;模型組大鼠線粒體病變嚴重,線粒體腫脹,雙層膜結構缺失,線粒體嵴斷裂,細胞器數量減少。西紅花可有效減輕I/R引起的線粒體形態破壞,減輕神經元水腫損傷,線粒體內外膜機構較完整,線粒體腫脹及空泡狀改變減輕; 線粒體嵴的數目和形態趨于正常。

Fig 1 Ultrastructural morphology of mitochondria
A:Sham group(× 30 000); B:MCAO group (×50 000); C:Saffron crocus 3 mg·kg-1group(×50 000); D:Ginaton 28.8 mg·kg-1group(×50 000)
2.3西紅花對腦I/R損傷大鼠腦組織病理形態的影響如Fig 2所示,假手術組大鼠皮層未見明顯病理改變,神經元細胞結構正常,細胞排列層次分明,結構完整、胞質豐富;模型組皮層神經元細胞排列紊亂,細胞壞死,細胞核固縮深,著色變淺,神經元數目明顯減少。西紅花組較模型組病變減輕,皮層神經元少量變性,減輕核固縮和核溶解程度,抑制神經元的凋亡與壞死,較為明顯改善腦I/R損傷大鼠皮層缺血周邊半暗帶區神經元及突觸超微結構損傷。

Fig 2 Effect of saffron crocus on pathomorphologyof cerebral tissues in rats(×20)
A:Sham group; B:MCAO group; C:Saffron crocus 3 mg·kg-1group; D:Ginaton 28.8 mg·kg-1group
2.4西紅花苷對腦I/R損傷大鼠神經元、星形膠質細胞的影響如Fig 3所示,正常組神經元細胞結果正常(MAP2綠色熒光),星形膠質細胞形態正常(GFAP紅色熒光),而模型組可見神經元熒光強度降低,而星形膠質細胞大量增生,呈瘢痕狀;與模型組比較,西紅花3 mg·kg-1能明顯抑制神經元壞死,抑制星形膠質細胞增生。
2.5西紅花對局灶性腦I/R缺血周邊半暗帶Drp1、Opa1表達的影響缺血90 min/再灌注第24 h,以COV IV作為線粒體內參,發現在缺血周邊半暗帶的皮層Drp1表達明顯升高,Opa1表達降低,西紅花可有效下調Drp1表達,上調Opa1表達(P<0.01,P<0.05),見Fig 4。
3 討論
線粒體融合分裂的動態平衡是神經元末梢長距離運輸和能量平均分布的基本保證[7-8],在神經元內,突觸和樹突棘的形成與線粒體融合分裂的動態調節過程密切相關。線粒體不斷的融合分裂,從而控制細胞器的大小,有利于介導線粒體將能量運輸至高度分化神經元遠距離的樹突棘和軸突延伸區域。這種機制能確保高耗能區域有充足的ATP 供應,并對ATP 能進行合理的分配。然而,線粒體動力學異常使線粒體在神經元中的運輸受阻,線粒體分布紊亂,從而導致線粒體能量代謝效率降低和活性氧(reactive oxygen species,ROS)產量增加等。以上揭示了線粒體融合分裂異常可能是多數神經變性疾病的致病機制之一。
在哺乳動物中,線粒體的動態變化受多個線粒體融合分裂相關蛋白控制。在線粒體融合的過程中,定位于線粒體外膜和內膜的3種動力學相關GTP酶發揮了重要作用,即線粒體融合蛋白1(mitofusin1,Mfn1)、線粒體融合蛋白2(mitofusin2,Mfn2)和Opa1。其中,線粒體外膜的融合依賴兩種線粒體融合蛋白Mfn1和Mfn2,其主要功能是促進線粒體外膜的融合[9]。Mfn1、Mfn2的缺陷會導致線粒體融合障礙、出現大量碎片狀線粒體。線粒體內膜的融合由Opa1介導,除了參與線粒體融合的控制以外,Opa1對于線粒體嵴結構的維持非常重要,Opa1的缺失可導致線粒體嵴重構,引起細胞色素C釋放[10]。線粒體分裂指線粒體一分為二的過程,許多小分子蛋白質參與這一過程。其中,Drp1和分裂蛋白1(fission 1,Fis1)主要參與調控。Drp1存在于胞質中,而Fis1是一種定位在線粒體外膜的蛋白,主要作為一個受體負責招募Drp1到線粒體上,形成環狀結構,逐漸收縮致使線粒體分裂。實驗證實,Drp1基因高表達時可以加速線粒體的分裂,繼而產生大量碎片化的線粒體。線粒體的融合分裂與細胞的代謝、增殖、凋亡、自噬等各種功能密切相關。研究發現,抑制線粒體融合可導致線粒體斷裂,促使細胞凋亡。如Sugioka等[11]發現,下調HeLa細胞中Mfn1和Mfn2的表達,抑制了線粒體融合,出現線粒體斷裂,增加細胞對凋亡刺激的敏感性; 而過表達Mfn1和Mfn2在引起線粒體融合的同時,延緩了細胞凋亡。線粒體分裂后,膜電位相對高的子線粒體發生融合,而膜電位相對低的子線粒體發生自噬,因此,線粒體融合可使蛋白相互補充,代謝物均勻分配,突變DNA得以修復,保持細胞內線粒體的完整性和同質性[12]。而線粒體過度分裂致線粒體碎片化是細胞凋亡的標志階段,線粒體的碎片化導致線粒體外膜通透性增加,細胞色素C從線粒體釋放,激活caspase酶,從而促發凋亡[13]。本研究證實,大鼠腦I/R后,線粒體正常形態破壞,大腦皮層線粒體Drp1表達上升,Opa1表達下降,線粒體分裂融合失衡,因此,線粒體動力學異常可能是缺血性腦血管病的發病機制之一,并可能進一步導致神經元的凋亡與壞死。

Fig 3 Effect of saffron crocus on neurons, astrocytes in I/R rats(×20)

Fig 4 Effect of crocin on expressions of Drp1, Opa1 in brain of rats induced by
A:Protein levels of Drp1 and Opa1; B:Protein levels quantified by band gray-value ratio to COX IV.**P<0.01vssham;#P<0.05,##P<0.01vsMCAO.
目前已有研究報道發現,西紅花苷可降低腦I/R后腦梗死面積,并對神經元具有保護作用[14-15],且能明顯降低缺血皮層丙二醛(malondialdehyde,MDA)含量,提高谷胱甘肽過氧化物酶(glutathione peroxidase,GPx)和超氧化物歧化酶(superoxide dismutase,SOD)活性。從本研究可以看出,西紅花提取物可有效抑制大鼠腦缺血后神經元死亡,抑制星形膠質細胞過度增殖;進一步實驗觀察到,西紅花可以有效下調Drp1表達,上調Opa1表達。以上實驗證實了西紅花能改善腦缺血損傷導致的能量代謝異常,而其改善能量代謝的途徑可能是改善線粒體動力學異常,恢復線粒體正常的融合分裂。越來越多的研究證明,在許多神經系統疾病中,都存在線粒體融合分裂異常的情況,這提示了線粒體動力學異常可能是神經變性疾病的致病機制之一。因此,進一步探索腦缺血后線粒體分裂融合的變化及設立時間點尋找其變化規律,尋找相關藥物作用靶點,對于防治缺血性腦血管病、促進腦缺血后神經發生及記憶的恢復具有一定意義。
[1] 楊 晴, 李新宇. 全腦缺血/再灌注致線粒體損傷的研究進展[J]. 醫學綜述, 2011,17(11):1619-21.
[1] Yang Q, Li X Y. Advances in mitochondrial injury induced by complete cerebral ischemia-reperfusion[J].MedRecap, 2011,17(11):1619-21.
[2] Archer S L. Mitochondrial dynamics--mitochondrial fission and fusion in human diseases[J].NEnglJMed, 2013,369(23):2236-51.
[3] Helle S C J, Feng Q, Aebersold M J, et al. Mechanical force induces mitochondrial fission[J].Elife, 2017,6:1-26.
[4] Otera H, Ishihara N, Mihara K. New insights into the function and regulation of mitochondrial fission[J].BiochimBiophysActa, 2013,1833(5):1256-68.
[5] Pitsikas N, Zisopoulou S, Tarantilis P A, et al. Effects of the active constituents of Crocus sativus L., crocins on recognition and spatial rats' memory[J].BehavBrainRes, 2007,183(2):141-6.
[6] Zheng Y Q, Liu J X, Wang J N, Xu L. Effects of crocin on reperfusion-induced oxidative/nitrative injury to cerebral microvessels after global cerebral ischemia[J].BrainRes, 2007,1138:86-94.
[7] Sheng Z H, Cai Q. Mitochondrial transport in neurons:impact on synaptic homeostasis and neurodegeneration[J].NatRevNeurosci, 2012,13(2):77-93.
[8] Suarez-Rivero J M, Villanueva-Paz M, de la Cruz-Ojeda P, et al. Mitochondrial dynamics in mitochondrial diseases[J].Diseases, 2016,5(1):1-15.
[9] Chen H, Detmer S A, Ewald A J, et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development[J].JCellBiol, 2003,160(2):189-200.
[10] Olichon A, Baricault L, Gas N, et al. Loss of OPA1 perturbates the mitochondrial inner membrane structure and integrity, leading to cytochrome C release and apoptosis[J].JBiolChem, 2003,278(10):7743-6.
[11] Sugioka R, Shimizu S, Tsujimoto Y. Fzo1, a protein involved in mitochondrial fusion, inhibits apoptosis[J].JBiolChem, 2004,279(50):52726-34.
[12] Twig G, Elorza A, Molina A J, et al. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy[J].EMBOJ, 2008,27(2):433-46.
[13] Elgass K, Pakay J, Ryan M T, Palmer C S. Recent advances into the understanding of mitochondrial fission[J].BiochimBiophysActa, 2013,1833(1):150-61.
[14] Sarshoori J R, Asadi M H, Mohammadi M T. Neuroprotective effects of crocin on the histopathological alterations following brain ischemia-reperfusion injury in rat[J].IranJBasicMedSci, 2014,17(11):895-902.
[15] 張業昊, 叢偉紅, 劉建勛. 西紅花苷對缺氧復氧損傷的SH-SY5Y細胞線粒體動力學的影響[J]. 中國藥理學通報, 2016,32(7):986-91.
[15] Zhang Y H, Cong W H, Liu J X. Effect of crocin on mitochondrial dynamics in SH-SY5Y cells against injury induced by oxygen-glucose deprivation[J].ChinPharmacolBull,2016,32(7):986-91.