頭頂一顆珠對AD模型大鼠腦海馬組織Tau蛋白磷酸化及突觸發育的影響
陳 瑋,羅洪斌,2,3,4,魯文杰,牟南樵,黃 勝,陳 娟,樊莎莎,謝文執,商 楠,楊晨宇,謝楓楓,諶 勤
(湖北民族學院1.醫學院生物化學與分子生物學教研室、2.科技學院醫學系生物化學與分子生物學教研室、3. 生物資源保護與利用湖北省重點實驗室、4. 神經精神共患病研究所、5.附屬民大醫院神經內科,湖北 恩施 445000)
阿爾茨海默病(Azheimer’s disease, AD)是一種神經退行性疾病,也是最為常見的老年癡呆癥,隨著全球老齡化進程的不斷加快,其發病率也呈上升趨勢[1]。AD的主要臨床特征為進行性認知功能障礙,老年斑(amyloid-β protein, SP)、神經纖維纏結(neurofibrillary tangles, NFTs)、營養不良性神經炎和神經元功能受損為其主要病理特征[2]。SP是由細胞外淀粉樣前體蛋白(amyloid precursor protein, APP)異常分裂產生的毒性β淀粉樣肽1~40, 42(Aβ1~40, 42)堆積形成,NFTs是由細胞內Tau蛋白過度磷酸化異常聚集形成的[2]。同時,Tau蛋白的過度磷酸化還是AD早期病理學特征性改變,所形成的NFTs數量與患者癡呆程度相關[3],因此,通過抑制Tau的過度磷酸化應該是治療AD的關鍵。糖原合酶激酶3(glycogen synthase kinase 3,GSK-3)是一種多功能絲氨酸/蘇氨酸蛋白激酶,包含GSK-3α和GSK-3β兩種異構體。其中GSK-3β在促進Tau蛋白異常過度磷酸化、毒性Aβ的產生、營養不良性神經炎和神經元受損過程中都起著非常重要的作用[4],并通過PI3K/Akt信號通路發揮作用[4]。因此,尋找能影響其活性的藥物便成為防治AD的重要研究途徑。
傳統中藥在防治AD方面具有不可替代的優勢,因此有必要進行深入研究以尋找較為有效的中藥及其有效成分。頭頂一顆珠(TrilliumTschonoskiiMaxim, TTM)為百合科延齡草屬植物,為傳統土家中藥,多產于鄂西山區,為當地四大神藥之一,主要功效為鎮靜安神、活血止血、祛痰除瘀等[5]。近年來的研究發現,TTM具有潛在的治療AD作用[6],并有抗氧化、延緩衰老之療效[6]。因此,有必要針對TTM對AD的防治作用進行深入研究,并掌握其詳細作用機制,促進該藥開發利用。
1 材料與方法
1.1藥物與試劑TTM購自湖北華潤新龍(恩施)醫藥有限公司,并經專家文德鑒副教授鑒定。根據臨床用藥人的劑量(60 kg)為標準,文獻記載[5]TTM臨床標準劑量為5~6 g,每人用藥劑量為0.083 g·kg-1·d-1,成人與大鼠的折算系數為6.25,其相對于人的臨床用量大鼠等效劑量為0.083×6.25=0.5 g·kg-1·d-1。換算成大鼠(250 g為標準體質量)的低、中、高劑量分別為0.125、0.25、0.5 g·kg-1·d-1,換算根據《藥理實驗中動物間和動物與人體間的等效劑量換算》進行計算。其水煎液制備方法:稱量20 g TTM,提前1 d水充分浸泡,d 2加適量水煎煮1 h,煎煮2次,合并藥液,紗布過濾,再低速離心棄底下沉淀物,得到上清液,再濃縮定量至0.2 kg·L-1的溶液,保存備用。GF-109203X (GFX):英國Tocris公司;Wortmannin (WT):美國Millipore公司;超敏二步法免疫組化檢測試劑盒:中國北京中杉金橋生物技術有限公司;GSK-3β抗體:美國Cell Signaling Technology公司;S9-GSK-3β、pT205、pT231、pS262、pT356、pS396、pS404抗體:美國SAB公司;Tau-5抗體:美國Abcam公司;β-actin抗體:美國Proteintech公司;BCA蛋白測定試劑盒、DAB顯色試劑盒:中國康為世紀生物科技有限公司。
1.2儀器DMS-2型Morris水迷宮系統(中國醫學科學院藥物研究所);大鼠68002雙臂腦定位儀(中國瑞沃德生命科技有限公司);099CK5424電動勻漿機(美國GLAS-COL公司);FDL-400S超聲儀(中國凡辛朗科技有限公司);1510全波長酶標儀(美國Thermo Fisher Scientific公司); Odyssey掃描儀(Licor biosciences,美國Gene Company);電泳儀電源、垂直電泳槽、濕轉槽(美國Bio-Rad公司); VT1200S振蕩切片機(德國Leica公司)。
1.3實驗動物與分組購自湖北省實驗動物研究中心的♂SD大鼠,合格證號42000600003985,該中心許可證號SCK(鄂)2015-0018。大鼠體質量(250±30)g,50只,自由進食飲水1周后隨機分配為5組:假手術組、AD模型組、高、中、低TTM治療組、每組10只。
1.4AD模型的建立及給藥和Morris水迷宮訓練給藥組均按每只SD大鼠體質量給予足量TTM的水煎液灌胃7 d,假手術組和AD模型組則灌胃飲用水7 d。從灌胃d 2開始進行水迷宮訓練,訓練5 d后,尋找能在15 s內找到隱藏平臺的SD大鼠(其搜索軌跡應簡單、筆直)用于以下實驗[7]。訓練d 6,再行側腦室注射WT+GFX各5 μL(將WT和GFX均溶于2% DMSO中,濃度均為100 μmol·L-1)造模[8]。假手術組給予10 μL的2% DMSO。術后給予溫暖環境,待大鼠蘇醒。24 h后立即進行Morris水迷宮測試。其訓練和測試方法均參照文獻[7],并做適當修改。記錄實驗大鼠尋找平臺的潛伏期和游泳軌跡。
1.5海馬勻漿蛋白Westernblot分析Morris水迷宮測試完后,立即斷頭取腦,并在冰上快速分離出完整海馬,勻漿后行Western blot(WB)實驗,參照本課題組前期建立實驗方法完成[12-13]。一抗分別為Tau蛋白多個磷酸化位點(p-Tau)以及GSK-3β、S9-GSK-3β、PKC、PI3K、Akt、突觸囊泡素(Synaptophysin)和突觸素-1(Synapsin-1)等。熒光二抗孵育1 h后,用1×TBST洗滌3次,每次10 min。最后Odyssey掃描成像顯色分析,使用其專有軟件分析灰度值。
1.6腦片免疫組化法(immunohistochemistry,IHC)染色大鼠迷宮測試完后,7%水合氯醛麻醉大鼠,固定后,參照文獻方法[7]行4%多聚甲醛液灌流內固定,取完整大腦后,再用4%多聚甲醛繼續后固定。振蕩切片機切完整腦片,保存于含0.02%的疊氮鈉PBS液中備用。取有完整海馬的腦片行IHC法染色,詳見文獻[7]。一抗抗體為Tau蛋白第404磷酸化位點抗體(pS404)(1 ∶100)。結束實驗后再用中性樹膠封片,顯微鏡下觀察拍照。
1.7腦片尼氏染色(Nisslstaining) 取海馬清楚的完整腦片置于16孔平板中。1×PBS洗滌3次,每次5 min。吸取適量尼氏染色液滴于腦片上,37℃染色10~15 min,ddH2O洗凈,乙醇梯度脫水,二甲苯透明,最后中性樹膠封片,顯微鏡下觀察拍照。
1.8高爾基染色(Golgistaining) 水迷宮測試完后,上述同樣藥物麻醉,固定后,按參考文獻方法[7]依次用沖洗液、固定液、媒染液體內灌流,灌流完畢后,取腦,切開兩個半球,再橫切成3等份。用新鮮媒染液泡3 d,每天更換新鮮媒染液。3 d后用1.5% AgNO3溶液在搖床里鍍銀,搖晃清洗3次,直至置換出的液體清亮,之后置于暗處鍍銀3 d,每日換新鮮的1.5% AgNO3溶液。在暗處配好2%重鉻酸鉀水溶液,把腦塊置于其中切片,35~40 μm厚度,染色30 min,染色結束后用雙蒸水清洗1 min×2次,貼片,脫水,透明,封片。
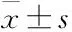
2 結果
2.1TTM對AD模型大鼠空間認知功能的影響Fig 1水迷宮實驗結果發現,注射WT+GFX后,大鼠尋找平臺的潛伏期與對照組相比均明顯延長(P<0.01),表明該AD模型大鼠空間學習記憶力明顯被抑制。而預先給予低、中、高劑量TTM可明顯改善AD模型大鼠空間學習認知障礙(P<0.05),其逃避潛伏期明顯縮短,并具有劑量依賴性(Fig 1A)。同時,TTM各治療組大鼠其搜尋策略均明顯改善,游泳軌跡接近直線(Fig 1B)。上述結果表明,不管是低、中劑量的TTM,還是高劑量的TTM均能有效改善WT+GFX激活GSK-3β活性所誘導的大鼠空間學習記憶障礙。
2.2TTM對AD模型大鼠腦海馬組織中GSK-3β活性的影響Western blot結果顯示(Fig 2A、2B),AD模型鼠腦海馬中表示非活性狀態的GSK-3β(GSK-3β第9位絲氨酸被磷酸化,即S9-GSK-3β)表達比對照組降低,其與總GSK-3β表達量的比值明顯下降,差異具有統計學意義(P<0.05),表明造模成功。對比模型組,TTM低、中、高治療組的S9-GSK-3β表達水平升高,其與總GSK-3β表達量的比值也升高,并差異具統計學意義(P<0.01)。結果表明,低、中、高劑量的TTM均能有效降低GSK-3β活性,且有劑量依賴性。同時檢測了PKC、PI3K、Akt等的表達情況及其磷酸化水平,結果發現,TTM組的p-PKC、p-Akt磷酸化水平比模型組高,說明用藥組PKC和Akt活性升高(Fig 2C、2D),這一結果提示,TTM能通過上調PKC和Akt活性,抑制下游GSK-3β的活性。
Fig 1 TTM prevents rats from WT+GFX induced spatial
A: TTM shortened the escape latency of WT+GFX injected SD rats in a dose-dependent manner; B: TTM improved the swimming pathway which was recorded 24 h after the injection of WT+GFX (after).**P<0.01vscontrol;##P<0.01vsbefore WT+GFX injection;ΔP<0.05vsafter WT+GFX injection.
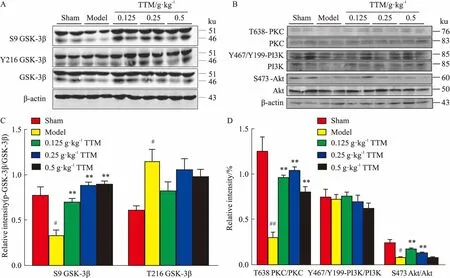
Fig 2 Effects of TTM on WT+GFX induced overactivation of
A: Western blot results showed the activity of GSK-3β in AD model group increased compared with blank group and TTM inhibited the high activity of GSK-3β induced by WT+GFX; B: TTM up-regulated the level of S9 GSK-3β phosphorylation and the results had statistical significance; C: Western blot results showed the activity of PKC and Akt in AD model group decreased compared with blank group and TTM increased the high activity of PKC and Akt induced by WT+GFX; D: TTM up-regulated the level of T636 PKC phosphorylation and S473 Akt phosphorylation and the results had statistical significance.#P<0.05,##P<0.01vscontrol(DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
2.3TTM對AD模型大鼠腦海馬Tau蛋白磷酸化的影響為了研究TTM對海馬Tau蛋白磷酸化的影響,分別進行WB和IHC實驗。WB結果證明,AD模型組Tau蛋白pT205、pT231、pS356、pS396、pS404等5個位點磷酸化水平高于對照組,且差異有統計學意義(P<0.01,P<0.05)。TTM預處理后,Tau蛋白多個位點磷酸化水平下降,如pT205、pT231、pS356、pS396、pS404位點均下降,且差異有統計學意義(P<0.01和P<0.05),見Fig 3A、3B。結果表明,TTM對AD大鼠腦海馬Tau蛋白磷酸化水平有明顯下調作用。IHC主要觀察各組海馬區Tau蛋白第404絲氨酸位點磷酸化水平。結果發現,模型大鼠海馬CA3和CA1區其Tau蛋白第404絲氨酸磷酸化水平明顯高于陰性對照組。而TTM低、中劑量組,CA3和CA1區Tau蛋白404絲氨酸位點磷酸化水平明顯改善(P<0.01,P<0.05)。這一結果和WB結果一致,見Fig 3C、3D。
2.4TTM對AD大鼠腦海馬突觸蛋白表達的影響Western blot結果發現,低、中、高劑量TTM均能有效促進AD大鼠的Synapsin-1、Synaptophysin、GluR-1等突觸蛋白的表達,其中3個用藥組Synapsin-1表達量均高于模型組(P<0.05),Synaptophysin的表達增多明顯(P<0.01),二者具有劑量依賴性。3個用藥組GluR-1表達量也明顯增多(P<0.01),上述結果差異均具有統計學意義,見Fig 4A、4B。提示不同劑量的TTM可通過增加AD大鼠突觸蛋白的表達,達到改善認知功能障礙的目的。
2.5尼氏染色法結果尼氏小體是顯示神經細胞功能活性的一個重要指標,在神經元受到損害時,尼氏小體會從核周向外緩慢溶解,發展至完全消失,但該病變可逆。本實驗結果發現,模型組腦海馬CA1和CA3區神經元數量減少,著色較淺,胞體萎縮并呈空泡狀,尼氏小體明顯減少。但TTM中、高劑量組大鼠腦海馬的CA1和CA3區尼氏小體數量增多,胞體飽滿,著色較深,細胞核大圓,呈劑量依賴性。提示中、高劑量的TTM有助于修復AD大鼠神經元活性,促進神經發育(Fig 5A、5B)。
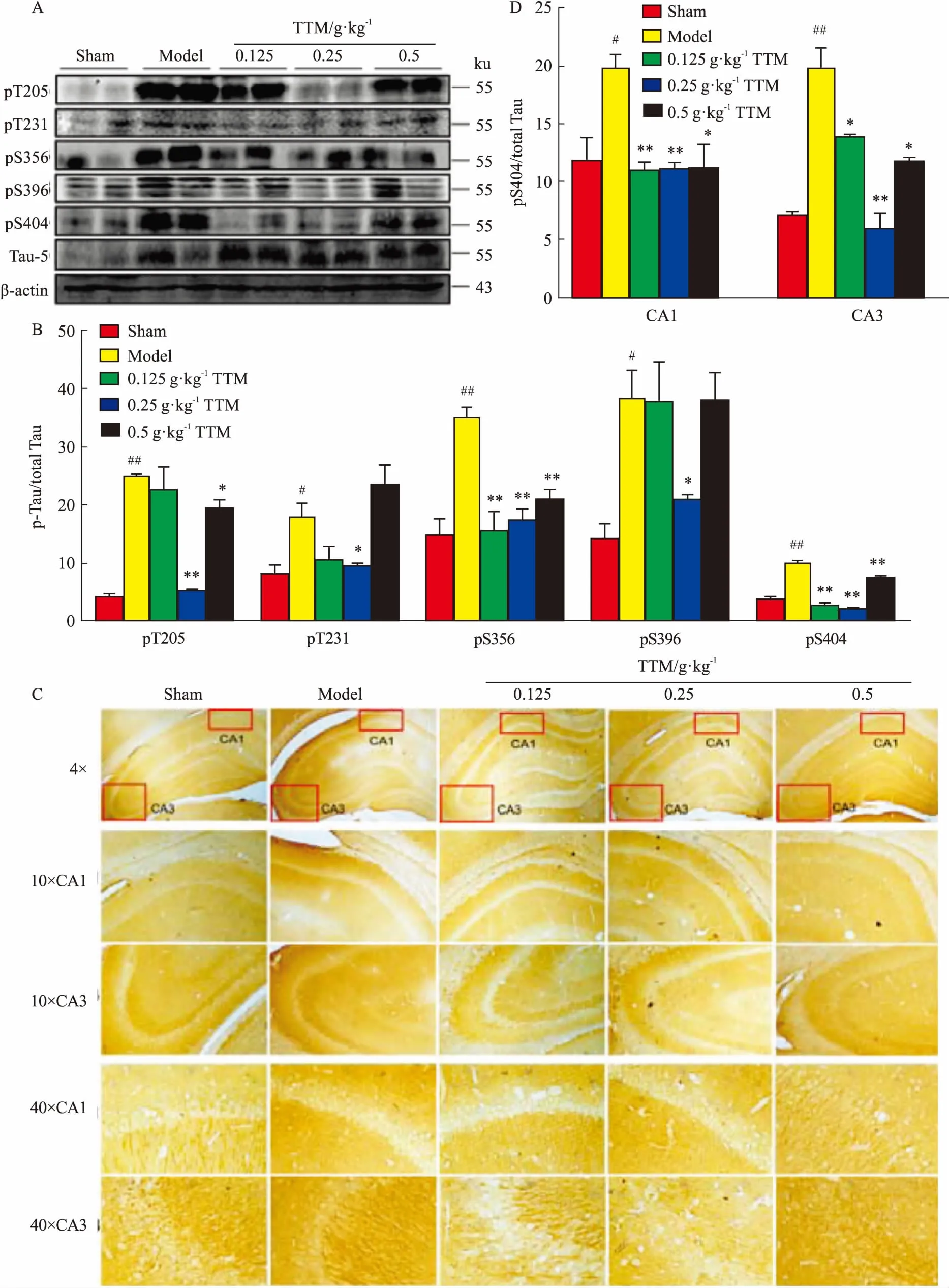
Fig 3 Effects of TTM on WT+GFX induced Tau hyperphosphorylation in SD rat
A: Western blot results showed the level of multiple phosphorylation sites of Tau in AD model group rat hippocampus was observably up-regulated than control group, which could be down-regualted by TTM; B: Western blot results of multiple phosphorylation sites of Tau had statistical significance; C: Immunohistochemistry results showed the level of Tau S404 phosphorylation in AD model group observably increased compared with control group in the area of CA1 and CA3, which could be decreased by TTM; D: The immunohistochemistry results of Tau S404 phosphorylation had statistical significance.#P<0.05,##P<0.01vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
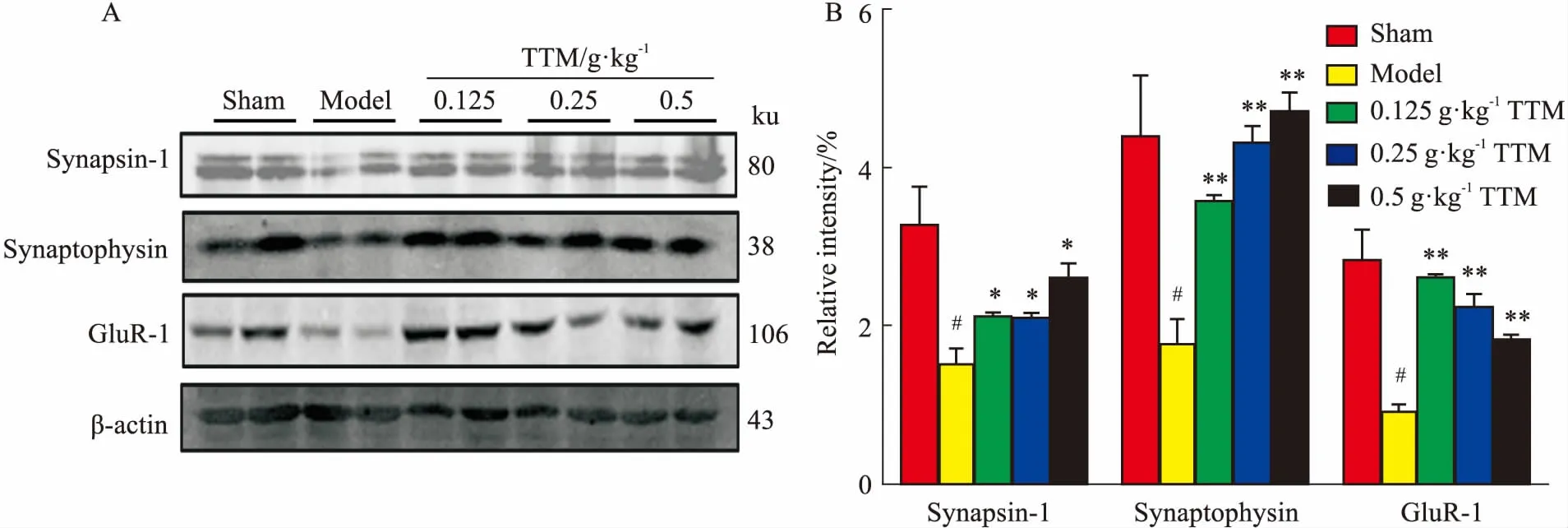
Fig 4 Effects of TTM on WT+GFX induced expression of
A: Western blot research showed the level of synapsin-1, synaptophysin and gluR-1 in AD model group rat hippocampas was down-regulated compared with blank group. Compared with AD model group, TTM up-regulated the level of synapsin-1, synaptophysin and gluR-1; B: TTM up-regulated the level of synapsin-1, synaptophysin and gluR-1 and results had statistical significance.#P<0.05vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
2.6TTM對AD大鼠海馬神經元樹突的影響與模型組相比,高爾基染色結果顯示,TTM中、高劑量組CA1區錐體細胞的頂樹突和基樹突的分支數增多,差異有統計學意義(P<0.01),見Fig 6A、6B。而低、中、高劑量組DG區顆粒細胞中軸突長度明顯增長,且樹突分支數明顯增多(P<0.01),見Fig 6C、6D。以上結果表明,中、高劑量TTM能明顯增加AD大鼠腦海馬CA1和DG區樹突復雜性。另外,TTM中、高劑量組CA1區錐體細胞頂樹突三級分支的樹突棘密度明顯增加(P<0.01),見Fig 6E;而在DG區顆粒細胞中3個用藥組蘑菇型樹突棘(Fig 6F、6G)密度明顯高于模型組,且呈劑量依賴性(P<0.01),瘦長型小棘在中、高劑量組增加(P<0.01),見Fig 6H。結果表明,中、高劑量TTM明顯改善AD大鼠海馬區CA1和DG區樹突棘密度,中劑量TTM促進瘦長型小棘發育,高劑量TTM對蘑菇型小棘和瘦長型小棘均有明顯促進發育作用。
3 討論
TTM作為土家族特色藥材,具有鎮靜安神、活血化瘀等功效[5],對新生大鼠缺血/缺氧腦損傷具有保護作用[9]。本課題組前期研究發現,TTM對岡田酸 (okadaic acid, OA) 誘導的AD大鼠腦海馬具有抗氧化作用[6],說明該藥對AD防治具有潛在研究價值,有必要深入研究。同時很多文獻證實,GSK-3β活性升高是產生NFT和SP的重要原因[6]。因此,有理由認為通過降低GSK-3β活性可成為治療AD希望所在[10],但目前尚無特效藥物,部分中藥卻有此作用[11],有必要在更廣范圍內尋找有效藥物。因此,我們構建了過度激活GSK-3β的AD大鼠模型,利用PI3K特異性阻斷劑Wortmannin和蛋白激酶C (PKC) 特異性抑制劑 (GF-109203X, GFX)行側腦室注射,激活GSK-3β,并引起Tau蛋白異常過度磷酸化[8],然后探討TTM能否通過這一途徑治療AD。
首先,水迷宮結果發現,注射WT+GFX導致大鼠空間認知功能下降,記憶力減退,而該模型大鼠運用低、中、高劑量TTM后,明顯改善了其空間認知功能障礙和定向航行能力,此效應具有劑量依賴性。該結果表明,TTM在行為學方面能有效改善AD大鼠認知功能障礙。如前所述,GSK-3β活性升高是導致NFT和SP產生的重要原因,因此,我們首先通過WB檢測了GSK-3β活性情況,結果發現,模型組大鼠腦海馬內GSK-3β的S9位點磷酸化水平(S9-GSK-3β)下調,而該位點磷酸化水平代表GSK-3β非活性狀態[6],TTM逆轉了模型大鼠海馬內GSK-3β的S9位點磷酸化水平。這一結果表明TTM能下調GSK-3β的活性。在GSK-3β信號通路中,其活性變化是由其上游激酶PKC、Akt和PI3K進行負性調節。因此,我們又檢測了TTM用藥后該3個激酶活性,結果顯示,不同劑量的TTM均能上調注射了WT+GFX的大鼠腦海馬組織中PKC 和Akt活性。這一結果提示TTM是通過上調PKC和Akt活性,進而抑制下游GSK-3β活性。由于Tau蛋白過度磷酸化在AD中是導致認知功能障礙的重要因素,而過度磷酸化的Tau蛋白對NTFs數量和分布影響及認知功能缺陷呈正相關[4-5]。因此,我們又研究了TTM能否通過改變GSK-3β活性,進而下調模型鼠腦海馬Tau蛋白磷酸化水平。WB和IHC結果顯示,預先給予低、中、高劑量TTM后,即使側腦室注射WT+GFX,也能在腦海馬的Tau蛋白多個磷酸化位點不同程度地抑制其磷酸化水平,說明TTM對Tau蛋白磷酸化具有防治作用。
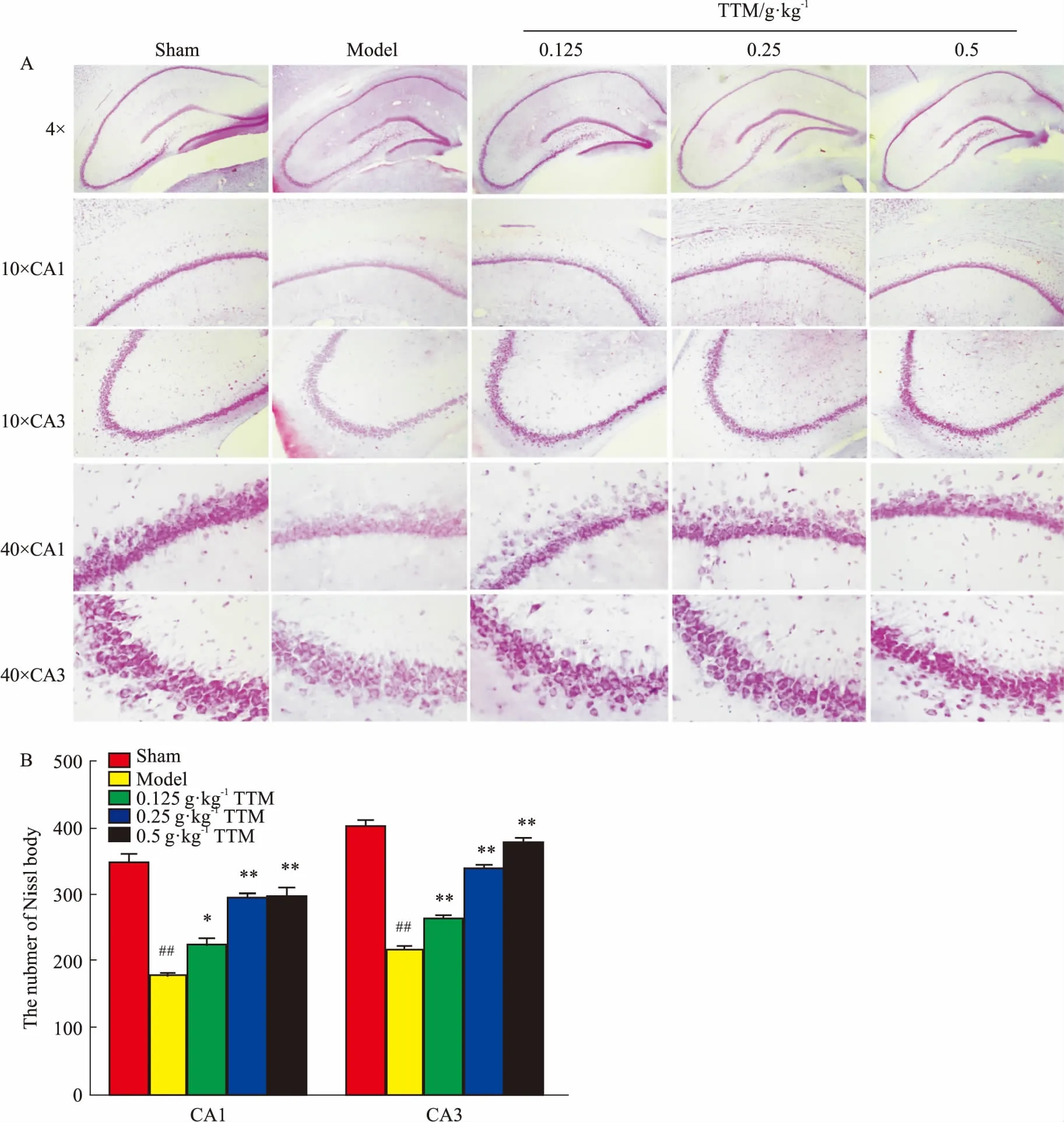
Fig5EffectsofTTMonWT+GFXinducedNisslbodiesdecreasedinSDrat
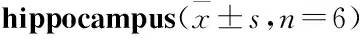
A:Nissl’s staining results showed the number of Nissl’s bodies in neuron cells of hippocampus on hippocampal CA1 and CA3 was obviously fewer than those in control group, which could be markedly increased by TTM; B: Nissl’s staining results of the number of Nissl’s bodies had statistical significance.##P<0.01vscontrol (DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
突觸是傳遞信息的重要組織結構,突觸互相交叉形成大腦信息網絡,突觸蛋白的表達對學習記憶有密切聯系。有研究表明,AD患者腦海馬中突觸相關蛋白明顯減少[12]。本實驗結果發現,模型組大鼠腦海馬突觸相關蛋白Synapsin-1、Synaptophysin和GluR-1表達明顯減少,而TTM用藥組的Synapsin-1、Synaptophysin和GluR-1蛋白表達比模型組明顯增加,提示TTM能恢復或保護突觸結構與功能從而改善學習記憶能力。
在細胞質中有特別的細胞器—尼氏小體。尼氏小體又稱核蛋白體,是合成蛋白質的場所。當神經元受損時,尼氏小體會減少甚至消失,這種病理改變是可逆的[13]。本實驗結果發現,各劑量TTM均能恢復或保護尼氏小體,其中又以中、高劑量組為甚,提示TTM能通過作用于尼氏小體來修復或改善大鼠海馬受損的神經元。
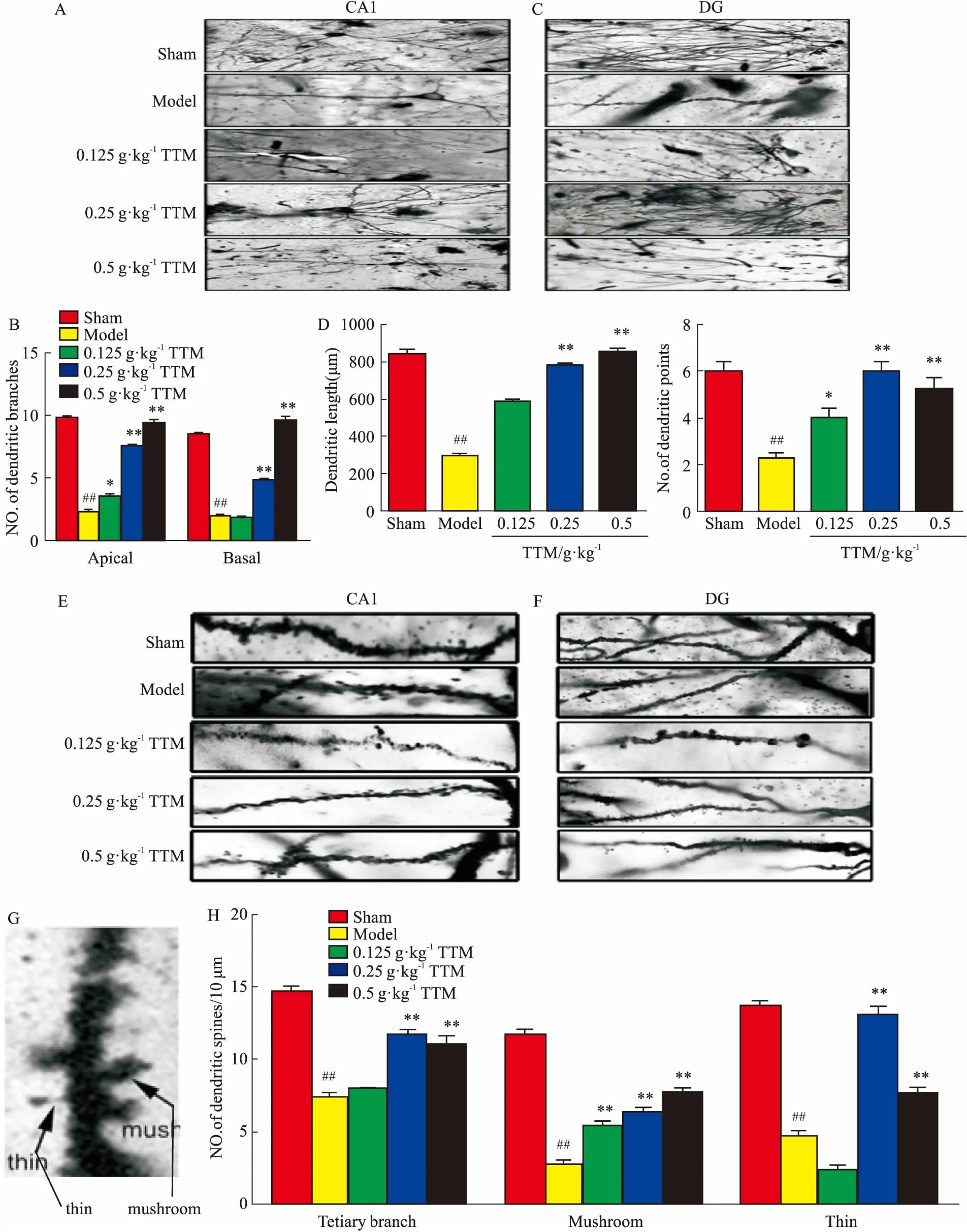
Fig 6 Effects of TTM on WT+GFX induced dendritic spines decreased in SD rat
A: Golgi staining results showed that the number of apical dendrites and radical dendrites on hippocampal CA1 and DG was obviously less than that in blank group, which could be markedly increased by TTM; B: Golgi staining results of the number of apical dendrites and radical dendrites had statistical significance; C: Golgi staining results showed the length axons and dendritic branches on hippocampal DG was obviously shorter and less than that in blank group, and TTM markedly lengthed axons and increased dendritic branch; D: Golgi staining results of the length axons and dendritic branches had statistical significance; E, F and G: Golgi staining results showed the dendritic spine density in hippocampus on hippocampal CA1 was apparently less than in blank group, the mushroom and slender (thin) dendritic spines density on hippocampus CA1 and DG was apparently less than in blank group, which could be dramatically increased by TTM; H: Golgi staining results of the dendritic spines density and the mushroom and slender (thin) dendritic spines density had statistical significance;##P<0.01vscontrol(DMSO);*P<0.05,**P<0.01vsWT+GFX injection.
樹突是由胞體發出,由一支發叉分出多支,表面伸出許多小突起稱為小棘,在AD患者大腦海馬中樹突分支和樹突棘均減少,導致接受刺激減少,引起學習記憶功能障礙[14]。在本實驗中我們發現,AD大鼠海馬中CA1和DG區運用中、高劑量TTM后,其樹突復雜性明顯增高,說明TTM能促進樹突發育。小棘又分成很多類型,有瘦長型、蘑菇型、豆芽型等,一般把蘑菇型稱為記憶性小棘,瘦長型稱為學習型小棘[15],目前廣泛認為蘑菇型小棘對學習記憶有較大的促進作用,有研究發現,瘦長型小棘對學習記憶的促進作用比蘑菇型更有效、更穩定[15]。本實驗Golgi染色結果顯示中、高劑量TTM明顯增加CA1和DG區樹突棘數量,中劑量組瘦長型樹突小棘增加更明顯,而高劑量組蘑菇型增加更明顯,可能不同劑量的藥物對不同類型的小棘影響各異,但均能改善樹突可塑性。
綜上所述,本實驗眾多結果提示,TTM對GSK-3β誘導的AD模型大鼠腦海馬組織中Tau蛋白磷酸化、神經發育及突觸相關蛋白表達等方面均有明顯的防治作用,同時還可促進海馬組織內樹突發育的復雜性和尼氏體修復,最終達到改善AD模型大鼠學習記憶功能。這些發現為AD治療提供一種新的藥物選擇,也可為TTM的開發利用提供實驗依據和基礎資料。
[1] Hottman D A, Li L. Protein prenylation and synaptic plasticity: implications for Alzheimer's disease[J].MolNeurobiol, 2014,50(1):177-85.
[2] Revett T J, Baker G B, Jhamandas J, et al. Glutamate system, amyloid β peptides and Tau protein: functional interrelationships and relevance to Alzheimer disease pathology[J].JPsychiatryNeurosci, 2013,38(1):6-23.
[3] Khan S S, Bloom G S. Tau: the center of a signaling nexus in Alzheimer's disease[J].FrontNeurosci, 2016,10(1):31.
[4] Takashima A. GSK-3 is essential in the pathogenesis of Alzheimer’s disease [J].JAlzheimersDis, 2006,9(3 Suppl): 309-17.
[5] 方志先,趙 暉,趙敬華. 土家族藥物志“上冊”[M]. 北京:中國醫藥科技出版社, 2007:371-2.
[5] Fang X Z, Zhao H, Zhao J H. Tujia Nationality Medicine Record, 1st volume[M]. Beijing: The Medicine Science and Technology Press of China, 2007:371-2.
[6] 黃麗亞,羅洪斌,張 宏. 頭頂一顆珠對崗田酸致阿爾茨海默病大鼠腦組織抗氧化酶和過氧化脂質的影響[J]. 中國老年學雜志,2008,28(18):1771-2.
[6] Huang L Y, Luo H B, Zhang H, et a1. The effect of' TTM on anti-oxidase and lipase peroxide in brain tissues of Alzheimer disease rats induced by okadiac acid[J].ChinJGerontol, 2008,28(18): 1771-2.
[7] 姜 霞,王建枝. L-肉毒堿在Alzheimer樣Tau蛋白過度磷酸化和空間記憶障礙中的保護作用[D]. 武漢:華中科技大學,2008.
[7] Jiang X. Effect of L-carnitine on Alzheimer-like Tau hyperphosphorylation and spatial memory retention deficits[D]. Wuhan: Huazhong University of Science and Technology(HUST),2008.
[8] 王建枝. 一種早老性癡呆大鼠動物模型的構建方法[P]. 2005-07-13.
[8] Wang J Z. The method for constructing rat model of Alzheimer's disease[P]. July 13, 2005.
[9] 邱 勇,李人鵬,劉 粟,等. 頭頂一顆珠醇提物對新生大鼠缺血/缺氧性腦損傷的保護作用[J]. 中國藥理學通報, 2016,32(11):1548-52.
[9] Qiu Y, Li R P, Liu S, et al. The protective effects of ethanol extract of Trillium tschonoskii Maxim. On hypoxia-ischemia brain damage in neonatal rats[J].ChinPharmacolBull, 2016,32(11):1548-52.
[10] King M K, Pardo M, Cheng Y, et al. Glycogen synthase kinase-3 inhibitors: rescuers of cognitive impairments[J].PharmacolTher, 2014,141(1): 1-12.
[11] 羅洪斌,劉翔宇,牟南樵,等. 板橋黨參對激活GSK-3β誘導的AD模型大鼠認知功能障礙的保護作用及其機制[J]. 中國藥理學通報, 2017,33(8):1060-7.
[11] Luo H B,Liu X Y,Mou N Q. Banqiao Codonopisis Pilosula improving cognitive dysfunction induced by high GSK-3β activity and its possible mechanism [J].ChinPharmacolBull, 2017,33(8): 1060-7.
[12] Salgado-Puga K, Rodriguez-Colorado J, Prado-Alcala R A, et al. Subclinical doses of ATP-sensitive potassium channel modulators prevent alterations in memory and synaptic plasticity induced by amyloid-β[J].JAlzheimersDis, 2017,57(1): 205-26.
[13] Roof R L, Schielke G P, Ren X, et al. A comparison of long-term functional outcome after 2 middle cerebral artery occlusion models in rats[J].Stroke, 2001,32(11): 2648-57.
[14] Tronel S, Fabre A, Charrier V, et al. Spatial learning sculpts the dendritic arbor of adult-born hippocampal neurons[J].ProcNatlAcadSciUSA, 2010,107(17): 7963-8.
[15] Spacek J, Harris K M. Three-dimensional organization of smooth endoplasmic reticulum in hippocampal CA1 dendrites and dendritic spines of the immature and mature rat[J].JNeurosci, 1997,17(1):190-203.