循環(huán)微囊泡miR-27a參與腦缺血小鼠血腦屏障緊密連接損傷的機(jī)制研究
呂燕妮,付龍生,錢(qián)貽崧
(1. 南昌大學(xué)第一附屬醫(yī)院藥學(xué)部,江西 南昌 330006;2. 南昌大學(xué)轉(zhuǎn)化醫(yī)學(xué)研究院心血管疾病研究中心,江西 南昌 330001)
腦血管疾病具有發(fā)病率高、致殘率高、死亡率高等危害,其中約85%為缺血性腦損傷。在腦部缺血的病理?yè)p傷過(guò)程中,血腦屏障這一維持中樞神經(jīng)系統(tǒng)穩(wěn)態(tài)的自身屏障結(jié)構(gòu)和功能改變,引起血腦屏障調(diào)控失衡,并最終導(dǎo)致腦損傷。緊密連接是血腦屏障結(jié)構(gòu)和功能完整性的重要基礎(chǔ),維系缺血區(qū)血腦屏障緊密連接結(jié)構(gòu)[1],對(duì)缺血性腦損傷及其后遺癥的發(fā)生、發(fā)展具有重要意義。臨床現(xiàn)有針對(duì)改善腦缺血的治療方式,如溶栓、抗血小板、改善循環(huán)等,是以恢復(fù)和改善血流再通的基礎(chǔ)治療手段,對(duì)血腦屏障損傷難有實(shí)質(zhì)性改善,其機(jī)制也不十分明確。細(xì)胞微囊泡(microvesicles, MVs)含有蛋白質(zhì)、mRNA、miRNAs等多種信息物質(zhì),在機(jī)體內(nèi)環(huán)境變化時(shí),可通過(guò)分泌至鄰近細(xì)胞或組織,介導(dǎo)細(xì)胞間通訊。微囊泡本身可作為輔助診斷缺血性腦梗死、動(dòng)脈粥樣硬化疾病發(fā)生和發(fā)展的生物標(biāo)志物[2]。然而,微囊泡跨血腦屏障對(duì)中樞神經(jīng)系統(tǒng)的調(diào)控機(jī)制目前尚未完全闡明,深入研究能夠?yàn)槿毖阅X血管疾病的分子機(jī)制和治療提供全新的研究方向。本實(shí)驗(yàn)建立小鼠大腦中動(dòng)脈栓塞(middle cerebral artery occlusion, MCAO)模型,提取缺血腦組織中的微囊泡,以注射微囊泡的方式探討微囊泡對(duì)小鼠缺血腦組織損傷的影響及相關(guān)機(jī)制。
1 材料與方法
1.1材料
1.1.1實(shí)驗(yàn)動(dòng)物 ♂SPF級(jí)C57BL/6J小鼠,3月齡,72只,體質(zhì)量(18~22) g,由揚(yáng)州大學(xué)比較醫(yī)學(xué)中心提供,動(dòng)物許可證號(hào):SCXK(蘇)2007-0001。小鼠飼養(yǎng)于南昌大學(xué)第一附屬醫(yī)院12 h光暗循環(huán)的中心實(shí)驗(yàn)室,飼養(yǎng)環(huán)境溫度為(22±2)℃,濕度為40%~60%,給予過(guò)濾水和營(yíng)養(yǎng)飼料。
1.1.2試劑 抗occludin、claudin-5抗體為Abcam公司產(chǎn)品;occludin和claudin-5免疫組化抗體購(gòu)自美國(guó)Zyemd公司;TLR4、β-actin、NF-κB p65、p38、p-NF-κB p65、p-p38抗體為CST公司產(chǎn)品;miR-27a序列及U6購(gòu)自上海吉?jiǎng)P基因化學(xué)技術(shù)有限公司;小鼠白細(xì)胞介素1β(interleukin 1β,IL-1β)和腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)檢測(cè)試劑盒購(gòu)自南京建成生物工程研究所;其余試劑為國(guó)產(chǎn)分析純。
1.1.3儀器 100000NWCO超濾膜、Model 8050旋轉(zhuǎn)超濾儀(美國(guó)Millipore公司);iZON顆粒分析儀(英國(guó)Malvern公司);電泳儀、實(shí)時(shí)定量PCR儀(美國(guó)Bio-Rad公司);透射電鏡(日本JEOL公司);激光共聚焦顯微鏡(美國(guó)Thorlabs公司)。
1.2微囊泡提取鑒定及微囊泡miR-27a表達(dá)測(cè)定設(shè)立假手術(shù)組和缺血2 h組。建立MCAO缺血模型,10 mL·kg-1腹腔注射4%水合氯醛麻醉,分離并暴露小鼠右側(cè)的頸總動(dòng)脈、頸外動(dòng)脈及頸內(nèi)動(dòng)脈,近心端預(yù)留結(jié)扎線。于頸外動(dòng)脈遠(yuǎn)心端切口,插入直徑約0.2 mm的線栓,通過(guò)頸總動(dòng)脈分叉進(jìn)入頸內(nèi)動(dòng)脈,過(guò)頸總動(dòng)脈分叉8 mm后傷口常規(guī)縫合。手術(shù)過(guò)程中觀察小鼠生命體征并檢測(cè)缺血側(cè)腦血流,棄去手術(shù)超過(guò)15 min或手術(shù)中出血、麻醉過(guò)深及基準(zhǔn)血流30%以下的小鼠,術(shù)中小鼠肛溫維持在37℃。缺血2 h后,各組小鼠斷頭取血后,分離血清并-80℃保存。取600 μL凍存血清置于25℃水浴溶解后,4℃ 300×g離心10 min,取上清液,再2 000×g離心20 min取上清液,經(jīng)0.22 μm孔徑過(guò)濾后,加入100000 NWCO超濾膜的Model 8050旋轉(zhuǎn)超濾儀中,氮?dú)饧白畲筮M(jìn)氣壓力517.125 kPa以下,渦旋上清液并過(guò)濾。過(guò)濾物50 mL PBS超濾3次,得過(guò)濾膜上微囊泡,-80℃保存?zhèn)溆肹3]。微囊泡經(jīng)iZON顆粒分析儀檢測(cè)直徑。
1.3股靜脈注射微囊泡及動(dòng)物分組實(shí)驗(yàn)動(dòng)物分為4組,每組6只,分別為假手術(shù)組、缺血2 h組、注射微囊泡+缺血2 h組、阻斷劑antagomiR-27a+注射微囊泡+缺血2 h組。阻斷劑antagomiR-27a組為尾靜脈注射溶于200 μL PBS的miR-27a阻斷劑antagomiR-27a(20 mg·kg-1),連續(xù)注射3 d;注射微囊泡為缺血0.5 h時(shí),自股靜脈以5 mg·kg-1注射溶于生理鹽水的微囊泡溶液,其他兩組注射相同體積的生理鹽水。
1.4實(shí)時(shí)定量PCR檢測(cè)微囊泡中miR-27a的表達(dá)提取各組缺血腦組織中總miRNA,反轉(zhuǎn)錄和實(shí)時(shí)定量PCR按照文獻(xiàn)[4]條件進(jìn)行。miR-27a引物序列為:5′-ACAGGCTAGCGCCGCCTAAC 3′(forward)和5′-CCTTAAGGCCCAAGATTACG 3′(reverse);U6引物序列為:5′-TCGCTTCGGCAGCACATATAC-3′(forward)和5′-TATGGAACGCTTCACGAATTT G-3′(reverse),各組以U6作為內(nèi)參,采用相對(duì)Ct方法2-△△Ct法進(jìn)行計(jì)算。
1.5TTC染色法測(cè)定腦梗死體積TTC溶于0.01 mol·L-1的PBS中,終濃度為1 %。構(gòu)建MCAO模型缺血2 h后,小鼠迅速斷頭取腦,-20℃冷凍約15 min后,切成厚度為1.5 mm的冠狀切片,迅速置于1%的TTC磷酸緩沖液中,37℃避光孵育約10 min。正常腦組織染為深紅色,腦梗死區(qū)為灰白色,10%福爾馬林固定,并用Image J圖像分析系統(tǒng)測(cè)量腦梗死體積。
1.6免疫組化測(cè)定缺血腦組織中occludin和claudin-5蛋白表達(dá)構(gòu)建MCAO模型缺血2 h后,處死各組小鼠,從左心室灌注生理鹽水沖洗至無(wú)明顯血絲, 4%多聚甲醛中固定24 h,干燥后石蠟包埋,厚5 μm切片。在occludin和claudin-5抗體中孵育(1 ∶50),PBS沖洗,4℃與二抗孵育過(guò)夜。在3-CCD彩色攝像機(jī)下20倍鏡拍攝[5],每個(gè)腦組織取8個(gè)視野進(jìn)行統(tǒng)計(jì)。
1.7Westernblot蛋白印跡法構(gòu)建MCAO模型缺血2 h后,提取各組腦組織中總蛋白,BCA定量蛋白質(zhì)量為40 μg上樣。采用12% SDS聚丙烯酰胺凝膠電泳,抗occludin、claudin-5、TLR4、β-actin抗體及NF-κB、p38磷酸化抗體(1 ∶1 000)4℃孵育過(guò)夜,用辣根過(guò)氧化物酶抗體孵育50 min。使用Bio-Rad生物圖像系統(tǒng)捕獲圖像并進(jìn)行分析。
1.8ELISA檢測(cè)IL-1β和TNF-α水平構(gòu)建MCAO模型缺血2 h后,從各組腦組織提取總蛋白,4℃、3 000 r·min-1離心5 min,按照試劑盒說(shuō)明書(shū)加入試劑反應(yīng),在450 nm波長(zhǎng)測(cè)定吸光度值,測(cè)定IL-1β和TNF-α含量。
2 結(jié)果
2.1循環(huán)微囊泡miR-27a的鑒定Fig 1透射電子顯微鏡顯示,微囊泡形態(tài)為圓形或近圓形的雙層膜結(jié)構(gòu)小囊泡。經(jīng)檢測(cè),樣品顆粒的直徑大多分布在45~350 nm,顆粒平均直徑為160 nm,無(wú)論是形態(tài)還是直徑均符合微囊泡的形態(tài)學(xué)特征[7]。Real-time PCR結(jié)果顯示,缺血組較假手術(shù)組中微囊泡miR-27a表達(dá)異常升高。

Fig 1 Morphological characteristics of microesicles
A: Transmission electron microscopy was used to observe the morphology of microvesicles; B: Real-time PCR was applied to detect the expression of miR-27a in microvesicles.##P<0.01vssham group.
2.2腦梗死體積和腦組織occludin、claudin-5表達(dá)的變化如Fig 2所示,缺血2 h組與假手術(shù)組相比,腦梗死體積明顯增加,提示造模成功。與缺血2 h組比較,注射微囊泡后能夠增加缺血小鼠腦梗死體積,而之前給予阻斷劑antagomiR-27a能夠減輕注射微囊泡對(duì)腦組織的損傷。同樣,缺血腦組織中occludin和claudin-5蛋白陽(yáng)性染色降低,注射微囊泡miR-27a后進(jìn)一步降低occludin和claudin-5蛋白染色表達(dá),而給予阻斷劑antagomiR-27a能夠抑制微囊泡對(duì)occludin和claudin-5蛋白染色的降低(Fig 3)。

Fig 2 Cerebral infarct volume of each group
##P<0.01vssham group;**P<0.01vs2 h of ischemia group;△△P<0.01vsinjection of MV and 2 h of ischemia group
2.3缺血腦組織occludin、claudin-5、TLR4、NF-κB、p38蛋白的變化如Fig 4所示,與免疫組化結(jié)果一致,缺血腦組織中occludin和claudin-5蛋白表達(dá)降低,TLR4表達(dá)升高,NF-κB、p38蛋白的磷酸化表達(dá)增加。注射微囊泡后,occludin和claudin-5蛋白表達(dá)進(jìn)一步降低,TLR4及NF-κB、p38蛋白的磷酸化表達(dá)持續(xù)增多,而給予阻斷劑antagomiR-27a能夠改善微囊泡對(duì)上述蛋白的作用。
2.4細(xì)胞因子IL-1β和TNF-α水平的變化Tab 1結(jié)果顯示,與假手術(shù)組相比,缺血腦組織中IL-1β和TNF-α釋放量明顯增多(P<0.01);注射微囊泡miR-27a后,IL-1β和TNF-α釋放量進(jìn)一步增多,與缺血組相比差異具有顯著性(P<0.01);給予阻斷劑antagomiR-27a能夠拮抗這一作用,減少細(xì)胞因子的釋放。

Fig 3 Occludin and claudin-5 immunohistochemical expression in each group (×20)

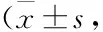
##P<0.01vssham group;*P<0.05,**P<0.01vs2 h of ischemia group;△P<0.05,△△P<0.01vsinjection of MV and 2 h of ischemia group

Tab 1 Release of cytokines IL-1β and
##P<0.01vssham;**P<0.01vs2 h of ischemia;△△P<0.01vsinjection of MV and 2 h of ischemia.
3 討論
血腦屏障是存在于血液和腦實(shí)質(zhì)之間的具有選擇通透性的動(dòng)態(tài)交換界面,由腦血管內(nèi)皮細(xì)胞、緊密連接、基膜、膠質(zhì)細(xì)胞足突等組成,其中腦血管內(nèi)皮細(xì)胞是血腦屏障功能發(fā)揮的結(jié)構(gòu)基礎(chǔ)。腦血管內(nèi)皮細(xì)胞因其蛋白缺乏收縮性,使得大分子、親水性藥物難以進(jìn)入中樞,確保中樞內(nèi)環(huán)境穩(wěn)定性。即血腦屏障有一定穩(wěn)定性,對(duì)于進(jìn)行中樞的物質(zhì)具有很強(qiáng)的選擇性,然而其通透性可隨著病理過(guò)程而發(fā)生變化。腦缺血/再灌注后,缺血側(cè)通透性于再灌注開(kāi)始增加,再灌注達(dá)高峰,非缺血側(cè)通透性未見(jiàn)明顯變化,并且腦部自由基、一氧化氮、基質(zhì)金屬蛋白酶和炎癥因子等表達(dá)異常增多,致血腦屏障通透性繼續(xù)增加[6]。
血腦屏障的結(jié)構(gòu)改變主要表現(xiàn)在腦血管內(nèi)皮細(xì)胞變形,核染色質(zhì)松散退變,通透性增加,胞質(zhì)和間質(zhì)水腫明顯,突起腫脹等。內(nèi)皮細(xì)胞之間的連接復(fù)合體由多蛋白體系構(gòu)成,occludin、claudin-5、閉鎖蛋白等是緊密連接的主要結(jié)構(gòu)蛋白,其表達(dá)水平的變化與腦微血管通透性的改變及腦水腫的程度密切相關(guān)[7]。最新研究表明,緊密連接是血腦屏障調(diào)節(jié)通透性的中心環(huán)節(jié),腦缺血性過(guò)程中,緊密連接功能和結(jié)構(gòu)的破壞可直接導(dǎo)致腦水腫,是死亡的主要原因。咬合蛋白(occludin)和閉合蛋白(claudin)均構(gòu)成復(fù)雜的跨膜結(jié)構(gòu),在大鼠局灶性腦缺血/再灌注模型血腦屏障超微結(jié)構(gòu)和occludin 變化的實(shí)驗(yàn)中發(fā)現(xiàn),腦缺血/再灌注過(guò)程中,occludin沿血管的表達(dá)變得間斷,同時(shí)occludin的蛋白表達(dá)水平下降,并且occludin表達(dá)在轉(zhuǎn)錄水平和翻譯水平均受到抑制,緊密連接開(kāi)放,血腦屏障完整性受損,提示occludin下降程度可作為血腦屏障損傷程度的標(biāo)志[8]。claudin是緊密連接復(fù)合物的主要構(gòu)成成分,參與維持緊密連接的選擇滲透性和細(xì)胞極化。claudin-5是構(gòu)成血腦屏障的主要跨膜蛋白,claudin蛋白被認(rèn)為是腦血管內(nèi)皮細(xì)胞通透性調(diào)節(jié)的最重要調(diào)節(jié)因子[9]。有研究發(fā)現(xiàn),在再灌注晚期,claudin-5從內(nèi)皮細(xì)胞間遷移到周?chē)男切文z質(zhì)細(xì)胞中,進(jìn)一步破壞血腦屏障[10]。在本研究中,不僅發(fā)現(xiàn)注射微囊泡后會(huì)加重缺血組織中腦梗死體積,還會(huì)降低occludin和claudin-5的陽(yáng)性染色率和蛋白印跡表達(dá),提示缺血組織中提取的微囊泡加重了缺血組織損傷,其本身的跨細(xì)胞通訊調(diào)控也可能是腦部缺血組織損傷的機(jī)制之一。
腦缺血或缺血/再灌注后誘導(dǎo)的炎癥介質(zhì)可被固有免疫系統(tǒng)識(shí)別。TLRs是固有免疫系統(tǒng)中的關(guān)鍵受體,其中TLR4是LPS誘導(dǎo)的中樞神經(jīng)系統(tǒng)感染的主要識(shí)別受體,在腦缺血后激活一系列炎癥分子分泌,是行使免疫功能和調(diào)節(jié)其功能的重要控制開(kāi)關(guān)之一。我們前期工作中已證實(shí),缺血/再灌注模型中,TLR4途徑下可誘導(dǎo)MyD88、MAPK、NF-κB等信號(hào)通路,促進(jìn)合成釋放 IL-1β、IL-6、TNF-α等炎癥介質(zhì),并誘導(dǎo)細(xì)胞凋亡[11],且TLR4誘導(dǎo)的此炎癥途徑參與了缺血后血腦屏障緊密連接損傷機(jī)制[12],可致血腦屏障緊密連接蛋白o(hù)ccludin、claudin-5和ZO-1表達(dá)降低。目前很多研究,特別是藥物或生物藥物干預(yù)研究,嘗試進(jìn)一步探索調(diào)控TLR4途徑,改善缺血后血腦屏障緊密連接損傷。
miR-27分為miR-27a和miR-27b,miR-27a屬于基因間miRNA,miR-27b屬于內(nèi)含子型mi RNA。miR-27a/b高表達(dá)于多種細(xì)胞和血管豐富組織中,包括脂肪細(xì)胞、心肌細(xì)胞、內(nèi)皮細(xì)胞、巨噬細(xì)胞等,均可參與調(diào)控糖脂代謝、血管生成、炎癥因子表達(dá)等[13]。然而,以往的研究多集中于miR-27a/b在腫瘤調(diào)控中的作用,在腦血管疾病研究較少,深入探討miR-27在缺血腦血管疾病中的作用和病理生理機(jī)制,對(duì)于腦缺血疾病的診斷、治療和防治有重要意義。miR-27a參與調(diào)節(jié)緊密連接報(bào)道較少,僅有miR-27a參與調(diào)節(jié)腫瘤相關(guān)血管內(nèi)皮鈣黏蛋白調(diào)控的報(bào)道[14]。前期研究已證實(shí),miR-27a參與調(diào)控LPS刺激小膠質(zhì)細(xì)胞中TLR4/IRAK4途徑,干擾miR-27a的表達(dá)可增加炎癥因子的表達(dá)[4]。本研究發(fā)現(xiàn),缺血組織中提取的微囊泡中miR-27a表達(dá)異常升高,提示缺血組織本身分泌的微囊泡可包含miR-27a信息,傳遞至缺血腦組織引起缺血組織損傷。細(xì)胞分泌的微囊泡可攜帶miRNAs、mRNA、蛋白質(zhì)等信息,轉(zhuǎn)移至細(xì)胞或組織中,通過(guò)細(xì)胞間通訊的方式調(diào)節(jié)靶細(xì)胞或組織[15]。在本研究中,注射miR-27a在缺血組織中釋放并致腦損傷,誘導(dǎo)下游的NF-κB和p38信號(hào)因子表達(dá)持續(xù)升高,產(chǎn)生炎癥級(jí)聯(lián)反應(yīng),使得缺血腦組織中緊密連接損害加重。由于本研究中微囊泡是在缺血腦組織中分離的,具體微囊泡是從何種細(xì)胞中傳遞,作用于何種細(xì)胞仍需進(jìn)一步研究。
(致謝: 本實(shí)驗(yàn)在南昌大學(xué)第一附屬醫(yī)院實(shí)驗(yàn)室完成,對(duì)在實(shí)驗(yàn)過(guò)程中給予指導(dǎo)和幫助的老師表示感謝!)
[1] Prinz M,Priller J.The role of peripheral immune cells in the CNS in steady state and disease[J].NatNeurosci,2017,20(2):136-44.
[2] EL Andaloussi S,Mger I,Breakefield X O,et al.Extracellular vesicles: biology and emerging therapeutic opportunities[J].NatRevDrugDiscov,2013,12(5):347-57.
[3] 劉 芬,李 勇,彭菲菲,等.iPSC-MSC來(lái)源的外泌體對(duì)LPS刺激肺泡巨噬細(xì)胞產(chǎn)生炎性因子的影響[J].實(shí)驗(yàn)與檢驗(yàn)醫(yī)學(xué),2016,34(1):4-7.
[3] Liu F,Li Y,Peng F F,et al.The effect of exosomes derived from iPSC -MSC on secretion of inflammation factor from LPS treated alveolar macrophage[J].ExpLaboratoryMed,2016,34(1): 4-7.
[4] Lv Y N,Ou-Yang A J,Fu L S.MicroRNA-27a negatively modulates the inflammatory response in lipopolysaccharide-stimulated microglia by targeting TLR4 and IRAK4[J].CellMolNeurobiol,2017,37(2):195-210.
[5] Ye X,Chopp M,Cui X,et al.Niaspan enhances vascular remodeling after stroke in type 1 diabetic rats[J].ExpNeurol,2011,232(2):299-308.
[6] Li X Q,Chen F S,Tan W F,et al.Elevated microRNA-129-5p level ameliorates neuroinflammation and blood-spinal cord barrier damage after ischemia-reperfusion by inhibiting HMGB1 and the TLR3-cytokine pathway[J].JNeuroinflammation,2017,14(1):205.
[7] 李 敏,王 斌,曹 慧,等.基于AQP-4、P-gp黃芩苷、梔子苷配伍對(duì)缺血/再灌注損傷大鼠血腦屏障保護(hù)機(jī)制研究[J].中國(guó)藥理學(xué)通報(bào),2017,33(3):443-4.
[7] Li M,Wang B,Cao H,et al.Effect of baicalin and geniposide on blood brain barrier permeability in cerebral ischemia-reperfusion injury rats based on AQP-4,P-gp and its mechanism[J].ChinPharmacolBull,2017,33(3): 443-4.
[8] Zhang G S,Tian Y,Huang J Y,et al.The γ-secretase blocker DAPT reduces the permeability of the blood-brain barrier by decreasing the ubiquitination and degradation of occludin during permanent brain ischemia[J].CNSNeurosciTher,2013,19(1):53-60.
[9] 方 波,張 穎,馬 虹.miR-122a對(duì)大鼠脊髓缺血/再灌注損傷后血-脊髓屏障的影響[J].中國(guó)藥理學(xué)通報(bào),2017,33(5):703-6.
[9] Fang B,Zhang Y,Ma H.Effects of miR-122a on blood-spinal cord barrier after spinal cord ischemia-reperfusion injury in rats[J].ChinPharmacolBull, 2017,33(5):703-6.
[10] Miyamori H,Takino T,Kobayashi Y,et al.Claudin promotes activation of pro-matrix metalloproteinase-2 mediated by membrane-type matrix metalloproteinases[J].BiolChem,2001,276(30):28204-11.
[11] Lv Y,Qian Y,Fu L,et al.Hydroxysafflor yellow A exerts neuroprotective effects in cerebral ischemia/reperfusion-injured mice by suppressing the innate immune TLR4-inducing pathway[J].EurJPharmacol,2015,769:324-32.
[12] Lv Y,Fu L. The potential mechanism for Hydroxysafflor yellow A attenuating blood-brain barrier dysfunction via tight junction signaling pathways excavated by an integrated serial affinity chromatography and shotgun proteomics analysis approach[J].NeurochemInt,2018,112:38-48.
[13] Chen W J,Yin K,Zhao G J,et al.The magic and mystery of microRNA-27 in atherosclerosis[J].Atherosclerosis,2012,222(2):314-23.
[14] Zhao Y,Ting K K,Li J,et al.Targeting vascular endothelial-cadherin in tumor-associated blood vessels promotes T-cell-mediated immunotherapy[J].CancerRes,2017,77(16):4434-47.
[15] Budnik V,Ruiz-Caada C,Wendler F.Extracellular vesicles round off communication in the nervous system[J].NatRevNeurosci,2016,17(3):160-72.