環境因子對微藻胞外多聚物主要組分的影響
吳琪璐,崔文倩,沈 亮,盧英華
(廈門大學化學化工學院,福建 廈門 361005)
利用微藻處理污水的生態修復技術已經成為世界上有關環境治理和能源發展方面最熱門的研究方向之一,然而,利用污水培養微藻往往面臨環境條件波動大以及營養元素不均衡等問題.為了得到更好的污水處理效果,需要進一步研究微藻的生長特性,包括其胞外多聚物(extracellular polymeric substances,EPS)的組分.一般而言,EPS是由微生物分泌到胞外的復雜混合產物,主要包括多糖、蛋白質、脂質、核酸和其他一些高分子聚合物[1-2].根據存在狀態,EPS又可分可溶性EPS(soluble EPS,S-EPS)和結合性EPS(bound EPS,B-EPS)[3-4].S-EPS主要存在于培養基質中或者輕輕附著在細胞表面,B-EPS則緊密結合在細胞表面.EPS在細胞的生長、聚集和生物膜形成等方面發揮很重要的作用.EPS的存在會影響微藻的絮凝,這在微藻污水處理后收集藻細胞中起關鍵作用.
目前對于EPS組分的研究主要針對胞外多糖和蛋白質:多糖是EPS中含量最高的組分,除個別藻細胞分泌的胞外多糖為均聚物外,大多數為帶有不同取代基的雜多糖[5];蛋白質是EPS的另一個重要組分,目前發現綠藻的EPS中多為糖蛋白[6].不同生長時期和條件下,微藻的蛋白質在EPS中所占比例不同,富氮培養條件下蛋白質所占比例更高[7].
EPS的產生受到許多外界因素的影響.首先,培養基質的不同會對EPS產量產生影響,研究發現活性污泥中醋酸鹽作為碳源比葡萄糖作為碳源產生的EPS更多[8].其次,微生物的兼養、自養和異養間的變化對EPS也會產生影響,從兼養變為異養會給微生物帶來環境壓力,從而產生更多EPS[9].再者,不同的營養元素含量也會產生影響,如:在污水中生長的微藻受氮、磷等營養元素含量的影響,當氮和磷含量都低于標準液體培養基中的含量時,藻細胞會產生大量EPS[10];活性污泥產生的EPS則隨著環境中碳氮比的降低,其蛋白質和多糖的比例升高[11].此外,還有一些其他外界條件影響微藻EPS的分泌,其中常見的是一些有毒成分,如重金屬元素的存在會加劇EPS的分泌[12].
本研究中選擇4種常見的淡水微藻,分別考察氮源含量、pH值、溫度和培養方式對EPS組分和含量的影響,以期獲得微藻對于環境的適應性生長條件,為微藻污水處理應用和藻細胞收集提供理論依據.
1 材料與方法
1.1 實驗材料
實驗中使用的4種微藻分別為葡萄藻(Botryococcussp.NJD-1)、柵藻(Scenedesmussp.NJD-5)、小球藻A(Chlorellasp. NJD-3)以及小球藻B(Chlorellasp. NJD-10),由本課題組從本地一家污水處理廠污水環境中分離得到,均屬于綠藻.
1.2 綠藻的培養
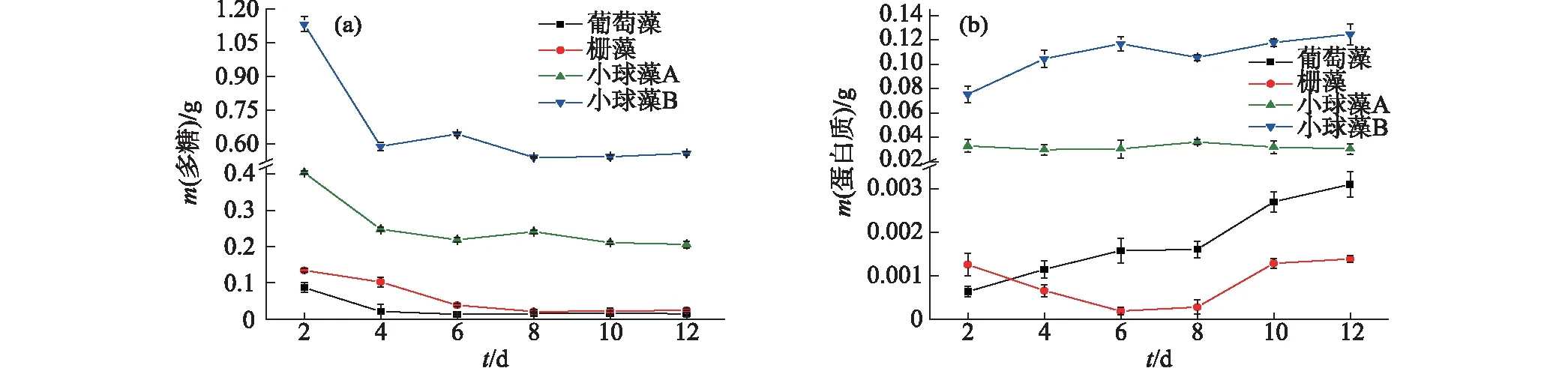
組分含量按每克細胞中的質量計,不同.圖1 4種微藻EPS中多糖(a)和蛋白質(b)含量的對比Fig.1 Contents of polysaccharide (a) and protein (b) in EPS of four different microalgae
采用BG11液體培養基進行無菌分批培養,培養過程包括預培養和培養兩個階段.
在異養條件下,預培養階段持續4 d,首先在250 mL錐形瓶中加入100 mL滅菌液體培養基(含10 g/L葡萄糖),pH值調至7(用1 mol/L HCl溶液和1 mol/L NaOH溶液調節,下同),再加入10 mL藻液,置于30 ℃、150 r/min的恒溫搖床中培養.培養階段持續12 d,首先在250 mL錐形瓶中加入150 mL滅菌液體培養基(含10 g/L葡萄糖),將pH值調至7,再加入一定量預培養的藻液,其他條件與預培養階段一致.
在自養條件下,預培養階段持續4 d,首先配制500 mL滅菌液體培養基,pH值調至7,再向其中加入10 mL藻液,24 h光照(飛利浦TWG121/2005型支架燈管4根,功率21 W),恒溫30 ℃,經過滅菌過濾膜通入CO2(純度≥99.9%),氣體流量保持在100 mL/min.培養階段持續12 d,首先配制1 L滅菌液體培養基,將pH值調至7,再向其中加入一定量預培養的藻液,其他條件與預培養階段一致.
上述條件即為標準培養條件.分析環境因子對微藻EPS的影響,僅改變單一環境條件,其他條件均不變,其中缺氮培養條件指將培養基中氮的含量減少50%.
1.3 EPS的提取
微藻EPS的分離提取選用超聲降解法[13]:首先在不同培養時間的搖瓶中取4 mL微藻樣品,在9 000 r/min轉速下離心15 min,上清液即為S-EPS;沉淀重新用磷酸鹽緩沖液(10 mmol/L NaCl,1.2 mmol/L KH2PO4,6 mmol/L Na2HPO4)溶解,將樣品放入冰水中,在40%最大功率的條件下進行超聲處理2 min;然后在9 000 r/min轉速下離心15 min,上清液即B-EPS.利用丙酮提取的方法測定總的EPS干質量:取一定量培養過程中的微藻樣品,用Whatman No.1濾膜進行過濾,保留清液,1 000 r/min轉速下離心10 min;取上清液,加入等體積的丙酮,在4 ℃條件下保存48 h;之后10 000 r/min轉速下離心10 min,保留沉淀,凍干24 h即得EPS并稱量其干質量[14].
1.4 藻細胞生長指標測定與組分分析
取4 mL微藻樣品于離心管,10 000 r/min轉速下離心10 min后倒去上清液,保留沉淀,放入60 ℃烘箱烘干24 h后進行稱量,該質量減去空管質量即為藻細胞干質量;同時采用雙光束紫外-可見分光光度計在波長680 nm條件下檢測同一微藻樣品的光密度(OD),繪制OD值與藻細胞干質量的標準曲線.蛋白質測定采用考馬斯亮藍法[15],使用Bradford染色劑.多糖測定采用苯酚-硫酸法[16].所有實驗重復3次,結果取平均值.
2 結果與討論
2.1 缺氮對不同微藻EPS的影響
2.1.1 標準條件下微藻EPS組分比較
在異養標準培養狀態下測定4種微藻的EPS組分含量,結果如圖1所示:小球藻B的EPS中多糖含量明顯大于其他3種微藻,經過最初微藻迅速生長的變化階段,從第8天開始穩定在約0.56 g;小球藻A的多糖含量次之,從第4天開始穩定在約0.21 g;葡萄藻和柵藻中多糖含量均較低(圖1(a)).小球藻B的EPS中蛋白質含量最高,最大值達到0.12 g;小球藻A的蛋白質含量則基本穩定在0.03 g左右,即50 mg/L(上清液),與前人研究結果[8]相似;而柵藻的蛋白含量最低,最大值僅0.001 4 g(圖1(b)).綜上,2種小球藻分泌的EPS中多糖與蛋白質的含量高于葡萄藻和柵藻.
圖2 葡萄藻的EPS中多糖(a)和蛋白質(b)含量的變化Fig.2 Changes of polysaccharide (a) and protein (b) contents in EPS of Botryococcus sp. NJD-1
對4種微藻在標準生長條件下的生物量情況進行分析,結果顯示葡萄藻最快(第4天)達到生物量最大值14.97 g/L,另外3種微藻在第6天后才達到生物量最大值(柵藻16.67 g/L,小球藻A 1.64 g/L,小球藻B 0.95 g/L).雖然葡萄藻長勢最好,但是以單位生物量來衡量EPS組分含量時發現其EPS中多糖含量最低.已有研究發現微生物細胞在底物限制時可利用EPS中的物質作為碳源和能量來源[17],由于葡萄藻生長速率較快,柵藻生物量較高,相同培養條件下葡萄藻和柵藻更容易受底物限制,所以可能會吸收更多的EPS多糖作為自身能量來源.
2.1.2 缺氮條件下4種微藻EPS組分比較
氮作為微藻生長過程中重要的營養元素,起著至關重要的作用.有機氮存在于許多生物基質中,如肽、蛋白質、酶、葉綠素、能量轉移分子(ADP和ATP)和基因材料(RNA和DNA).有機氮的無機來源包括硝酸根(NO3-)、亞硝酸根(NO2-)、硝酸(HNO3)、銨根(NH4+)、氨(NH3)和氮氣(N2).微藻在無機氮通過同化作用轉化為有機氮的過程中起著決定性作用.
對葡萄藻、柵藻、小球藻A和小球藻B分別進行標準培養和缺氮培養條件下的實驗,結果顯示2種培養條件下的多糖含量均遠大于蛋白質含量,但是在不同微藻的生長過程中兩者變化趨勢有所差異(圖2).
葡萄藻EPS中多糖含量的變化如圖2(a)所示.總體來看基本均呈下降趨勢,且前6天的下降速率極快.生長初期在S-EPS和B-EPS中,缺氮培養條件下的多糖含量均高于標準培養條件下,其中第4天和第6天的S-EPS中多糖含量均高出標準培養條件下50%以上;但生長至第10天后,葡萄藻生長狀態趨于穩定,2種培養條件下多糖的含量基本相同,隨之趨于穩定,S-EPS中的多糖含量均維持在0.014 g左右;在同一培養條件下,B-EPS中的多糖含量遠低于S-EPS中,到穩定期時B-EPS中的多糖含量僅有0.001 g.
葡萄藻EPS中蛋白質含量的變化如圖2(b)所示.總體來看S-EPS中的蛋白質含量均大于B-EPS中.標準培養條件下葡萄藻的S-EPS中蛋白質含量不斷增加,前6天雖低于缺氮培養條件下,但在生長穩定期超過缺氮培養條件下,在第12天達到0.002 1 g.這可能是因為缺氮培養的葡萄藻在生長初期會因為缺氮帶來的環境壓力促使細胞分泌更多蛋白質,但到了后期,環境中缺少氮源,葡萄藻開始吸收之前釋放的蛋白質來滿足生長的營養需求;然而在標準培養條件下,葡萄藻生長迅速,其細胞數量更多,在分批培養初始底物濃度相同情況下死亡的細胞也更多,細胞死亡破裂釋放出蛋白質導致其含量不斷增加.
綜上,葡萄藻EPS中多糖含量逐漸減少,而蛋白質含量略微增多,這可能是因為葡萄藻在逐漸分泌EPS的同時也會吸收EPS中的組分,其對EPS中多糖的吸收量大于分泌量而對蛋白質的吸收量小于分泌量,所以出現上述變化趨勢.
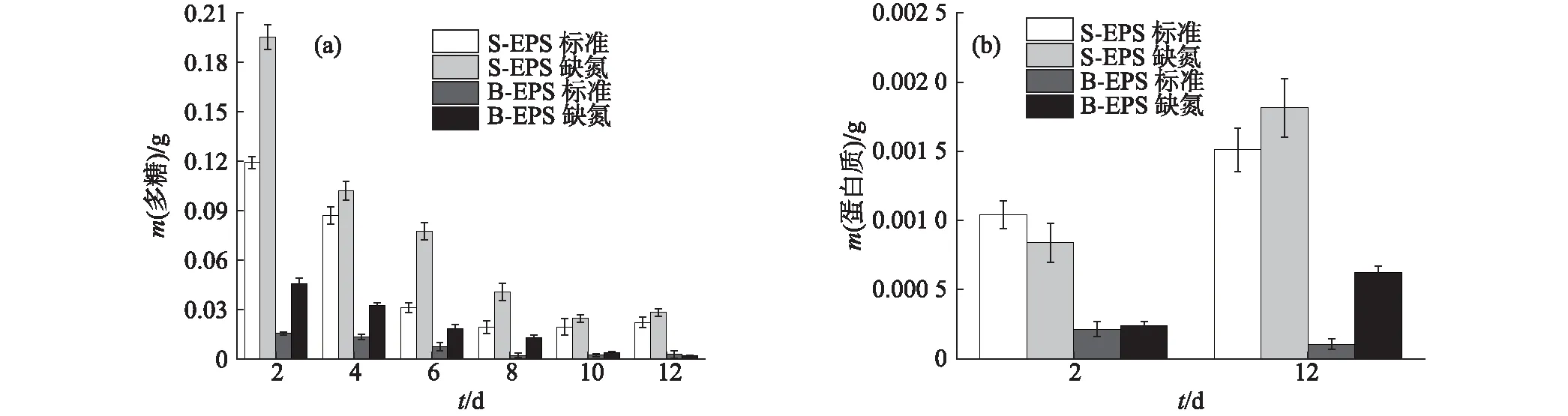
圖3 柵藻的EPS中多糖(a)和蛋白質(b)含量的變化Fig.3 Changes of polysaccharide (a) and protein (b) contents in EPS of Scenedesmus sp. NJD-5
柵藻EPS中多糖含量的變化與葡萄藻類似.如圖3(a)所示,總體上多糖含量在生長初期急速下降,缺氮培養條件下的多糖含量均高于標準培養條件下;但到了生長穩定期(第10天后)相差不大,標準培養和缺氮培養條件下的S-EPS中多糖含量分別穩定在0.025和0.030 g.這可能是因為柵藻生長后期大量的細胞衰老并死亡,從而造成細胞破裂,釋放出了一定量的多糖.此外,S-EPS中的多糖含量始終高于B-EPS中.由于柵藻EPS中蛋白質含量相對較低,測定誤差較大,所以僅選取培養初期(第2天)和末期(第12天)進行對比.由圖3(b)可知,2種培養條件下,其S-EPS中的蛋白質含量均有所增加,但B-EPS中的蛋白質含量在標準條件下變化不大,甚至略有減少,而在缺氮條件下則有所增加.
圖4 小球藻A的EPS中多糖(a)和蛋白質(b)含量的變化Fig.4 Changes of polysaccharide (a) and protein (b) contents in EPS of Chlorella sp. NJD-3
小球藻A的EPS中多糖含量的變化如圖4(a)所示,在標準培養條件下S-EPS中多糖含量明顯高于缺氮培養條件下,而B-EPS中除培養初期外則基本相同,這與葡萄藻和柵藻的結果不同,但整體變化趨勢基本一致.小球藻A的EPS中蛋白質含量的變化與葡萄藻和柵藻有所差別,如圖4(b)所示,除標準培養條件下S-EPS中蛋白質含量變化不大外,其余均呈減少趨勢.這可能是因為小球藻A在缺氮培養條件下生物量更大,且生長速率更快,需要更多的氮源,此時蛋白質可作為有效的氮源被細胞吸收利用,所以蛋白質含量逐漸減少.此外,與葡萄藻類似,小球藻A的S-EPS中的蛋白質含量始終高于B-EPS中,標準培養條件下S-EPS中的蛋白質含量最高可達到0.030 g.
如圖5(a)所示,小球藻B的S-EPS中多糖含量在2種培養條件下,生長至第8天后均穩定在0.45 g左右;B-EPS中則穩定在相對較低的水平,標準培養條件下最后維持在0.11 g,而缺氮培養條件下僅為0.041 g,這可能與其生長穩定期的細胞數量較少有一定關系.從圖5(b)中可見,小球藻B生長至穩定期后,S-EPS中的蛋白質含量明顯高于B-EPS中,這與多糖含量的結果一致;并且在缺氮培養條件下,由于細胞對EPS中蛋白質的吸收利用,蛋白質含量整體呈下降趨勢.
2.1.3 不同微藻EPS中多糖和蛋白質含量比較
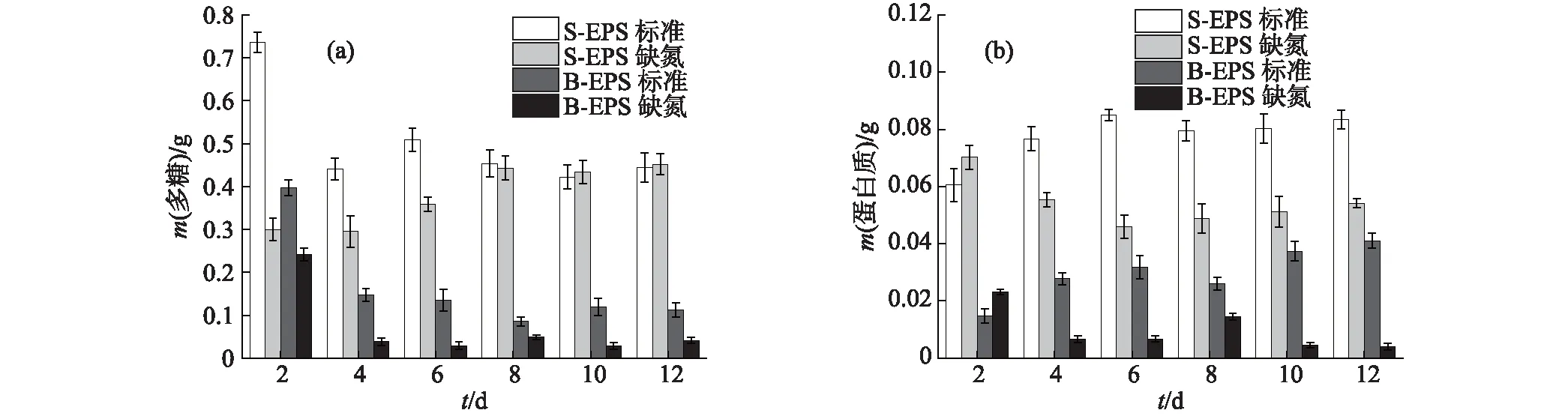
圖5 小球藻B的EPS中多糖(a)和蛋白質(b)含量的變化Fig.5 Changes of polysaccharide (a) and protein (b) contents in EPS of Chlorella sp. NJD-10
由于柵藻的EPS中多糖含量變化與葡萄藻類似且蛋白質含量極少,表1僅列出了葡萄藻、小球藻A和小球藻B在標準和缺氮2種培養條件下EPS的總量及其中多糖和蛋白質的質量分數.由表1可知,微藻在缺氮培養條件下EPS中多糖和蛋白質的質量分數相對于標準培養條件下有所降低,其中多糖質量分數降低最多的為葡萄藻,下降了22.7%,而蛋白質質量分數降低最多的為小球藻A,下降了56.0%,這說明缺氮培養會導致EPS的組成發生變化.葡萄藻和小球藻B的EPS總量在缺氮培養條件下均有所減少,而小球藻A在缺氮培養條件下相對于標準培養條件下增加了約29.3%,這可能與小球藻A在缺氮培養條件下生長更好有關,符合已有文獻報道的培養條件改變會導致微生物EPS組分比例發生改變,且變化趨勢和微生物種類、生長情況和改變的培養條件等有關[18-20].
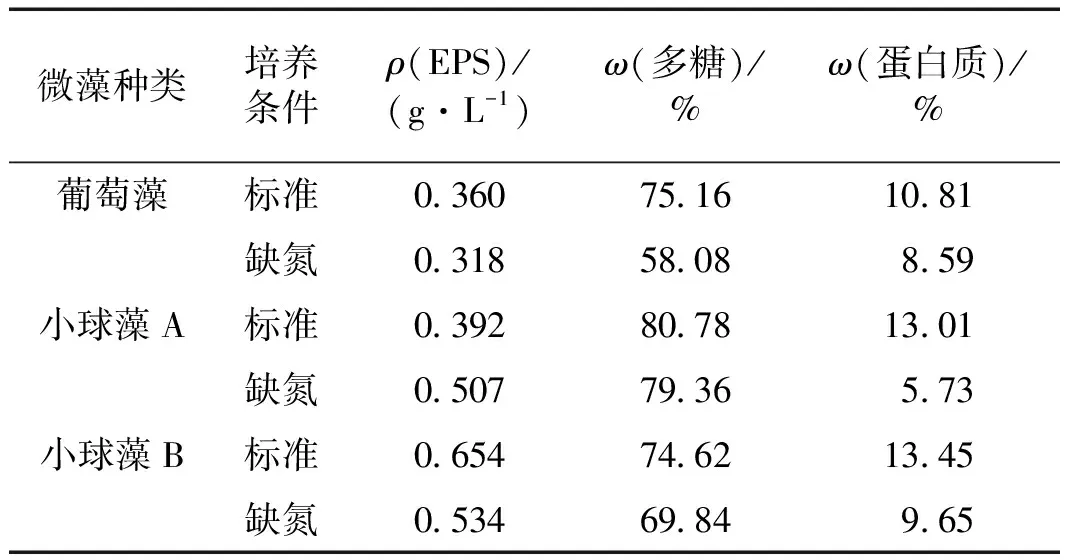
表1 3種微藻的EPS總量及多糖和蛋白質組分的質量分數
綜合以上結果及微藻自身的生長情況,鑒于葡萄藻有一定代表性,且能在不適宜生長的條件中保持穩定生長,后續實驗選擇葡萄藻研究pH值、溫度和培養方式對EPS組分的影響.
2.2 pH值對葡萄藻EPS組分的影響
2.2.1 多糖含量
培養階段分別在pH值為5,7,9和11條件下進行葡萄藻的培養及EPS組分的分析,所得EPS中多糖含量的變化結果如圖6所示.由圖6(a)可知:當pH值為11時,S-EPS中的多糖含量始終大于同時期其他pH條件下,到第12天時仍能達到0.15 g;而pH值為7時,生長穩定后S-EPS中的多糖含量最低.B-EPS中的多糖含量如圖6(b)所示,總體上遠小于S-EPS中,pH值為11時的最大值也僅有0.021 g;與S-EPS中的結果類似,pH值為11時的B-EPS中多糖含量始終高于同時期其他pH條件下,且pH值為7時,生長穩定后B-EPS中的多糖含量最低.
2.2.2 蛋白質含量
pH值對EPS中蛋白質含量的影響如圖7所示.由圖7(a)可知:S-EPS中的蛋白質含量隨著葡萄藻的生長整體呈增大趨勢,在生長穩定后,pH值為5時的蛋白質含量明顯大于其他pH條件下,最高達到0.004 5 g;在pH值為9時,生長穩定后的蛋白質含量最低.因為葡萄藻B-EPS中蛋白質含量相對較低,測定結果存在較大誤差,所以選取培養初期(第2天)和培養末期(第12天)進行蛋白質含量的測定并對比,結果如圖7(b)所示:生長初期,pH值為11時的蛋白質含量最高,達0.002 6 g,而pH值為7時最低;但隨著葡萄藻的生長,到了生長末期,pH值為11時的蛋白質含量明顯降低,僅有0.000 4 g,而pH值為7時的蛋白質含量則明顯升高,達0.000 9 g.

圖6 葡萄藻在不同條件下S-EPS(a)和B-EPS(b)中多糖含量的變化Fig.6 Changes of polysaccharide contents in S-EPS(a) and B-EPS(b) of Botryococcus sp. NJD-1 under different pH values
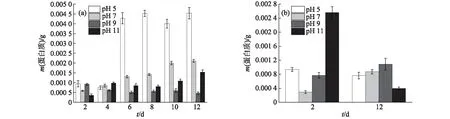
圖7 葡萄藻在不同pH條件下S-EPS(a)和B-EPS(b)中蛋白質含量的變化Fig.7 Changes of protein contents in S-EPS (a) and B-EPS (b) of Botryococcus sp. NJD-1 under different pH values
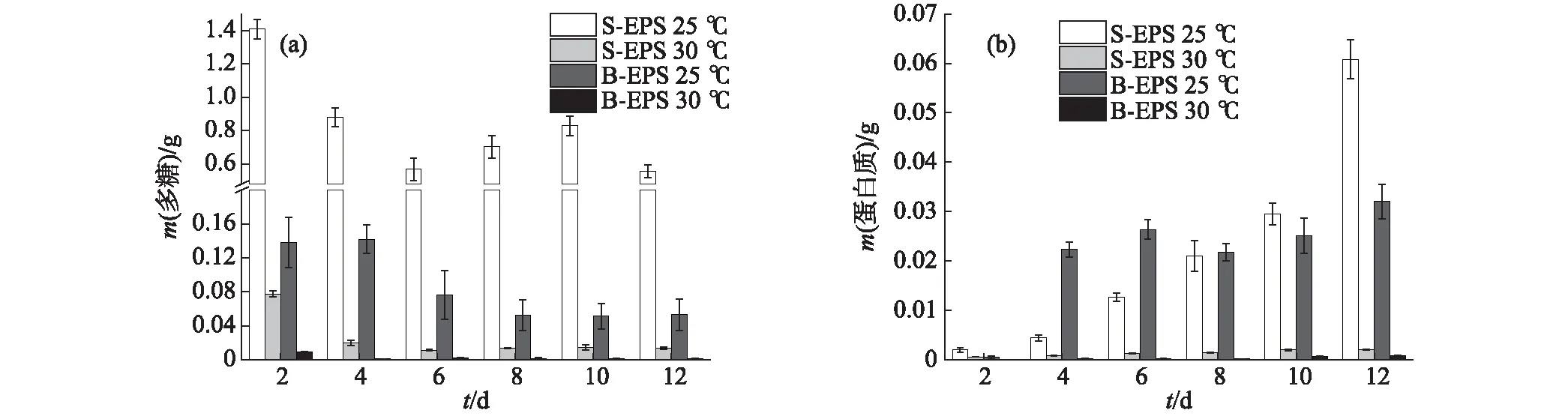
圖8 葡萄藻在不同溫度條件下EPS中多糖(a)和蛋白質(b)含量的變化Fig.8 Changes of polysaccharide (a) and protein (b)contents in the EPS of Botryococcus sp. NJD-1 at different temperature
2.3 溫度對葡萄藻EPS組分的影響
葡萄藻在不同溫度條件下EPS中多糖含量的變化如圖8(a)所示:總體來看,多糖含量隨著葡萄藻的生長呈降低趨勢,溫度為25 ℃時葡萄藻傾向于分泌更多的多糖,S-EPS和B-EPS中的多糖含量均高于30 ℃時.這一結果也印證了EPS的分泌是微藻對惡劣環境的一種響應機制:在30 ℃時,葡萄藻處于適宜的生長環境中,EPS的分泌減少;而當溫度降低到25 ℃時,溫度條件偏離了葡萄藻適應范圍,葡萄藻減緩生長進而分泌出更多的多糖.不同溫度條件下,EPS中蛋白質含量的變化如圖8(b)所示:當溫度為25 ℃時,S-EPS中的蛋白質含量隨著葡萄藻的生長快速增加,B-EPS中則在初期快速增加后趨于穩定;與25 ℃相比,30 ℃時S-EPS和B-EPS中的蛋白質含量均維持在極低的水平,與多糖的結果一致.
2.4 自養和異養對葡萄藻EPS組分的影響
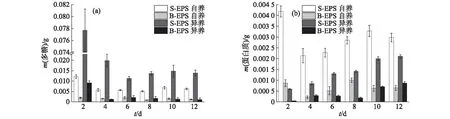
圖9 葡萄藻在異養和自養條件下EPS的多糖(a)和蛋白質(b)含量的變化Fig.9 Changes of polysaccharide(a) and protein(b)contents in EPS of Botryococcus sp. NJD-1 under autotrophic and heterotrophic conditions
將葡萄藻在自養和異養2種培養條件下的EPS組分進行對比分析,結果如圖9所示.從圖9(a)可以明顯看出:葡萄藻在自養培養條件下多糖含量在初期下降后趨于穩定,且生長穩定后S-EPS中的多糖含量(約0.006 3 g)遠低于異養條件下(約0.014 0 g);B-EPS中多糖含量隨著葡萄藻生長逐漸下降,至生長穩定后,自養條件下的多糖含量略高于異養條件下.蛋白質含量的變化如圖9(b)所示:異養培養條件下的葡萄藻EPS中蛋白質含量整體呈上升趨勢,而自養培養條件下的葡萄藻則在初期分泌出大量蛋白質后,隨著細胞增長蛋白質含量降低,在生長到達穩定期后又有所上升.此外,在相同培養條件下多糖的總含量始終大于蛋白質的總含量,印證了之前相關研究[13]所得的結論.
3 結 論
微藻在適宜的培養基中生長時,EPS中多糖的含量會隨著細胞增多而下降,蛋白質含量則呈現相反趨勢.對比本研究中的4種微藻,小球藻釋放更多的多糖和蛋白質.氮作為微藻生長的必要元素,其減少不一定會抑制微藻的生長,但會迫使微藻細胞從其他來源吸收營養,因此缺氮培養條件會造成EPS中的蛋白質含量減少.環境呈堿性(pH值為11)會刺激葡萄藻產生更多EPS多糖和蛋白質,含量與中性(pH值為7)時相比分別增加0.135和0.018 g.溫度的降低(從30至25 ℃)可使葡萄藻EPS中多糖和蛋白質的含量急劇增加,最高達約40倍.自養和異養的培養類型改變對葡萄藻EPS中多糖和蛋白質含量的影響不同,自養會導致EPS中出現大量蛋白質,而異養則會產生更多的多糖,這與其對于碳源利用方式的不同有關.綜上,本研究初步探討了各種外界環境條件對微藻EPS多糖和蛋白質的影響規律,對于了解微藻處理污水時的生長情況和取得更好的集藻效果有一定指導意義.
[1] PARK C,NOVAK J T,HELM R F,et al.Evaluation of the extracellular proteins in full-scale activated sludges[J].Water Research,2008,42(14):3879-3889.
[2] SHENG G P,YU H Q,LI X Y.Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J].Biotechnology Advances,2010,28(6):882-894.
[3] YANG Z,KONG F,SHI X,et al.Changes in the morphopogy and polysaccharide content ofMicrocystisaeruginosa(Cyanobacteria) during flagellate grazing(1)[J].Journal of Phycology,2008,44(3):716-720.
[4] QU F,LIANG H,WANG Z,et al.Ultrafiltration membrane fouling by extracellular organic matters (EOM) ofMicrocystisaeruginosain stationary phase:influences of interfacial characteristics of foulants and fouling mechanisms[J].Water Research,2012,46(5):1490-1500.
[5] DE JESUS RAPOSO M F,DE MORAIS A M M B,DE MORAIS R M S C.Bioactivity and applications of polysaccharides from marine microalgae[M]∥RAMAWAT K G,MERILLON J-M.Polysaccharides:bioactivity and biotechnology.Cham:Springer International Publishing,2015:1683-1727.
[6] PAULSEN B,ASLAKSEN T,S.FREIRE-NORDI C,et al.Extracellular polysaccharides fromAnkistrodesmusdensus(Chlorophyceae)[J].Journal of Phycology,1998,34(4):638-641.
[7] WANG M,KUO-DAHAB W C,DOLAN S,et al.Kinetics of nutrient removal and expression of extracellular polymeric substances of the microalgae,Chlorellasp. andMicractiniumsp.,in wastewater treatment[J].Bioresour Technol,2014,154:131-137.
[8] LI X Y,YANG S F.Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation,sedimentation and dewaterability of activated sludge[J].Water Research,2007,41(5):1022-1030.
[9] SHIPIN O V,MEIRRING P,PHASWANA R,et al.Integrating ponds and activated sludge process in the PETRO concept[J].Water Research,1999,33(8):1767-1774.
[10] BOONCHAI R,KAEWSUK J,SEO G.Effect of nutrient starvation on nutrient uptake and extracellular polymeric substance for microalgae cultivation and separation[J].Desalination and Water Treatment,2014,55(2):360-367.
[11] LIU Y,FANG H H P.Influences of extracellular polymeric substances (EPS) on flocculation,settling,and dewatering of activated sludge[J].Critical Reviews in Environmental Science and Technology,2003,33(3):237-273.
[12] 陳長平,徐華林,梁君榮,等.鎘離子對紅樹林底棲硅藻新月筒柱藻胞外多糖的影響[J].廈門大學學報(自然科學版),2013,52(1):122-126.
[13] XU H,CAI H,YU G,et al.Insights into extracellular polymeric substances of cyanobacteriumMicrocystisaeruginosausing fractionation procedure and parallel factor analysis[J].Water Research,2013,47(6):2005-2014.
[14] ABREU I,CERDA M E,DE NANCLARES M P,et al.Boron deficiency affects rhizobia cell surface polysaccharides important for suppression of plant defense mechanisms during legume recognition and for development of nitrogen-fixing symbiosis[J].Plant and Soil,2012,361(1):385-395.
[15] HAMMOND J B W,KRUGER N J.The Bradford method for protein quantitation[J].Methods in Molecular Biology,1994,32(32):9.
[16] TAYLOR K A C C.A modification of the phenol/sulfuric acid assay for total carbohydrates giving more comparable absorbances[J].Applied Biochemistry and Biotechnology,1995,53(3):207-214.
[17] DURMAZ B,SANIN F D.Effect of carbon to nitrogen ratio on the composition of microbial extracellular polymers in activated sludge[J].Water Science and Techno-logy,2001,44(10):221-229.
[18] LIU L Z,HUANG Q,ZHANG Y L,et al.Excitation-emission matrix fluorescence and parallel factor analyses of the effects of N and P nutrients on the extracellular polymeric substances ofMicrocystisaeruginosa[J].Limnologica,2017,63:18-26.
[19] METIVIER R,BOURVEN I,LABANOWSKI J,et al.Interaction of erythromycin ethylsuccinate and acetami-nophen with protein fraction of extracellular polymeric substances (EPS) from various bacterial aggregates[J].Environ Sci Pollut Res Int,2013,20(10):7275-7285.
[20] ZHANG W J,CAO B D,WANG D S,et al.Variations in distribution and composition of extracellular polymeric substances (EPS) of biological sludge under potassium ferrate conditioning:effects of pH and ferrate dosage[J].Biochemical Engineering Journal,2016,106:37-47.

