胰島素泵持續皮下注射胰島素對1型糖尿病酮癥酸中毒患兒機體代謝紊亂糾正效果研究
李 佳,王旭艷,劉 超,鄒宗毅,陳 鏡
西安市兒童醫院(西安 710003)
1型糖尿病(T1DM)是臨床常見的慢性代謝性疾病,胰島β細胞破壞造成的胰島素的絕對分泌不足是該病的主要原因,持續的血糖升高是其主要臨床表現。相關研究顯示[1]:受環境污染、生活方式改變等多種因素影響,糖尿病發生率正逐年升高,因其并發癥所致的死亡患者占疾病死亡的第5位,我國作為糖尿病高發國家,近30年來患病率增加約10倍之多,其相關并發癥危害也受到高度關注。研究顯示:兒童作為T1DM的高發人群,其發病率也呈爆發式升高,且較成年人出現并發癥幾率更高,危害更為嚴重[2]。糖尿病酮癥酸中毒(DKA)是糖尿病最常見的并發癥,常因治療控制不佳、急性感染等因素所致,具有起病急、病情進展迅速及預后差等特點,以嚴重血糖升高、高血酮癥、酸堿水電解質紊亂為主要病理表現,可引起多器官功能的損害,具有較高的疾病致死率。研究發現:T1DM患兒多達20.0%~30.0%[3],以DKA為首發癥狀起病,且DKA發生率與年齡呈負相關,極大增加患兒治療難度。研究證實:有效控制血糖至正常水平,糾正機體酸中毒和高酮血癥是治療兒童T1DM的關鍵。胰島素是兒童T1DM主要治療藥物,既往臨床多行MSII治療,但多次皮下注射不僅加重患兒痛苦,降低治療依從性,且伴隨強化治療開展,導致其療效受限、低血糖風險增加等多種問題[4]。研究發現[5],CSII能較好模擬胰島素生理功能,更利于機體血糖水平的穩定,更好改善患兒中毒癥狀,減少低血糖等并發癥風險。因此,本研究筆者就對MSII和CSII治療T1DM患兒療效及安全性,以及對血細胞因子表達影響展開報道,旨在為臨床提供指導。
資料與方法
1 一般資料 選取我院2015年12月至2017年3月收治的1型DKA患兒94例,納入標準[6]:①均符合2010年世界衛生組織(WHO)關于TIDM診斷標準;②年齡均在2~15歲;③未合并嚴重心腦血管、肝腎肺等器官組織疾病;④患兒或家屬均自愿參與并簽署知情同意書。排除標準:①因藥物、消化道出血等原因等因素所致的DKA;②2型糖尿病患兒;③對本研究藥物過敏或近期服用免疫抑制劑;④合并急慢性感染、免疫系統、血液系統等嚴重疾病;⑤合并惡性腫瘤。采用隨機數字法將其分為對照組和觀察組,每組各47例。對照組患兒中,男30例,女17例,年齡2~15歲,平均8.20±5.68歲,病程5個月至6年,平均2.79±0.88年;觀察組患兒中,男28例,女19例,年齡2~15歲,平均8.14±5.62歲,病程4個月至5年,平均2.61±0.83年。兩組患兒在性別、年齡及病程等一般資料比較,差異均無統計學意義(P>0.05),具有可比性。
2 治療方法 兩組患兒入院后均給予常規糾正DKA療法治療,包括抗生素抗感染、及時靜脈補液、營養支持等及對癥治療等。觀察組患兒應用胰島素泵皮下持續輸注生物合成胰島素治療,首先以0.1U/(kg·h)劑量和滴速治療,當尿酮轉陰和酸中毒消退后,將劑量調整為0.6~1.0U/(kg·d),同時餐前需追加胰島素治療。對照組患兒首先接受生物人工合成胰島素持續靜脈滴注治療,開始以0.1U/(kg·h)劑量,隨后根據血糖控制效果調節劑量,當血糖控制在13.0 mmol/L時改為4.0 g 5.0%葡萄糖注射液與1U胰島素混合滴注,當尿酮轉陰和酸中毒消失后,改用皮下注射胰島素治療,于三餐前及睡前皮下注射治療。
3 觀察指標 ①比較兩組患兒的血糖達標時間、DKA糾正時間、尿酮轉陰時間、pH值糾正時間、每日胰島素用量、住院時間及低血糖發生率;②比較兩組患兒治療前后的二氧化碳結合力(CO2-CP)、糖化血紅蛋白(HbAlc)、陰離子間隙(AG)、C肽等指標水平;③比較兩組患兒治療前后的巨噬細胞移動抑制因子(MIF)和單核細胞趨化蛋白-1 (MCP-1)表達水平。
4 檢測方法 采用德國拜耳血氣分析儀監測兩組患兒pH值、酸堿水電解質代謝變化;同時采用CGMS-2009型實時動態血糖監測儀(湖南天泰保健器械銷售有限公司)監測血糖水平變化;采用微標法測定治療前后HbAlc水平,試劑盒由沈陽萬類生物科技有限公司生產,采用酶聯免疫吸附法(ELISA)測定MIF和MCP-1表達水平,試劑盒由生產,所有步驟均嚴格參考操作說明書進行。
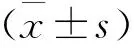
結 果
1 兩組患兒療效指標比較 見表1。觀察組患兒的血糖達標時間、DKA糾正時間、尿酮轉陰時間、pH值糾正時間、每日胰島素用量、住院時間均明顯低于對照組(P<0.05)。
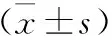
表1 兩組患兒療效指標比較
注:與對照組比較,*P<0.01
2 兩組患兒治療前后的各T1DM轉歸指標比較 見表2。兩組患兒的基線CO2-CP、HbAlc、AG及C肽水平比較均無統計學差異(P>0.05);治療后,觀察組患兒的CO2-CP和C肽水平均明顯高于對照組(P<0.01),而HbAlc和AG水平均明顯低于對照組(P<0.01)。
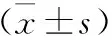
表2 兩組患兒治療前后各T1DM轉歸指標比較
注:與對照組比較,*P<0.01;與治療前比較,#P<0.05
3 兩組患兒治療前后的MIF和MCP-1表達水平比較 見表3。兩組患兒治療前的MIF和MCP-1表達水平比較均無統計學差異(P>0.05);治療后,觀察組患兒的MIF和MCP-1表達水平均明顯低于對照組(P<0.01)。
4 兩組患兒的低血糖發生率比較 觀察組患兒的低血糖發生率為4.26%,對照組患兒的低血糖發生率為19.19%,觀察組明顯低于對照組(P<0.05)。
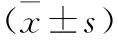
表3 兩組患兒治療前后MIF和MCP-1表達水平比較
注:與對照組比較,*P<0.01;與治療前比較,#P<0.05
討 論
糖尿病是兒童常見的慢性代謝性疾病,且多以T1DM為主,主要因機體胰島素β細胞破壞引起的胰島素絕對分泌不足所致,機體血糖如得不到及時控制,可導致各系統急慢性感染、神經病變、心血管病變以及DKA等多種并發癥,直接危及患兒生命安全。研究顯示[7]:DKA是兒童T1DM最常見的急性并發癥,常由急性感染、過度勞累、暴飲暴食及應激反應的因素引起,具有起病急、病情進展快及多變等特點,是造成T1DM患兒死亡的重要原因,且患兒往往就診時已合并DKA,極大提高臨床就診難度。研究顯示[8]:當T1DM患兒出現DKA時,機體血糖水平可出現顯著升高,并伴有胰島素嚴重分泌不足,引起脂肪大量分解產能,而該過程中酮體過多產生,超過正常肝腎代謝能力,使血液中酮體聚集,導致機體酸中毒,直接威脅患兒生命安全。而1型DKA患兒對胰島素敏感度較高,機體血糖波動幅度大。因此,如何在短時間內控制血糖和HbAlc至正常水平,糾正機體中毒狀態是搶救1型DKA患兒的關鍵所在[9]。
研究證實[10],強化胰島素治療1型DKA患兒最強有力的治療手段,可迅速控制機體血糖,促進胰島β細胞功能恢復,抑制脂肪分解產生酮體,從而改善機體重癥癥狀,并能抑制視網膜、神經、腎臟及心血管并發癥進展。小劑量胰島素靜脈輸注是既往常用的治療方法,根據患兒血糖波動情況調整胰島素用量,促進血糖及酮體代謝恢復。但研究發現:該方法每日需多次行皮下注射,胰島素劑量控制難度大,無法實現持續性治療,導致機體胰島素分布不均勻,易誘發低血糖甚至腦水腫等并發癥[11]。同時多次皮下注射易造成患兒依從性降低,影響胰島素治療療效。CSII在臨床開展已有20余年,被稱之為“人工胰島”[12],其優勢體現在微電腦控制下的人工智能控制,經微電腦控制下的脈沖式皮下注射模式,有效模擬生理胰島素分泌,實現24h動態胰島素合理補充,使夜間和用餐間期血糖更為穩定,同時根據食物類型及用量,調節胰島素劑量及輸注方式,保證了用餐前后血糖穩定,降低低血糖發生率,并能減少每日胰島素用量,使血糖持續維持在理想范圍,抑制脂肪過度分解從而減少酮體生成,進而糾正DKA狀態[13]。本研究結果顯示,觀察組患兒的血糖達標時間、DKA糾正時間、尿酮轉陰時間、pH值糾正時間、每日胰島素用量、住院時間及低血糖發生率均明顯低于對照組,表明CSII對1型DKA患兒的降血糖和改善DKA效果更為迅速,且控制血糖效果更好,使低血糖發生率及胰島素用量得以降低。研究證實:1型DKA患兒氧化應激明顯增強,并伴有炎癥因子和脂質過氧化物大量生成,出現二氧化碳結合力(CO2-CP)降低和陰離子間隙(AG)增加等代謝性酸中毒表現。本研究結果顯示:觀察組治療后的CO2-CP明顯高于對照組,而AG明顯低于對照組,證實CSII對1型DKA患兒DKA糾正效果更佳。既往研究證實,MIF和MCP-1表達與2型糖尿病發生發展密切相關。而最近研究發現[14],MIF和MCP-1同樣參與兒童T1DM發生發展,參與心血管、腎臟等并發癥發生,對患兒預后轉歸具有一定指導意義。本研究結果顯示:觀察組治療后的MIF和MCP-1表達水平均明顯低于對照組,進一步證實CSII對患兒血糖控制和延緩并發癥進展效果更佳。
綜上所述,胰島素泵持續皮下注射胰島素能有效糾正1型DKA患兒機體代謝紊亂,促進中毒癥狀消退,抑制血細胞因子表達,且治療安全性較高。
[1] 郭 紅,白 玲,米爾班.1型糖尿病患兒胰島素泵治療與多次皮下注射胰島素強化治療效果比較[J].中國醫藥,2014,9(3):342-344.
[2] Cohen M,Leibovitz N,Shilo S,etal.Subcutaneous regular insulin for the treatment of diabetic ketoacidosis in children[J].Pediatric Diabetes,2016, 18(4):290-296.
[3] 劉貴陽,辜 勇,廖學東,等.不同胰島素給藥方式救治糖尿病酮癥酸中毒臨床研究[J]. 現代生物醫學進展,2013,13(26):5075-5078.
[4] 龐雅玲,楊麗華.胰島素泵治療對2型糖尿病合并妊娠產婦血糖控制及新生兒的影響觀察[J].中國婦幼保健,2016,31(24):5501-5503.
[5] Blackman SM,Raghinaru D,Adi S,etal.Insulin pump use in young children in the T1D Exchange clinic registry is associated with lower hemoglobin A1c levels than injection therapy[J].Pediatric Diabetes,2014,15(8):564-572.
[6] 段素靜,諶劍飛,譚 薇.短期持續胰島素輸注治療酮癥起病的2型糖尿病療效觀察[J]. 中西醫結合心腦血管病雜志,2013,11(3):363-364.
[7] 葉先智.不同方案胰島素靜注治療糖尿病酮癥酸中毒療效對比研究[J].實用臨床醫藥雜志,2015,19(15):103-105.
[8] Aronson R,Reznik Y, Conget I,etal. Sustained efficacy of insulin pump therapy compared with multiple daily injections in type 2 diabetes: 12‐month data from the OpT2mise randomized trial[J]. Diabetes Obesity & Metabolism, 2016, 18(5):500-507.
[9] 李東風.小劑量胰島素持續靜脈滴注聯合胰島素泵治療糖尿病酮癥酸中毒的療效觀察[J].山西醫藥雜志,2013,42(6):671-672.
[10] 余曉慧.短期持續皮下胰島素輸注對初診2型糖尿病患者胰島功能、血脂及C反應蛋白的影響[J].中國綜合臨床,2014,30(8):863-865.
[11] Peters AL, Henry RR,Thakkar P,etal.Diabetic ketoacidosis with canagliflozin, a sodium-glucose cotransporter 2 inhibitor, in patients with type 1 diabetes[J].Diabetes Care,2016,39(4):532-539.
[12] Bruce B,Beck RW,Ruedy KJ,etal.Effectiveness of early intensive therapy on β-cell preservation in type 1 diabetes[J].Diabetes Care,2013, 36(12):4030-4035.
[13] 高秀艷.門冬胰島素和生物合成人胰島素治療妊娠期糖尿病的療效觀察[J].中國婦幼保健,2014,29(19):3068-3070.
[14] Reznik Y,Cohen O,Aronson R,etal.Insulin pump treatment compared with multiple daily injections for treatment of type 2 diabetes (OpT2mise): a randomised open-label controlled trial[J]. Lancet, 2014, 384(50):1265-1272.

