時間-平均血尿酸水平與新發慢性腎臟病的關系研究
葉美玉 胡康 金娟 胡培英 何強
近年來,隨著國民生活水平的提高,日常飲食中高嘌呤含量的食物攝入量不斷增加,高尿酸血癥(HUA)患病人數日益增多。HUA不僅會導致痛風,還與高血壓、心血管疾病、代謝綜合征以及腎臟疾病等發生相關。同時,由于慢性腎臟病(CKD)發病率居高不下,隨之而來的終末期腎病(ESRD)、心血管疾病和過早死亡等風險的增加[1],CKD已逐漸成為全球性的健康問題。已有動物實驗研究發現,血尿酸水平升高與CKD的發生、發展密切相關[2-4]。大部分流行病學研究結果表明,HUA在CKD的發生、發展中起重要作用[5-7];然而,也有部分學者提出,HUA并不一定是CKD的獨立危險因素,尤其是在調整混雜因素后,原因是HUA患者往往同時伴隨著糖尿病、高血壓、代謝紊亂等導致CKD的易感因素[8-10]。因此,關于血尿酸水平升高是否為CKD的危險因素,目前尚存在爭議。本研究通過對大樣本健康成人進行血尿酸值檢測與腎功能評估,分析并探討普通成人時間-平均血尿酸水平與CKD的關系,現報道如下。
1 對象和方法
1.1 對象 選取2011年1月1日至2016年12月31日在浙江省人民醫院體檢中心每年健康體檢的非CKD普通成人5 701例為研究對象,年齡25~85歲,其中男3 493例,女2 208例。納入標準:初始腎功能正常,即基線估算的腎小球濾過率(eGFR)>60 ml/min/1.73m2,且尿蛋白陰性;無尿路感染、原發性和繼發性腎小球疾病;無精神病史,語言表達能力正常。排除標準:既往患有心血管系統疾病(心絞痛或心肌梗死等)、腦血管疾病(腦中風、腦出血或腦梗死等)、肝功能明顯異常、感染性疾病及惡性腫瘤等患者,有腎臟手術史、曾行腎臟替代治療的患者。
1.2 數據采集 記錄所有研究對象的生理檢查和生化指標結果,包括體檢者2011年初次體檢的個人信息(姓名、性別、年齡),晨起空腹體重、凈身高,計算BMI,測量平靜狀態下收縮壓(SBP)、舒張壓(DBP)。空腹抽取靜脈血標本并利用自動生化酶譜分析儀檢測相關實驗室指標:血尿酸、血肌酐(Scr)、血尿素氮、空腹血糖、TC、TG、HDL-C、LDL-C。取晨尿標本利用散射比濁法測量尿蛋白(定性)。詢問既往史。根據腎臟疾病飲食控制(MDRD)公式計算eGFR=186×Scr-1.154×年齡-0.203(女性×0.742)ml/(min·1.73m2)[11];2011至2016年期間每年記錄血尿酸值并評估eGFR,利用每年檢測的血尿酸值計算時間-平均血尿酸水平。
1.3 分組方法 將該人群2011年初次體檢的結果作為基線特征,根據初始血尿酸的四分位數分為4組,第1組為血尿酸≤297.5μmol/L,第2組為血尿酸297.6~333.2μmol/L,第 3 組為血尿酸 333.3~368.9μmol/L,第 4組為血尿酸>368.9μmol/L。經過6年的隨訪后,將所有研究對象按時間-平均血尿酸的四分位數分為4組,第1組為時間-平均血尿酸≤273.7μmol/L,第2組為時間-平均血尿酸 273.8~333.2μmol/L,第3組為時間-平均血尿酸 333.3~392.7μmol/L,第4組為時間-平均血尿酸>392.7μmol/L。以尿酸4分組為自變量,有無新發CKD為因變量,采用二分類logistic回歸分析和Cox比例風險模型來調整各混雜因素的影響,并計算出各組新發CKD的相對危險度(OR)和風險比(HRs)。
1.4 評價標準 超重診斷標準:24<BMI<28。肥胖診斷標準:BMI≥28。高血壓診斷標準:非同日3次測量血壓,SBP>140mmHg或DBP>90mmHg,或自訴既往有高血壓史。糖尿病診斷標準:空腹血糖≥7.0mmol/L(126mg/dl),或自訴既往有糖尿病史。HUA診斷標準:男性血尿酸>420μmol/L(7mg/dl),女性血尿酸>360μmol/L(6 mg/dl)。CKD 診斷標準:參照2012年改善全球腎臟病預后組織(KDIGO)制定的臨床實踐指南中對CKD的定義,腎臟結構或功能異常,如腎臟損傷指標(如蛋白尿、血尿或解剖學異常)或腎小球濾過率(GFR)<60ml/(min·1.73m2),任一指標異常持續時間>3個月,且這種結構或功能的異常對健康有影響。
1.5 觀察指標 (1)比較不同血尿酸水平組體檢者基線特征;(2)比較新發CKD組與非CKD組體檢者基線特征:經過6年的隨訪,篩選新發CKD與非CKD體檢者;(3)比較不同血尿酸水平組體檢者、不同時間-平均血尿酸水平組體檢者發生CKD的OR值;(4)比較不同血尿酸水平組體檢者、不同時間-平均血尿酸水平組體檢者發生CKD的HRs值。
1.6 統計學處理 應用SPSS 20.0統計軟件;正態分布的計量資料以表示,多組間比較采用單因素方差分析;非正態分布的計量資料以 M(P25,P75)表示,多組比較采用Wilcoxon秩和檢驗;計數資料以頻數和構成比表示,組間比較采用χ2檢驗;采用多因素校正的二分類logistic回歸分析和Cox比例風險模型來調整混雜因素的影響并進行危險因素分析;P<0.05為差異有統計學意義。
2 結果
2.1 不同血尿酸水平組體檢者基線特征比較 見表1。
由表1可見,4組體檢者性別、年齡、BMI、超重率、肥胖率、血壓、血脂指標、血尿素氮、空腹血糖、eGFR、高血壓、CKD患病率等方面比較差異均有統計學意義(均P<0.05),而糖尿病患病率比較差異無統計學意義(P >0.05)。
2.2 新發CKD組與非CKD組體檢者基線特征比較見表2。
由表2可見,新發CKD組體檢者的年齡、BMI、超重率、肥胖率、血壓、血脂指標、血尿素氮、空腹血糖、初始血尿酸、時間-平均血尿酸及HUA、高血壓、糖尿病患病率均高于非CKD組(均P<0.05),而腎功能(eGFR)低于非CKD組(P<0.05)。

表1 不同血尿酸水平組體檢者基線特征比較
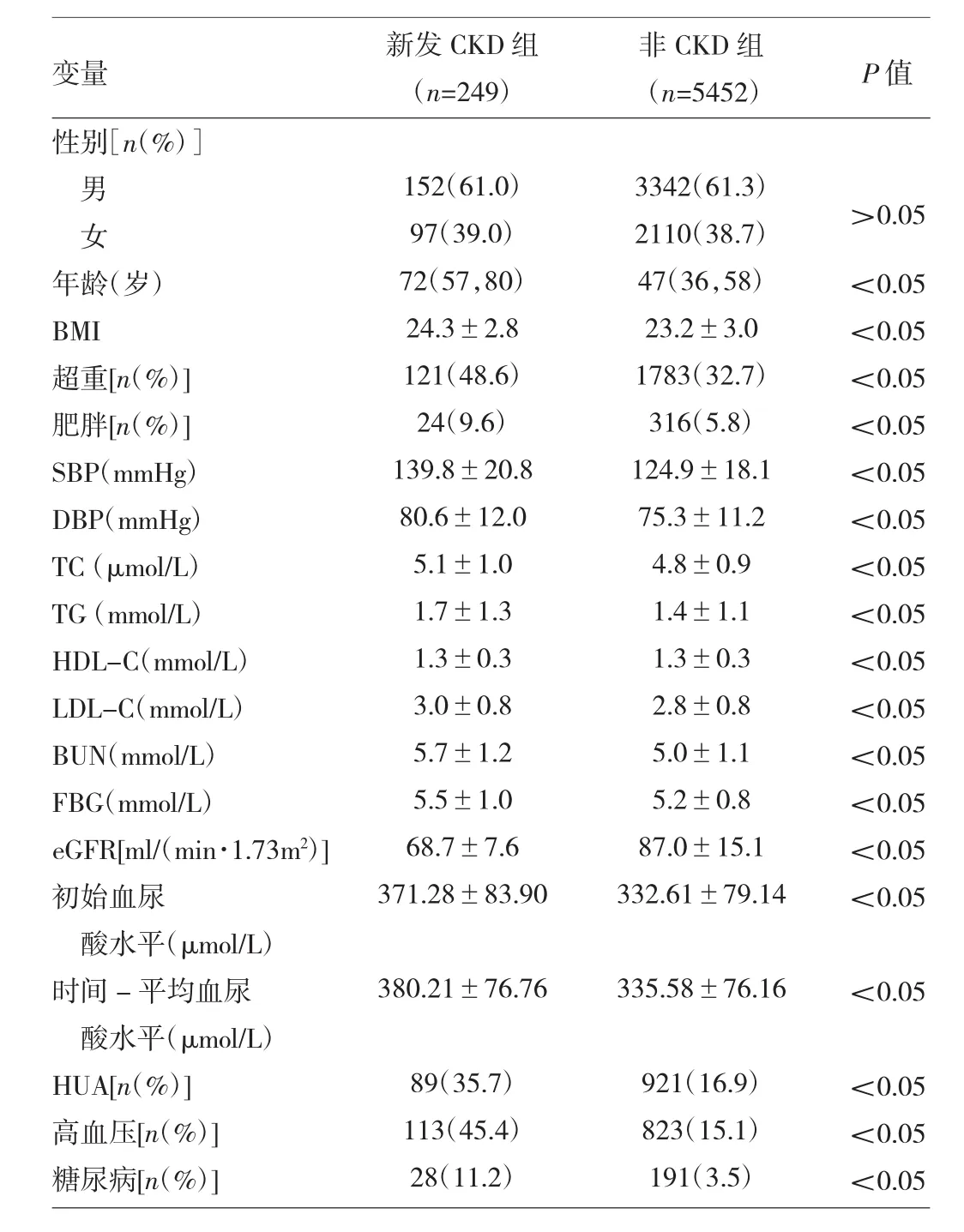
表2 新發CKD組與非CKD組體檢者基線特征比較
2.3 不同血尿酸水平組體檢者、不同時間-平均血尿酸水平組體檢者發生CKD的OR值比較 見圖1。
由圖1可見,對基線血尿酸值各組變量進行二分類logistic回歸分析,發現在校正性別和年齡后,各組發生CKD的OR值隨基線尿酸水平升高而升高。第1組OR=1.00,第 2 組 OR=1.981(95%CI:1.195~3.283,P<0.05),第 3 組 OR=2.177(95%CI:1.277~3.712,P<0.05),第 4組 OR=3.864(95%CI:2.240~6.668,P<0.05)。當進一步調整相關混雜因素后,仍然可見新發CKD風險增加的趨勢,第2~4組OR值分別為1.726(95%CI:1.017~2.930,P<0.05)、1.455(95%CI:0.831~2.547,P >0.05)、2.162(95%CI:1.208~3.870,P<0.05)。而相比之下,隨著年齡和性別校正后時間-平均血尿酸水平的升高,各組發生CKD的OR值增加趨勢比基線尿酸更加明顯,第2~4組 OR 值分別為 3.004(1.567~5.756,P<0.05)、4.794(2.473 ~9.291,P <0.05)、11.718 (5.971 ~22.993,P <0.05)。同樣地,在調整所有混雜因素后,盡管時間-平均血尿酸水平各組新發CKD的OR值均有所下降,但差異仍較基線尿酸顯著 [第2~4組OR值分別為2.709(95%CI:1.386~5.293)、3.754(95%CI:1.898~7.428)、7.462(95%CI:3.694~15.073),均P<0.05]。
2.4 不同血尿酸水平組體檢者、不同時間-平均血尿酸水平組體檢者發生CKD的HRs值比較 見圖2。

圖1 不同組間性別與年齡校正模型和多因素校正模型logistic分析結果

圖2 不同組間性別與年齡校正模型和多因素校正模型Cox生存分析結果
由圖2可見,以新發CKD作為終點事件,將初次出現終點事件的時間加入Cox比例風險模型中進行分析。結果顯示,在校正性別和年齡后,最高基線尿酸組發生CKD的風險率是最低基線尿酸組的4倍(HRs=4.053,95%CI:2.469~6.652,P<0.05);最高時間-平均血尿酸組發生CKD的風險是最低時間-平均血尿酸組的 10 倍 (HRs=10.134,95%CI:5.327~19.279,P<0.05)。進一步調整所有混雜因素后,基線尿酸各組間的風險率均有所減弱,第2~4組HRs值分別為1.532(95%CI:0.947~2.478)、1.316(95%CI:0.809~2.139)、1.689(95%CI:1.058~2.696)。相比之下,時間-平均血尿酸水平各組間發生CKD的風險差異仍較顯著[第2~4 組 HRs值分別為 2.491(95%CI:1.324~4.687)、3.268 (95%CI:1.728~6.180)、6.320 (95%CI:3.285~12.159),均P<0.05]。
3 討論
尿酸是人類嘌呤化合物的代謝終產物,正常人體尿液中的產物主要為尿素氮,含少量尿酸。人類的正常血尿酸濃度為200~450μmol/L,健康男性血尿酸水平是女性的1.2倍左右。尿酸在腎臟排泄的經典模型是由以下4步組成的:腎小球的濾過(100%),腎小管的重吸收(98%~100%)、腎小管的再分泌(50%)、分泌后的再次重吸收(40%)。因此,當尿酸產生過多、腎臟清除尿酸過少或者兩種因素同時存在時,易導致尿酸在人體血液中過度累積。近年來,相關動物實驗及臨床觀察研究表明,HUA易導致腎臟發生腎小球動脈硬化和間質纖維化[12],在糾正高尿酸癥狀后可以顯著改善腎臟血管病變程度,從而減少尿蛋白,進而改善腎功能。目前認為,HUA引起腎臟疾病的機制包括介導腎臟炎癥反應、腎小球入球小動脈病變、趨化因子和細胞因子表達增強、腎素-血管緊張素-醛固酮系統(RAAS)激活和細胞環氧化酶-2(COX-2)活化、介導氧化應激等[13-16]。
流行病學研究不斷證實,HUA與心血管事件及病死率的關聯不僅易發生于慢性腎臟病,高血壓或者基礎心血管疾病的患者身上,且也在存在于正常人群中。在韓國、日本及歐美國家的橫斷面研究中發現,HUA水平與CKD患病風險之間存在相關性[17-19]。一項對日本健康人群和腎功能輕度下降人群血尿酸和CKD進展之間關系的研究顯示,血尿酸水平≥360μmol/L的受試者人群較240~294μmol/L的受試者人群其腎臟損害的風險大大提高[18]。Domrongkitchaiporn等[19]研究者通過對普通人群長達12年的隊列研究證明,血尿酸水平升高是腎功能減退和CKD發病的危險因素。但是,在部分早期的觀察性研究中一些學者持相反的觀點,他們指出CKD患者出現HUA是由患者腎血管阻力增加所致,因此不認為HUA是CKD發病的獨立危險因素[8-10]。Sturm等[9]研究者提出,HUA只在混雜因素校正前具有預示CKD發生的作用,在調整腎功能相關參數例如基線eGFR和蛋白尿后,HUA不再作為CKD發生和進展的危險因素。然而,近期一項包括15個隊列研究在內的Meta分析顯示,在調整代謝相關風險因素后,中年人群血尿酸水平升高和CKD風險增加之間呈正相關[20],這與本研究結果相一致。
本研究采用的是時間-平均血尿酸水平,與單次檢測的血尿酸水平相比,更能準確地反應研究對象體內血尿酸水平維持狀態與其腎功能進展之間的關系,進而強調了定期檢測并有效管理血尿酸水平的重要性,對延緩腎功能進展具有很大的幫助意義。本研究尚存在一些不足之處及局限性。首先,本研究選取的是關注自身健康進而每年定期參與體檢的人群,因此在研究對象的選擇上難以做到絕對的完全隨機。其次,由于是回顧性的橫斷面研究,本研究未能完整地收集研究對象的生活方式,例如飲食習慣、吸煙史、飲酒史、日常鍛煉情況等資料,從而無法排除所有可能對血尿酸水平產生影響的潛在因素,因此,還有待進一步的大樣本前瞻性研究來證實。
綜上所述,本研究探討了普通成人時間-平均血尿酸水平與CKD的關系。首先,研究發現除了HUA,正常范圍內的稍高血尿酸水平同樣與eGFR下降具有相關性,而未發現較低血尿酸水平對腎功能減退的影響。其次,多元回歸分析表明單次高血尿酸水平與時間-平均高血尿酸水平兩者都可作為新發CKD風險增加的獨立危險因素,而時間-平均高血尿酸水平更具有預測意義,并且這種關系獨立于其他可能的混雜因素,例如性別、年齡、高血壓、糖尿病、肥胖等。
[1]Tonelli M,Wiebe N,Culleton B,et al.Chronic kidney disease and mortality risk:a systematic review[J].J Am Soc Nephrol,2006,7(7):2034-2047.
[2]Kang DH,Nakagawa T,Feng L,et al.A role for uric acid in the progression of renal disease[J].J Am Soc Nephrol,2002,13(12):2888-2897.
[3]Sanchez-Lozada LG,Tapia E,Santamaria J,et al.Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats[J].Kidney Int,2005,67(1):237-247.
[4]Sanchez-Lozada LG,Lanaspa MA,Cristobal-Garcia M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-78.
[5]Obermayr RP,Temml C,Knechtelsdorfer M,et al.Predictors of new-onset decline in kidney function in a general middle-european population[J].Nephrol Dial Transplant,2008,23(4):1265-1273.
[6]Weiner DE,Tighiouart H,Elsayed EF,et al.Uric acid and incident kidney disease in the community[J].J Am Soc Nephrol,2008,19(6):1204-1211.
[7]Obermayr RP,Temml C,Gutjahr G,et al.Elevated uric acid increases the risk for kidney disease[J].J Am Soc Nephrol,2008,19(12):2407-2413.
[8]Madero M,Sarnak MJ,Wang X,et al.Uric acid and long-term outcomes in CKD[J].Am J KidneyDis,2009,53(5):796-803.
[9]Sturm G,Kollerits B,Neyer U,et al.Uric acid as a risk factor for progression of non-diabetic chronic kidney disease?The Mild to Moderate KidneyDisease(MMKD)Study[J].Exp Gerontol,2008,43(4):347-352.
[10]Kuriyama S,Maruyama Y,Nishio S,et al.Serum uric acid and the incidence of CKD and hypertension[J].Clin Exp Nephrol,2015,19(6):1127-1134.
[11]Ma YC,Zuo L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[12]Filiopoulos V,Hadjiyannakos D,Vlassopoulos D.New insights into uric acid effects on the progression and prognosis of chronic kidney disease[J].Ren Fail,2012,34(4):510-520.
[13]Zhou Y,Fang L,Jiang L,et al.Uric acid induces renal inflammation via activating tubular NF-κB signaling pathway[J].PLoS One,2012,7(6):e39738
[14]Sanchez-Lozada LG,Lanaspa MA,Cristobal-Garcia M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-78.
[15]Rabadi MM,Kuo MC,Ghaly T,et al.Interaction between uric acid and HMGB1 translocation and release from endothelial cells[J].Am J Physiol Renal Physiol,2012,302(6):F730-741.
[16]Corry DB,Eslami P,Yamamoto K,et al.Uric acid stimulates vascular smooth muscle cell proliferation and oxidative stress via the vascular renin-angiotensin system[J].J Hypertens,2008,26(2):269-275.
[17]Mok Y,Lee SJ,Kim MS,et al.Serum uric acid and chronic kidney disease:the Severance cohort study [J].Nephrol Dial Transplant,2012,27(5):1831-1835.
[18]Toyama T,Furuichi K,Shimizu M,et al.Relationship between Serum Uric Acid Levels and Chronic Kidney Disease in a Japanese Cohort with Normal or Mildly Reduced Kidney Function[J].PLoS One,2015,10(9):e0137449.
[19]Domrongkitchaiporn S,Sritara P,Kitiyakara C,et al.Risk factors for development of decreased kidney function in a southeast Asian population:a 12-year cohort study[J].J Am Soc Nephrol,2005,16(3):791-799.
[20]Zhu P,Liu Y,Han L,et al.Serum uric acid is associated with incident chronic kidney disease in middle-aged populations:a meta-analysis of 15 cohort studies[J].PloS One,2014,9(6):e100801.

