重組膠原酶Bacillus cereus ColM13的酶學及結構特性分析
劉麗莉,楊陳柳,李玉,梁嚴予,孟圓圓,代曉凝,陳珂
(河南科技大學 食品與生物工程學院,河南 洛陽,471023)
我國是畜產品的生產大國,具有豐富的牛骨資源,然而只有為數有限的蛋白酶可以引起牛骨膠原蛋白的降解,導致長期以來,我國絕大多數牛骨資源尚未得到有效的開發利用[1-2]。如果能夠利用生物酶工程技術的優勢,對牛骨進行深加工,開發功能性骨蛋白肽,不僅可以解決牛骨資源浪費問題,而且還能夠帶來一定的經濟效益,將為我國畜禽骨骼資源的深度開發利用提供新的研究思路。牛骨骼中的膠原蛋白經酶解后,可以得到骨膠原多肽,它不僅能夠抗氧化、抗衰老、促進礦物質吸收等,而且在營養吸收方面,比膠原蛋白效果更佳[3-5]。
目前有關微生物源膠原蛋白酶的產生菌的報道有溶組織梭菌[6],Bacillussp.MO-1[7],CandidaalbicansURM 3622[8]和VibriovulnificusCYK279H[9]等等,但是這些菌株大部分為致病菌,在產膠原蛋白酶時,病原菌也產生相應的毒素,并不適合大規模生產。因此,目前市售的膠原蛋白酶菌株及相關研究都很少[10-11]。如趙妍嫣等[12]采用胰蛋白酶作用于骨膠原,結果表明與膠原蛋白相比,酶解后的蛋白肽有更好的乳化性和溶解性; ZHANG等[13]將牛骨膠原通過6種常規蛋白酶處理與不處理進行對比發現,處理后的產物膠原蛋白肽可以降低血壓。但這些研究所采用的蛋白酶對骨骼的降解程度仍未達到較佳的工業利用價值。本研究以蠟樣芽胞桿菌BacilluscereusMBL13-U來源的目的基因為模板,成功構建出工程菌pET30a-ColM13/BL21,對工程菌表達純化出的重組膠原酶(ColM13)的酶學性質進行研究,并對經BSC和ColM13處理的膠原蛋白進行結構特性分析,結果表明,與BacilluscereusMBL13-U分離純化出的膠原酶(BSC)相比,ColM13對骨膠原蛋白有更好的降解效果,這為今后的工業化生產提供了理論依據。
1 材料與方法
1.1 材料與試劑
牛跟踺Ⅰ型膠原蛋白,源葉生物有限公司;工程菌pET30a-ColM13/BL21,本課題組構建的表達膠原蛋白酶活性的菌株;茚三酮,天津光復精細化工研究所;其他試劑均為分析純。
1.2 儀器與設備
H1650型高速冷凍離心機,湘儀實驗室儀器有限公司;PHS-3C型pH計,上海精科有限公司;UV2600型紫外可見分光光度計,日本島津有限公司;Perten DA7200型FT-IR紅外光譜儀,德國Bruker公司;熒光分光光度計,美國Aglient Cary Elipse公司。
1.3 方法
1.3.1 ColM13的分離純化
1.3.1.1 LB培養基(含卡那霉素)及配制方法
向100 mL的去離子水中加入NaCl 1.0 g,酵母粉0.5 g,蛋白胨1.0 g,于121 ℃滅菌鍋中滅菌20 min,冷卻后向其中加入50 mg/mL Kana 100 μL。
1.3.1.2 ColM13的分離純化
按1%接種量將工程菌pET30a-ColM13/BL21接種至LB液體培養基(含卡那霉素),在37 ℃、180 r/min的條件下過夜培養。向5 mL LB培養液(含Kana)中加入1%培養物,再恒溫培養約3~4 h至細菌的OD600值為0.3~1.0左右。在37 ℃的培養條件下,向工程菌培養液中加入1‰ IPTG(100 mmol/L)進行誘導,誘導時間為4 h。將培養物以5 000g離心,時間10 min,收集沉淀。然后用配好已滅菌的800 μL PBS溶液吹打洗滌,進行超聲波破碎后離心(破碎條件為冰浴、400 W、20 min、超聲2 s間歇3 s),上清即為ColM13的粗酶液,然后使用Ni-NTA親和層析對ColM13進行純化[14]。
1.3.2 ColM13最適溫度及熱穩定性研究
分別在不同溫度下(20、30、37、40、45、50、55、60、70 ℃)測定ColM13酶活,以確定ColM13的最適溫度,將最適溫度下確定的ColM13酶活定為100%,其余溫度下測定的ColM13酶活與之相比得到相對酶活;將ColM13分別在20、30、37、40、45、50、55、60、70 ℃的條件下處理1 h,冷卻后在最適溫度下測定ColM13酶活,將未處理的ColM13酶活定為100%,其余溫度條件下測得的ColM13酶活與之相比得到相對酶活,ColM13酶活采用茚三酮顯色法進行測定[15-16]。
1.3.3 ColM13最適pH及pH穩定性研究
分別在pH 3.0~11.0的條件下測定ColM13酶活,以確定ColM13的最適pH,將最適pH條件下測定的ColM13酶活定為100%,其余pH值下測定的ColM13酶活與之相比得到相對酶活;將ColM13分別在pH 3.0~11.0的條件下處理1 h,然后在最適pH下測定酶活,以未處理的重組酶活作為100%,其余pH值下測得的ColM13酶活與之相比得到其相對酶活。
1.3.4 蛋白酶抑制劑對ColM13酶活性的影響
在反應體系中加入PMSF,EDTA,EGTA和β-巰基乙醇等蛋白酶抑制劑,在最適反應條件下測ColM13酶活力,以未添加抑制劑的ColM13酶活作為100%,加入抑制劑測得的ColM13酶活與之相比得到其相對酶活。
1.3.5 BSC的分離純化
以蠟樣芽胞桿菌BacilluscereusMBL13-U為出發菌種,從發酵制備的粗酶液中分離純化出降解骨膠原蛋白的膠原酶(BSC),分離純化步驟參照文獻[17]。
1.3.6 紫外(UV)掃描分析
將骨膠原蛋白分別用BSC和ColM13進行處理,在近紫外區對處理過的樣品進行200~400 nm的全波長掃描。
1.3.7 差示掃描熱量(DSC)分析
將經BSC、ColM13處理前后冷凍干燥的樣品,放入DSC鋁坩鍋中,加蓋密封鋁坩鍋后,以空鋁坩鍋作為參比。30 ℃保持1 min,從30 ℃升溫到150 ℃,升溫速率為5 ℃/min,120 ℃保持1 min。
1.3.8 熒光光譜分析
將骨膠原蛋白分別用BSC和ColM13進行處理,分別將其放入熒光分光光度計中。實驗中設置激發波長為280 nm,掃描波長為280~700 nm進行掃描[18]。
1.3.9 紅外光譜分析
將一定量干燥后的KBr和經BSC、ColM13處理前后冷凍干燥過的樣品置于瑪瑙研缽中,盡量研磨成粉末狀,裝樣,進行手動壓片,取出樣品小心輕放入樣品室。采用傅立葉變換紅外光譜儀對樣品在400~4 000 cm-1區間掃描。
1.4 數據處理
采用Origin 8.5軟件對試驗數據進行統計分析。
2 結果與分析
2.1 溫度對ColM13酶活力的影響
對ColM13在不同溫度條件(20~70 ℃)下的酶活力進行測定,結果如圖1所示。由圖1-a可知,溫度在20~50 ℃范圍內ColM13酶活力隨著反應溫度的升高而逐漸增高;50 ℃時,酶活達到最大值;55 ℃時,酶活仍能夠保持在85%以上。繼續升高溫度,ColM13酶活力呈顯著性下降,這可能是因為較高的反應溫度破壞了酶的空間結構,從而酶活力下降[19]。因此,ColM13的最佳反應溫度為50 ℃。將ColM13在不同溫度條件下溫育1 h后,測定其殘余酶活力結果如圖1-b所示,在55 ℃以下的溫度(20~55 ℃)溫育1 h后,ColM13酶活力仍能夠保持80%以上;當溫育時的溫度達到55 ℃以上(60 ℃、70 ℃),隨著溫度的升高,殘余的ColM13酶活力明顯下降,幾乎完全失活。因此,當預處理的溫度低于55℃時,ColM13具有較高的熱穩定性。
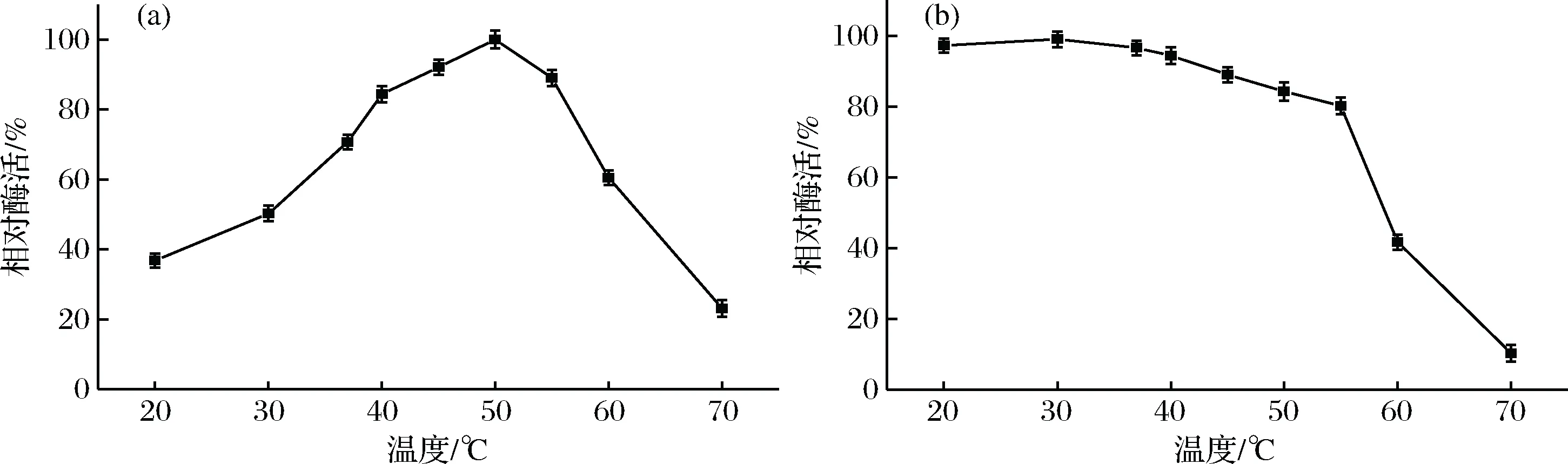
圖1 溫度對重組ColM13相對酶活的影響(a);重組ColM13的熱穩定性分析(b)Fig.1 The influences of temperature on relative activity of recombinant ColM13(a); Temperature stability analysis of recombinant ColM13(b)
2.2 pH對ColM13酶活力的影響
對ColM13在不同pH反應體系(3.0~11.0)下的酶活力進行測定,結果如圖2所示。

圖2 pH對重組ColM13相對酶活的影響(a);重組ColM13的pH穩定性分析(b)Fig.2 The influences of pH on relative activity of recombinant ColM13(a); pH stability analysis of recombinant ColM13(b)
由圖2-a可知,當反應體系在pH 8.0時,ColM13酶活力達到最高;在偏酸、偏堿性的環境中,ColM13酶活會隨著酸堿性的增加而酶活力逐漸降低。因此,ColM13酶活的最適pH值為pH 8.0。ColM13酶活呈現這種現象可能是因為酸、堿環境對酶分子活性中心的催化基團和活性基團的離子化狀態影響較大,同時影響著酶分子活性部位上的相關基團的解離[19]。此外,將ColM13在不同pH的溶液溫育1 h,以測定其對酸、堿溶液的耐受性,殘余酶活力情況如圖2-b所示。在pH 3.0~6.0的范圍內,隨著溶液pH值的逐漸增高,ColM13酶活力也隨之上升;在pH 6.0的條件下,酶活力達到最高;在pH 6.0~9.0的條件下處理ColM13,其酶活仍能夠保持80%以上;當繼續升高溶液的pH,ColM13酶活開始下降,但酶活仍在30%以上,這可能是由于ColM13酶對堿性溶液呈現較好的耐受性。因此,在pH 6.0~9.0的范圍內,ColM13具有較好的穩定性。
2.3 抑制劑對ColM13酶活力的影響
分別用1 mmol/L PMSF,EDTA,EGTA和β-巰基乙醇預處理1 h,然后測定其殘余酶活,以未加抑制劑的為對照,結果如圖3所示。

圖3 抑制劑對重組ColM13酶相對酶活的影響Fig.3 The influences of different inhibitors on relative activity of recombinant ColM13 enzyme
由圖3可知,在反應體系中添加PMSF、β-巰基乙醇后,ColM13酶活幾乎不受影響,其酶活仍保持在80%以上;然而,添加EDTA、EGTA后,ColM13酶活在30%以下。結果表明,金屬蛋白酶抑制劑EDTA、EGTA對ColM13有顯著的抑制作用。
2.4 UV光譜分析

圖4 膠原蛋白酶解前后的紫外光譜分析Fig.4 Analysis of UV spectrum before and after enzymatic hydrolysis of collagen

2.5 DSC掃描分析
采用DSC對一定量的骨膠原蛋白和經BSC、ColM13處理后冷凍干燥的樣品進行分析,結果如圖5所示。

圖5 熱收縮溫度分析Fig.5 Analysis of differential scanning calorimetry
由圖5可以看出,3者的DSC熱變性溫度曲線均出現了明顯的放熱峰,其原因是蛋白質受熱變性導致分子構象發生了變化。蛋白質的熱穩定性與其氨基酸組成相關,疏水性氨基酸比親水性氨基酸比例高的蛋白質一般熱穩定較好[23]。膠原蛋白經過BSC和ColM13處理后的熱變性溫度均升高,這是因為酶解后的膠原蛋白的球狀結構遭到破壞,埋藏在分子內部的疏水基團被釋放出來,同時游離出脯氨酸殘基和賴氨酸殘基,從而使其熱穩定性提高[24]。膠原蛋白經BSC和ColM13處理后的熱變性溫度分別升高了4.75 ℃和8.25 ℃,表明ColM13處理的膠原蛋白具有更好的熱穩定性。
2.6 熒光光譜分析
蛋白質中含有的色氨酸、酪氨酸和苯丙氨酸時產生熒光的主要原因。激發波長280 nm主要激發色氨酸和酪氨酸,激發波長293 nm僅激發色氨酸[25-26]。骨膠原蛋白中不含有色氨酸殘基,因此選擇激發波長為280 nm進行熒光試驗,如圖6所示。

圖6 熒光光譜分析Fig.6 Analysis of fluorescence spectroscopy

2.7 FT-IR光譜分析
骨膠原蛋白和及其降解物膠原蛋白肽的紅外光譜分析,見圖7。
由圖7可知,經BSC和ColM13處理過的膠原蛋白的紅外圖譜幾乎相重合,說明膠原蛋白經2種酶處理后形成的產物在微觀結構上有很大的相似性。牛骨膠原蛋白和膠原蛋白肽的酰胺A均出現在3 320 cm-1附近,這是由N—H伸縮振動引起的,是蛋白的特征吸收,經過兩種酶的降解作用,膠原蛋白肽的吸收峰強度增強,是酶解后的膠原蛋白肽中N—H伸縮振動與氫鍵形成了締合體[28]所導致的。兩種酶處理后的膠原蛋白肽在2 962.98 cm-1和2 960.56 cm-1出現強吸收峰,是—CONH—的特征吸收峰;1 700~1 600 cm-1為酰胺Ⅰ帶,是由多肽骨架的—CONH—的伸縮振動引起,酶解產物在1 653.04 cm-1和1 653.37 cm-1出現強吸收峰,表明酶解后產物為膠原多肽[29]。強吸收峰的原因是由于2種酶破壞了維系膠原蛋白三螺旋結構的氫鍵,增加了二級結構中α-螺旋、β3折疊等結構的數量。1 360~1 200 cm-1為酰胺Ⅲ帶,二者在此波數范圍內均出現特征吸收,為C—H伸縮振動和N—H彎曲振動所產生的,但是膠原蛋白肽具有較強的吸收峰強度,表明在兩種酶作用下骨膠原蛋白的肽鏈發生斷裂,酶解使膠原蛋白二級結構發生明顯變化[29]。

圖7 紅外光譜圖分析Fig.7 Analysis of fourier transform infrared spectrometer
3 結論
(1) 本試驗以課題組成功構建的特異性降解骨膠原蛋白的工程菌pET30a-ColM13/BL21為材料,以酶活為指標,通過研究溫度、pH、抑制劑對ColM13的影響,對工程菌所產ColM13的酶學特性進行分析,得出ColM13的最適反應溫度為50 ℃,最適反應pH為pH 8.0;其在20~55 ℃和pH 6.0~9.0范圍內預處理后仍保持80%的酶活;PMSF、β-巰基乙醇對ColM13酶活性影響不大,金屬蛋白酶抑制劑EDTA、EGTA對ColM13有顯著的抑制作用。

[1] 安廣杰, 胡加松, 王章存,等.豬骨蛋白酶解制取多肽鈣的研究綜述[J].鄭州輕工業學院學報(自然科學版), 2013,28(6):27-31.
[2] 劉麗莉, 馬美湖, 余秀芳,等.膠原蛋白酶產生菌的篩選及酶的分離純化[J].生物工程學報, 2010, 26(2):194-200.
[3] GELSE K, P?SCHL E, AIGNER T.Collagens-structure, function, and biosynthesis[J].Advanced Drug Delivery Reviews, 2003, 55(12):1 531-1 546
[4] HORN M M, MARTINS V C A, PLEPIS A M D G.Interaction of anionic collagen with chitosan: effect on thermal and morphological characteristics[J].Carbohydrate Polymers, 2009, 77(2):239-243.
[5] 柳林, 韋術敏, 程仕偉,等.產膠原酶的琥珀葡萄球菌分離鑒定及其培養優化研究[J].中國釀造, 2016, 35(1):62-67.
[6] BICSAK T A, HARPER E.Purification of nonspecific protease-free collagenase fromClostridiumhistolyticum[J].Analytical Biochemistry, 1985, 145(2):286-291.
[7] OKAMOTO M, YONEJIMA Y, TSUJIMOTO Y, et al.A thermostable collagenolytic protease with a very large molecular mass produced by thermophilicBacillussp.strain MO-1[J].Applied Microbiology and Biotechnology, 2001, 57(1):103-108.
[8] LIMA C A, RODRIGUES P M B, PORTO T S, et al.Production of a collagenase fromCandidaalbicans, URM3622[J].Biochemical Engineering Journal, 2009, 43(3):315-320.
[9] KANG S I, JANG Y B, KONG C J Y.Purification and properties of a collagenolytic protease produced by marine bacteriumVibriovulnificusCYK279H[J].Biotechnology and Bioprocess Engineering, 2005, 10(6):593-598.
[10] ZHANG X X, LI Y, WANG S Y, et al.Identification of a collagenase produced byBacilluscereusR75E isolated from human colostrum[J].Applied Biochemistry and Microbiology, 2015, 51(5):511-521.
[11] 楊光垚.膠原蛋白酶的純化及其基因的克隆與表達研究[D].成都:四川大學, 2004.
[12] 趙妍嫣, 胡林林, 方芳, 等.骨膠原蛋白的酶解工藝條件[J].食品科學, 2010, 31(22): 153-155.
[13] ZHANG Yu-hao, MA Liang, CAI Lu-yun, et al.Effect of combined ultrasonic and alkali pretreatment on enzymatic preparation of angiotensin converting enzyme (ACE) inhibitory peptides from native collagenous materials[J].Ultrasonics Sonochemistry, 2017, 36(5): 88-94.
[14] Lee J M, Lee J, Nam G H, et al.Heterologous expression and enzymatic characterization of γ-glutamyltranspeptidase fromBacillusamyloliquefaciens[J].Journal of Microbiology, 2017, 55(2):147-152.
[15] 萬驥, 王丹, 傅婷, 等.韭菜β-木糖苷酶的分離純化與部分性質研究[J].食品科學, 2016, 37(7): 104-109.
[16] 李陳.一種新的短小芽孢桿菌膠原蛋白酶的分離、純化及酶學性質研究[D].成都: 四川農業大學, 2008.
[17] 劉麗莉.BacilluscereusMBL13-U膠原蛋白酶的分離純化及其降解動力學分析[J].食品與發酵工業, 2017,43(12):13-19.
[18] 俞園園, 劉學謙.類人膠原蛋白與Ca(Ⅱ)相互作用的熒光光譜研究[J].化學工程, 2013, 41(9):1-4.
[19] 莊志凱.凡納濱對蝦蝦頭內源性蛋白酶分離純化與酶學特性研究[D].湛江:廣東海洋大學, 2011.
[20] 溫慧芳, 陳麗麗, 白春清,等.基于不同提取方法的鮰魚皮膠原蛋白理化性質的比較研究[J].食品科學, 2016, 37(1):74-81.
[21] LIN Y K, DENG C L.Comparison of physical-chemical properties of type I collagen from different species[J].Food Chemistry, 2006, 99(2):244-251.
[22] 張曉潔, 張宇昊, 馬良,等.超聲輔助提取兔皮膠原蛋白及其理化特性[J].食品與機械, 2017, 33(1):167-171.
[23] GHRIBI A M, GAFSI I M, SILA A, et al.Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J].Food Chemistry, 2015, 187(11):322-330.
[24] 吳雷, 鄭娟, 劉文濤,等.雞關節軟骨Ⅱ型膠原蛋白結構及性能表征[J].食品與發酵工業, 2016, 42(11):86-90.
[25] 魏曉芳, 劉會洲.熱變性對蛋白質結構及泡沫行為的影響[J].過程工程學報, 2000, 21(4):379-383.
[26] 楊偉, 袁芳, 高彥祥.魚膠原蛋白肽與表沒食子兒茶素沒食子酸酯相互作用的研究[J].光譜學與光譜分析, 2015, 35(1):184-188.
[27] 肖嵐, 李誠, 付剛, 等.5種蛋白酶對豬皮膠原蛋白水解效果的比較研究[J].食品研究與開發, 2015, 36(17): 10-14.
[28] 琚海燕, 劉新華, 但衛華, 等.牛跟腱Ⅰ型膠原纖維的微觀結構與理化性能分析[J].功能材料, 2015(15): 15 031-15 034.
[29] 鐘朝輝, 李春美, 顧海峰,等.溫度對魚鱗膠原蛋白二級結構的影響[J].光譜學與光譜分析, 2007, 27(10):1 970-1 976.

