KISS-1基因表達物對骨肉瘤細胞凋亡和自噬調控機制的研究
劉曉強,吳華明,謝惠,姚熙四川省資陽市安岳縣人民醫院骨科,四川資陽 642350
骨肉瘤是一種罕見的原發性骨腫瘤,在美國占不到1%[1]。然而,它是兒童和年輕人中最常見的原發性骨惡性腫瘤,約占3.4%,占所有兒童癌癥和兒童骨惡性腫瘤的大部分[2]。手術切除腫瘤是治療的基該組成部分,化療已被證明可以改善骨肉瘤患者的生存[3]。然而,骨肉瘤患者的生存率一直保持在3年前的約60%,復發的患者中有85%發生早期肺部轉移[4]。既往文獻顯示,骨肉瘤轉移的發生與 KISS-1/G蛋白偶聯受體54(GPR54)表達異常相關[5]。腫瘤轉移抑制基因 KISS-1作為腫瘤抑制基因在許多腫瘤中都有被證明,如肝癌[6]、乳腺癌[7]、結腸及直腸癌[8]。在骨肉瘤體外培養細胞中,Kiss-1基因表達對細胞增殖和侵襲能力呈負相關[9],此外,Kiss-1基因轉染和過表達后,對人骨肉瘤細胞的增殖和入侵能力可能有所下降。該研究在設計時考慮到這些發現,該實驗于2016年4月—2017年1月在該院細胞實驗室進行,應用K7M2骨肉瘤細胞系進行研究,分別向其加入KISS1基因表達物--Kp或抗Kp蛋白,并分別與普通K7M2細胞體系進行比較,了解骨肉瘤細胞在KISS-1基因表達物的影響下的增殖、凋亡和自噬作用。
1 材料與方法
1.1 主要材料
人骨肉瘤K7M2細胞,KISS1蛋白--Kp及抗Kp蛋白,流式細胞儀,cDNA合成試劑盒,RNA提取試劑盒,SYBR Premix EX Taq和定量PCR試劑盒,MTT試劑盒。
1.2 方法
細胞培養24、48、72 h和96 h后,用MTT染色法檢查每個培養瓶細胞的增殖情況,流式細胞檢測儀分析細胞凋亡情況。RT-PCR檢測培養72 h后的凋亡標記物(P53、CytC)及自噬標記物(P62、Beclin1)的 mRNA表達水平。
1.2.1 分組 對數生長期的骨肉瘤細胞K7M2在分別在加入 Kp(100 nmol/L)或者抗 Kp蛋白(100 nmol/L)的培養液中培養,并將其對應地分為Kp組及Anti-Kp組,且以普通培養的K7M2細胞形成控制對照組。
1.2.2 細胞傳代及培養 加0.25%胰蛋白酶消化后,加入含10%FBS的DMEM懸液細胞,懸液1 000 rpm×5 min離心,棄上清加入常規培養液重懸,以1×105/mL接種于新的培養瓶,將培養瓶置入37℃、5%CO2的飽和濕度培養箱內培養,以后隔日換液,并適時拍照記錄。
1.2.3 細胞增長率檢測 胰蛋白酶消化法收集細胞,96孔板每孔放置1×106/mL的懸浮細胞100 μL,細胞于37℃ 5%CO2分別孵育 24、48、72、96 h 后,分別加入 10 μL的MTT溶液5 mg/mL后繼續孵育4 h。離心,每孔加入150 μL二甲基亞砜,低速振蕩8 min使結晶物充分溶解后,在酶聯免疫檢測儀OD 490 nm測量各孔的吸光值,重復3次取平均值。
1.2.4 細胞凋亡率檢測 細胞接種后,于37℃5%CO2分別孵育24、48、72、96 h后,分別收集各時段細胞并PBS洗滌一次。用4%多聚甲醛固定細胞30 min,PBS洗滌,用含0.1%Triton X-100的PBS重懸細胞,冰育2 min后,再次PBS洗滌1次,加入50 μL的TUNEL檢測液(TdT酶+熒光標記液+TUNEL檢測液),37℃避光孵育60 min,PBS懸浮,在細胞流式細胞儀進行檢測。
1.2.5 P53、CytC和P62、Beclin1的mRNA表達檢測細胞接種72 h后,RNA提取試劑盒提取RNA,cDNA第一鏈試劑盒合成cDNA第一鏈。由Takara生物合成各引物(PCR 引物:p53:正向 5'-tacatgtgttaacagttcctgca-3';反向引物 5'-ttctgacaacgatcggagga-3';溫度 55℃;CytC:正向引物 5'-GATTGACCAGGAAGCTGCAG-3',反向引物5'-CCACCAAAATCTCCTGCGTT-3';溫度55℃;P62正向引物 5'-GACTACGACTTGTGTAGCGTC-3',反向引物 5'-AGTGTCCGTGTTTCACCTTCC-3';Beclin1:正向引物5'-CGGGATCCATGGAAGGGTCTAAGACGTCC-3',反向引物5'-CGGAATTCTCATTTGTTATAAAATTG TGAGG-3';溫度 55℃)。 由 2.5 μL 5×緩沖+1.5 μL 氯化鎂+0.5+1 μdNTPμL L GAP-43 的正義和反義引物+0.3 μL Taq 酶+2 μcDNA 模板和水的反應 25 μL,條件 95℃ 5 min,95℃ 30 s、62℃ 30 s、72℃ 30 s, 重復循環35次,最終以72℃10 min延伸。后行瓊脂糖凝膠電泳,紫外燈下觀察結果,采用凝膠圖像分析系統,對電泳條帶進行密度掃描。
1.3 統計方法
采用SPSS 24統計學軟件進行統計分析。所有計量數據以均數±標準差(±s)表示,采用方差分析(ANOVA)方法進行分析比較,采用LSD-t法進行檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 細胞培養24、48、72、96 h后增殖率的比較
在對照組和Anti-Kp組的細胞增殖率處于增長狀態,Anti-Kp組的細胞增殖率明顯高于對照組,差異有統計學意義(P<0.05),在控制組和 Kp組比較中,Kp組的細胞增殖率明顯低于對照組,且隨時間推移呈現下降趨勢,差異有統計學意義(P<0.05),見表 1。
表 1 各組細胞的增殖率[(±s),%]
注:Kp 組與對照組比較,P<0.05;Anti-Kp 組與對照組比較,P<0.05。
組別24 h 48 h 72 h 96 h對照組Kp組Anti-Kp 組0.660±0.075 0.530±0.083 0.677±0.093 0.818±0.095 0.468±0.088 0.905±0.121 1.105±0.167 0.377±0.058 1.217±0.142 1.330±0.214 0.328±0.044 1.465±0.194
2.2 細胞培養 24、48、72、96 h凋亡率的比較
在Kp組的細胞凋亡率處于上升狀態,對照組和Anti-Kp組的細胞凋亡率變化不明顯。Kp組與對照組比較,差異有統計學意義(P<0.05),見表 2。
表 2 各組細胞凋亡率[(±s),%]

表 2 各組細胞凋亡率[(±s),%]
注:Kp組與對照組比較,P<0.05。
組別24 h 48 h 72 h 96 h對照值Kp值Anti-Kp 值15.89±2.73 24.53±3.65 8.65±1.47 15.67±2.58 27.54±4.65 9.18±1.47 16.28±2.40 35.77±5.03 8.60±1.68 16.53±2.68 39.75±8.32 9.37±1.39
2.3 P53、Cytc、P62、Beclin1 的 mRNA 表達水平比較
細胞接種培養72 h后,Kp組的凋亡標記物(P53、Cytc)和自噬標記物(P62、Beclin1)的 mRNA 表達明顯高于對照組,差異有統計學意義(P<0.05)。Anti-Kp組凋亡標記物(P53、Cytc )和自噬標記物(P62、Beclin1)的mRNA表達明顯低于對照組,兩組差異有統計學意義(P<0.05),見表 3。
表 3 P53、P62、Cytc、Beclin1 的 mRNA 表達水平(±s)
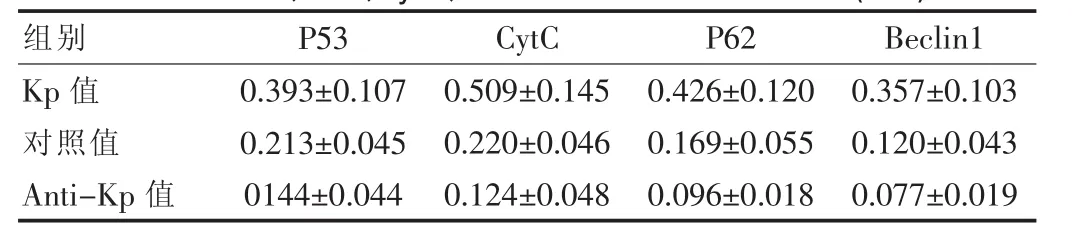
表 3 P53、P62、Cytc、Beclin1 的 mRNA 表達水平(±s)
注:Kp 組與控制組 P53、P62、Cytc、Beclin1 的 mRNA 表達的比較,P<0.05;Anti-Kp 組與控制組 P53、P62、Cytc、Beclin1 的 mRNA 表達的比較,P<0.05。
組別P53CytC P62 Beclin1 Kp值對照值Anti-Kp值0.393±0.107 0.213±0.045 0144±0.044 0.509±0.145 0.220±0.046 0.124±0.048 0.426±0.120 0.169±0.055 0.096±0.018 0.357±0.103 0.120±0.043 0.077±0.019
2.4 方差分析 P53、P62、Cytc、Beclin1 的 mRNA 表達差異性比較
細胞接種培養72 h后行(ANOVA)方法進行組間比較,在 Kp 組或者 Anti-Kp 組內 P53、P62、Cytc、Beclin1各自的mRNA表達量差異無統計學意義(P>0.05)(表4),說明Kp或Anti-Kp對它們的促進或者抑制各基因表達的作用強度在統計學上沒有明顯差異性。
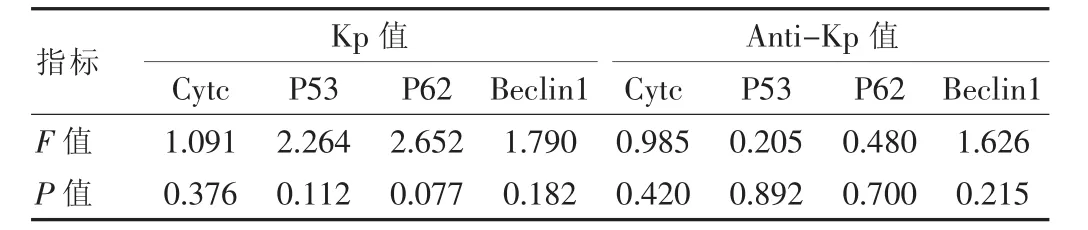
表4 方差分析P53、P62、Cytc、Beclin1的mRNA表達差異性比較
3 討論
KISS-1基因主要表達在胎盤組織中,但也可以表達于中樞神經系統、睪丸、卵巢、胰腺和小腸[10],近年研究發現,KISS-1基因在腫瘤的發生、發展過程中起著重要的作用[11]。Kp是GPR54的內源性配體,是KISS-1翻譯產物。Kp和GPR54之間的相互作用可以激活受體,通過信號傳導通路在細胞內引起一系列的影響,包括激活磷脂酶,鈣內流和膠原酶活性的調節,激活PI釋放花生四烯酸,活化的MAPK網絡和細胞外信號調節蛋白激酶1和2(ERK1和ERK2)[12]。然而,同樣的相互作用,也可以抑制趨化活性[13]。抗Kp蛋白具有拮抗Kp的作用,達到抑制Kp功能的能力。
該研究結果顯示,細胞培養96 h后,對照組細胞增殖率均數百分比由(0.660±0.075)%變為(1.330±0.214)%,Anti-Kp組細胞增殖率均數百分比由(0.677±0.093)%變為(1.465±0.194)%,而 Kp 組細胞增殖率均數百分比由(0.530±0.083)%變為(0.328±0.044)%,對照組和Anti-Kp組細胞增殖率隨時間延長而增加,而Kp組細胞增殖率呈下降趨勢。此外,Anti-Kp組細胞增殖率高于對照組,而Kp組細胞增殖率最低。基于此,似乎KISS-1表達物具有抑制骨肉瘤細胞增殖的作用,可以作為抑癌基因發揮抑癌作用。KISS-1基因表達物也顯示在骨肉瘤細胞凋亡中具有重要作用,對照組隨時間變化凋亡率無明顯差異,而在Kp組細胞凋亡率均數百分比由(24.53±3.65)%變為(39.75±8.32)%,細胞凋亡率最高,而在Anti-Kp組凋亡率均數百分比由(8.65±1.47)%變為(9.37±1.39)%,變化率最低,故此可以認為,Kp蛋白可能具有促進細胞凋亡的作用,也可認為KISS-1基因表達物在骨肉瘤細胞的凋亡中起著一定的作用,且有利于骨肉瘤細胞的凋亡。同理,也就意味著在機體中,KISS-1基因可能促進骨肉瘤細胞的凋亡作用,進而起到減緩骨肉瘤發生、發展的能力。
凋亡基因P53和CytC在真核細胞促進細胞凋亡中起重要的作用,具有決定細胞凋亡的作用。在該次的研究與對照組相比顯示,細胞接種培養72 h后,對照組的 P53和 CytC的 mRNA表達水平均數為 (0.213±0.045)和(0.220±0.046),Kp 組 P53 和 CytC 的 mRNA 表達量均數為(0.393±0.107)和(0.509±0.145),可見對照組P53、CytC基因的相對表達水平基本保持不變,而Kp組的P53、CytC基因的mRNA表達水平升高,Anti-Kp組的P53、CytC基因的mRNA表達水平減低,另外,對照組和Anti-Kp組細胞凋亡率較低,故此,可以認為Kp蛋白具有促進凋亡基因P53、CytC表達的能力,進而認為KISS-1基因在機體中的表達具有促進凋亡基因(P53、CytC)表達,以此來達到抑制骨肉瘤的發展。
自噬不同于凋亡,具有典型的自噬體在細胞內形成,Beclin1作為細胞的自噬基因在細胞自噬方面發揮重要的作用[14]。PI3K復合物III激活自噬體的形成,引導相關蛋白Beclin1發生自噬反應[15]。P62與Beclin1密切相關,且同時作為細胞自噬標記基因[16]。細胞在培養過程中,P62和Beclin1在控制組的mRNA表達量均數為(0.169±0.055)和(0.120±0.043),而在 Kp 組 P62 和Beclin1mRNA 表達量均數為(0.426±0.120)和(0.357±0.103)。相對表達水平的P62和Beclin1基因在控制組無明顯變化,但在Kp組P62和Beclin1 mRNA表達水平明顯升高,提示Kp蛋白可能具有促進自噬基因(P62、Beclin1)表達的能力,在培養中具有促進骨肉瘤細胞的自噬反應。
綜上所述,可以看出KISS-1基因表達物具有抑制骨肉瘤增殖、促進細胞凋亡的作用,同時還能促進凋亡基因(P53 和 CytC)和自噬基因(P62、Beclin1)的表達作用,通過加快凋亡和自噬過程抑制骨肉瘤細胞增殖。在該研究中發現,抗Kp蛋白具有拮抗KISS-1基因的表達蛋白Kp的功能表現,也進一步證明KISS-1基因的抑癌作用,其有望成為一個新的骨肉瘤藥物治療的靶點。
[1]Bennion NR,Baine MJ,Malouff T,et al.Osteosarcoma of the Larynx:Treatment Outcomes and Patterns of Failure Analysis[J].Rare Tumors,2017,9(1):6955.
[2]Spix C,Grosche B,Bleher M,et al.Background gamma radiation and childhood cancer in Germany:an ecological study[J].Radiation&Environmental Biophysics,2017,56(1):1-12.
[3]Berner K,Hall KS,Monge OR,et al.Prognostic factors and treatment results of high-grade osteosarcoma in norway:a scope beyond the"classical"patient[J].Sarcoma,2015(3):1-14.
[4]Matsubara E,Mori T,Koga T,et al.Metastasectomy of Pulmonary Metastases from Osteosarcoma:Prognostic Factors and Indication for Repeat Metastasectomy[J].Journal of Respiratory Medicine,2015:1-5.
[5]Khan MH,Hazarika SB,Perumal Pl.Kiss 1 and GPR54 mRNA expression,endocrine profile,follicular development and onset of estrus following kisspeptin administration in prepubertal mithun heifers[J].Indian Journal of Animal Sciences,2017,87(4):427-431.
[6]Song WW,Gui A Pl.Expressions of HIF and KISS-1 in patients with liver cancer and correlation analysis[J].European Review for Medical&Pharmacological Sciences,2017,21(18):4058.
[7]Kaverina N,Borovjagin AV,Kadagidze Z.Astrocytes promote progression of breast cancer metastases to the brain via a KISS1-mediated autophagy[J].Autophagy,2017:1.
[8]Mousavi AR,Hashemzadeh S,Behrouz SS.Aberrant methylated EDNRB can act as a potential diagnostic biomarker in sporadic colorectal cancer while KISS1 is controversial[J].Bioengineered,2017:1-10.
[9]Yin Y,Tang L,Shi L.The metastasis suppressor gene KISS-1 regulates osteosarcoma apoptosis and autophagy processes[J].Molecular Medicine Reports,2017,15(3):1286.
[10]Shahi N,Singh AK,Sahoo M,et al.Molecular cloning,characterization and expression profile of kisspeptin1 and kisspeptin1 receptor at brain-pituitary-gonad(BPG)axis of golden mahseer,Tor putitora (Hamilton,1822)during gonadal development[J].Comparative Biochemistry&Physiology Part B Biochemistry&Molecular Biology,2017,205:13-29.
[11]Kaverina N,Borovjagin AV,Kadagidze Zl.Astrocytes promote progression of breast cancer metastases to the brain via a KISS1-mediated autophagy[J].Autophagy,2017:1.
[12]Peng J,Tang M,Zhang BP.Kisspeptin stimulates progesterone secretion via the Erk1/2 mitogen-activated protein kinase signaling pathway in rat luteal cells[J].Fertility&Sterility,2013,99(5):1436.
[13] Quevedo EG,Aguilar GM,Aguilar LA.Polymorphisms rs12998 and rs5780218 in KiSS1 suppressor metastasis gene in Mexican patients with breast cancer[J].Disease Markers,2015,2015(12):365845.
[14]Qi JJ,Han XF,Cai XL,et al.[Expression and clinical significance of autophagy-related gene Beclin1 and P62 in nasal polyps][J].Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2016,51(6):428-432.
[15]Wang S,Jie L,Du Y,et al.The Class I PI3K Inhibitor S14161 induces autophagy in malignant blood cells by modulating the Beclin 1/Vps34 complex[J].Journal of Pharmacological Sciences,2017,134(4).
[16]陳飛,余婷婷,李俊.宮頸癌中自噬標記蛋白Beclin1、p62的表達及其臨床意義[J].實用癌癥雜志,2017,32(2):218-220.

