綿羊弓形蟲TgSheepHn1對小鼠的病理損傷及其抗原分布特點
,,, ,,
剛地弓形蟲(Toxoplasmagondii)是一種細胞內寄生原蟲,廣泛分布于全球陸地、水域范圍內,能夠侵染所有恒溫動物的有核細胞,從而誘發弓形蟲病[1]。貓科動物是弓形蟲的終末宿主,綿羊可經過食入含卵囊的飼草或飲水、孕期垂直傳播胎兒而感染弓形蟲[2],弓形蟲病是誘發綿羊流產的病原之一(www.gov.uk/government/statistics)。研究發現,人類和綿羊妊娠期首次感染弓形蟲,易引發胎兒發育異常或流產[3],因此弓形蟲病對綿羊產業以及人類健康造成危害。分離弓形蟲蟲株并研究其致病特征是防控弓形蟲病的基礎工作,目前我國從綿羊體內共分離到3株弓形蟲蟲株[4-5],本文研究了綿羊分離株TgSheepHn1(ToxoDB#9)[5]對Swiss小鼠的病理損傷及抗原分布特點,補充了我國綿羊分離株的致病特點,為進一步了解弓形蟲病的基本特征提供相關依據。
1 材料與方法
1.1弓形蟲蟲株速殖子與抗體 TgSheepHn1(ToxoDB#9)弓形蟲蟲株分離于河南省焦作市綿羊心肌[5],蟲株經Vero細胞培養獲得大量速殖子,保存于本研究室。兔抗弓形蟲多克隆抗體、弓形蟲抗原均由美國農業部Dubey實驗室饋贈,小鼠Specific HRP/DAB(ABC)Detection IHC kit 購自abcam公司(貨號:ab64264)。
1.2實驗動物及處理 Swiss小鼠15只,≥45 d齡,體重≥25 g,弓形蟲檢測陰性,購于河南省實驗動物中心。小鼠分為3組,2個感染組,1個對照組,每組5只小鼠,雌雄分開,自由采食清潔級全營養顆粒飼料,飲用高壓滅菌水。感染組小鼠分別腹腔注射104濃度的弓形蟲速殖子,對照組小鼠注射無菌生理鹽水,接種量均為1 mL/只。每日觀察小鼠臨床表現并記錄死亡情況。對感染后死亡小鼠的肺臟及腸系膜淋巴結涂片鏡檢弓形蟲速殖子,并用10%的中性福爾馬林溶液固定小鼠大腦、舌頭、眼球、心臟、肝臟、脾臟、肺臟、腎臟、腎上腺、小腸、腸系膜淋巴結、生殖器官、膀胱和骨骼肌。
1.3實驗方法 肺臟及腸系膜淋巴結中弓形蟲速殖子檢測采用組織涂片方法,光學顯微鏡鏡檢觀察;運用常規病理學技術制作石蠟切片,采用蘇木素與伊紅對比染色法(Hematoxylin-Eosin staining,H&E)鑒定病理損傷,免疫組織化學(Immunohistochemistry,IHC)染色,定位弓形蟲抗原分布。
2 結 果
2.1Swiss小鼠接種TgSheepHn1弓形蟲速殖子后的發病情況 腹腔接種104濃度的TgSheepHn1弓形蟲速殖子后,感染小鼠在72 h開始出現被毛逆立、弓背蜷縮、呼吸窘迫和食欲降低等臨床表現,感染組小鼠在接種后10 d(10 days post inoculation,10 DPI)內100%死亡,最早急性死亡時間為8 DPI,對照組小鼠未見異常(表1)。對急性期死亡小鼠肺臟和腸系膜淋巴結涂片鏡檢,可見大量弓形蟲速殖子,見圖1(A、B),確定小鼠因弓形蟲感染而死亡。
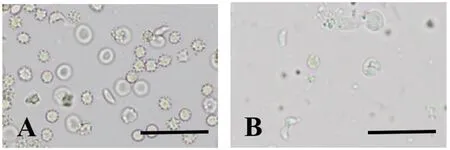
A: Tachyzoites of T. gondii, lung smear, unstained, 8 DPI; B: Tachyzoites of T. gondii, mesenteric lymph nodes smear, unstained, 8 DPI. Bar = 50 μm圖1 小鼠組織涂片的弓形蟲速殖子Fig.1 Tachyzoites of T. gondii in tissue smear of mice
表1 Swiss小鼠腹腔注射104濃度的TgSheepHn1弓形蟲速殖子的發病情況
Tab.1 Pathogenicity of the Swiss mice post inoculation with 104of TgSheepHn1 T. gondii tachyzoites by intraperitoneal injection
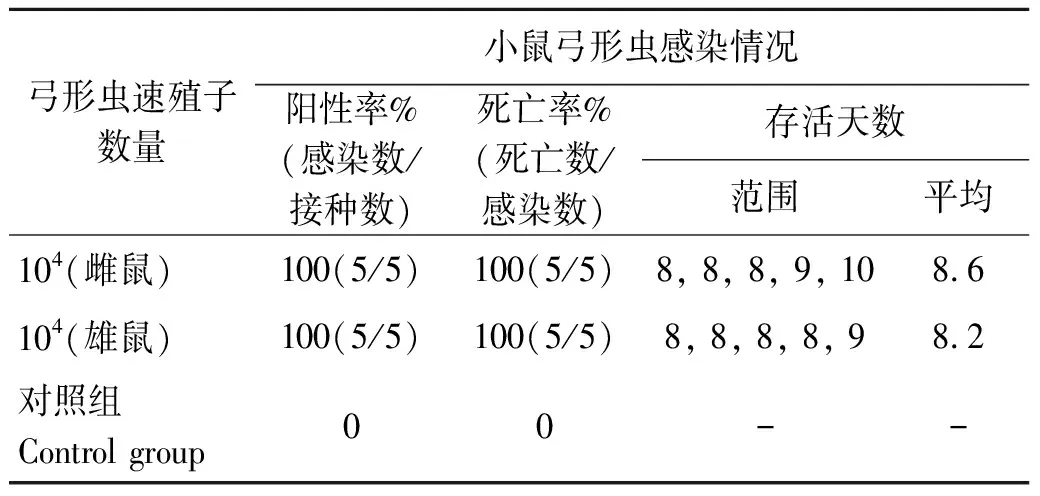
弓形蟲速殖子數量小鼠弓形蟲感染情況陽性率%(感染數/接種數)死亡率%(死亡數/感染數)存活天數范圍平均104 (雌鼠)100(5/5)100(5/5)8, 8, 8, 9, 108.6104 (雄鼠)100(5/5)100(5/5)8, 8, 8, 8, 98.2對照組Control group00--
注:“-”表示小鼠未感染
2.2感染TgSheepHn1弓形蟲小鼠的病理組織損傷及弓形蟲抗原分布 死亡小鼠剖檢主要眼觀病變為:肺臟暗紅色,淤血,脾臟和腸系膜淋巴結腫大,肝臟腫大淤血,腎上腺腫大,小腸腸壁菲薄充血。對各組織器官做常規石蠟切片,H&E染色鏡檢發現,多器官表現為壞死、水腫,血管周圍炎,但未見出血。急性死亡小鼠組織器官內弓形蟲及其分泌蛋白等抗原分布于多處組織,其中肝臟膽囊管肌層、脾臟、腸系膜淋巴結、腎上腺、生殖系統有大量分布。肝臟肝細胞呈局灶性壞死,血管周圍炎性細胞浸潤,肝臟膽囊管肌層大量單核細胞浸潤,可見大量弓形蟲蟲體的斷面分布(圖2A,圖3A);腸系膜淋巴結大量淋巴細胞壞死、水腫,分布大量弓形蟲蟲體(圖2B,圖3B);脾臟白髓壞死(圖2C,圖3C);回腸腸黏膜上皮細胞壞死脫落崩解,腸腺萎縮(圖2D);肺臟肺泡間隔增寬,單核細胞浸潤(圖2E);腎小管上皮脫落壞死,單核細胞浸潤(圖2F);腎上腺固有結構不清晰,可見局灶性細胞壞死(圖2G)及大量弓形蟲蟲體(圖3D);大腦和心肌未見明顯病理損傷,但可見弓形蟲抗原分布(圖3 E、F);睪丸、附睪和前列腺可見局灶性壞死,分布大量弓形蟲蟲體(圖2H,圖3G、H);子宮固有結構破壞,弓形蟲分布于黏膜層、黏膜下層、肌層及漿膜層(圖2I,圖3I)。此外,肺臟、腎臟、小腸、膀胱及尿液中均可見弓形蟲抗原分布,有的可以看到假包囊。從弓形蟲抗原分布規律,表現為各臟器均是由外膜到中心逐漸減少。
3 討 論
弓形蟲蟲株毒力分析研究表明:Ⅰ型為強毒株,感染性強,急性死亡率高;Ⅱ、Ⅲ型和非典型蟲株均屬于弱毒株,致死率低,多為高成囊率,常常誘發慢性弓形蟲病,但在試驗條件下,高濃度的弱毒株對小鼠也具有較高的致死率,如對遠交小鼠、近交小鼠和免疫缺陷小鼠[6-7]。對比原型克隆譜系典型參考蟲株和我國已分離的其他動物源的ToxoDB#9型蟲株,本試驗所研究的綿羊分離株TgSheepHn1(ToxoDB#9)弓形蟲對Swiss小鼠的感染性和致死性均較強,與已報道的我國優勢基因型蟲株ToxoDB#9型(TgCtgy1、TgCtwh3和TgCtwh6等蟲株)蟲株的侵染毒性特征相似[5,8]。
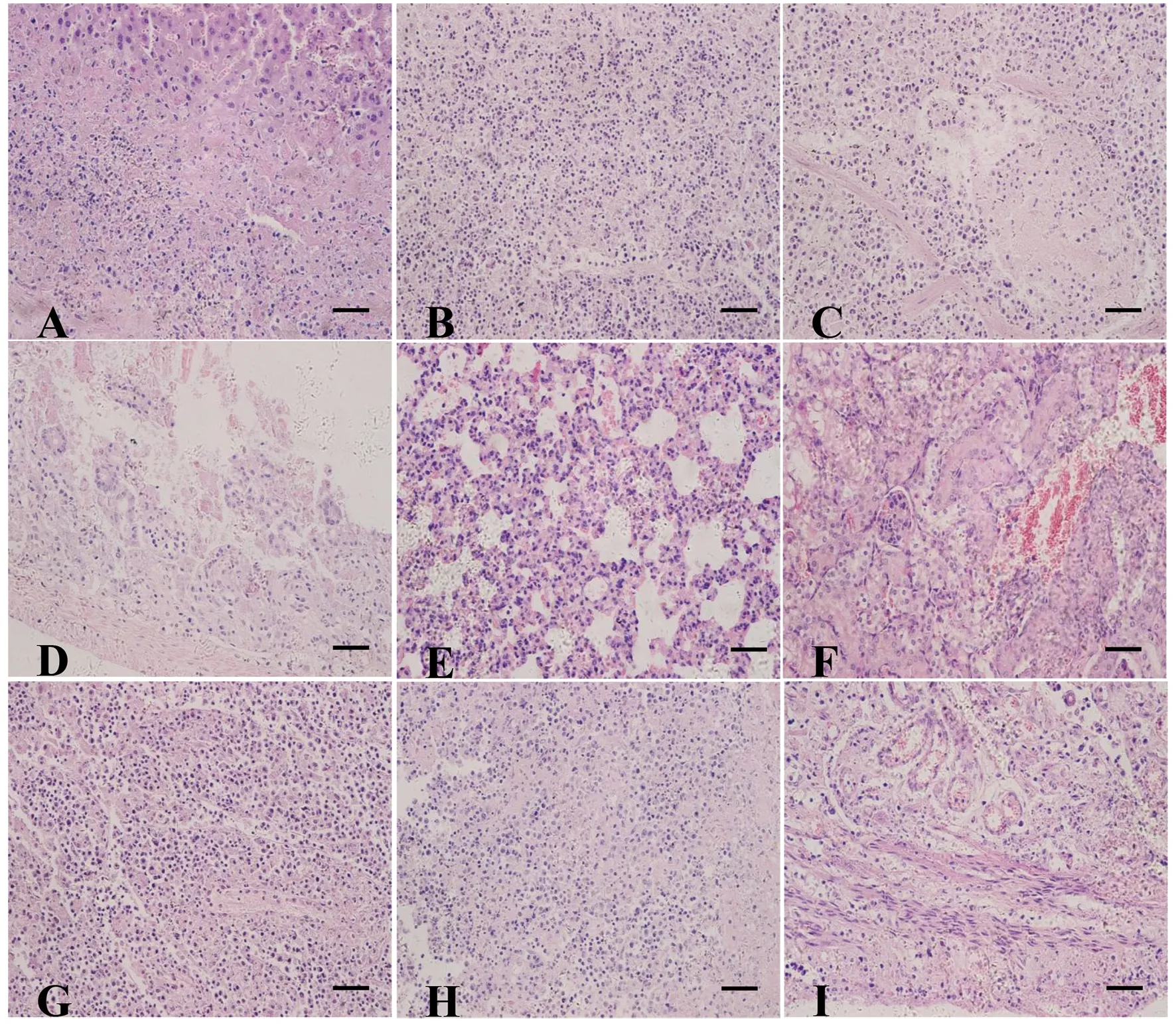
A-I are liver, mesenteric lymph nodes, spleen, ileum, lung, kidney, adrenal, epididymis, uterus, respectively. HE staining, bar=50 μm.圖2 Swiss小鼠感染TgSheepHn1弓形蟲后,各器官的病理組織損傷, 8 DPI.Fig.2 Pathology histological lesions of Swiss mice after infection with TgSheepHn1 tachyzoites, 8 DPI
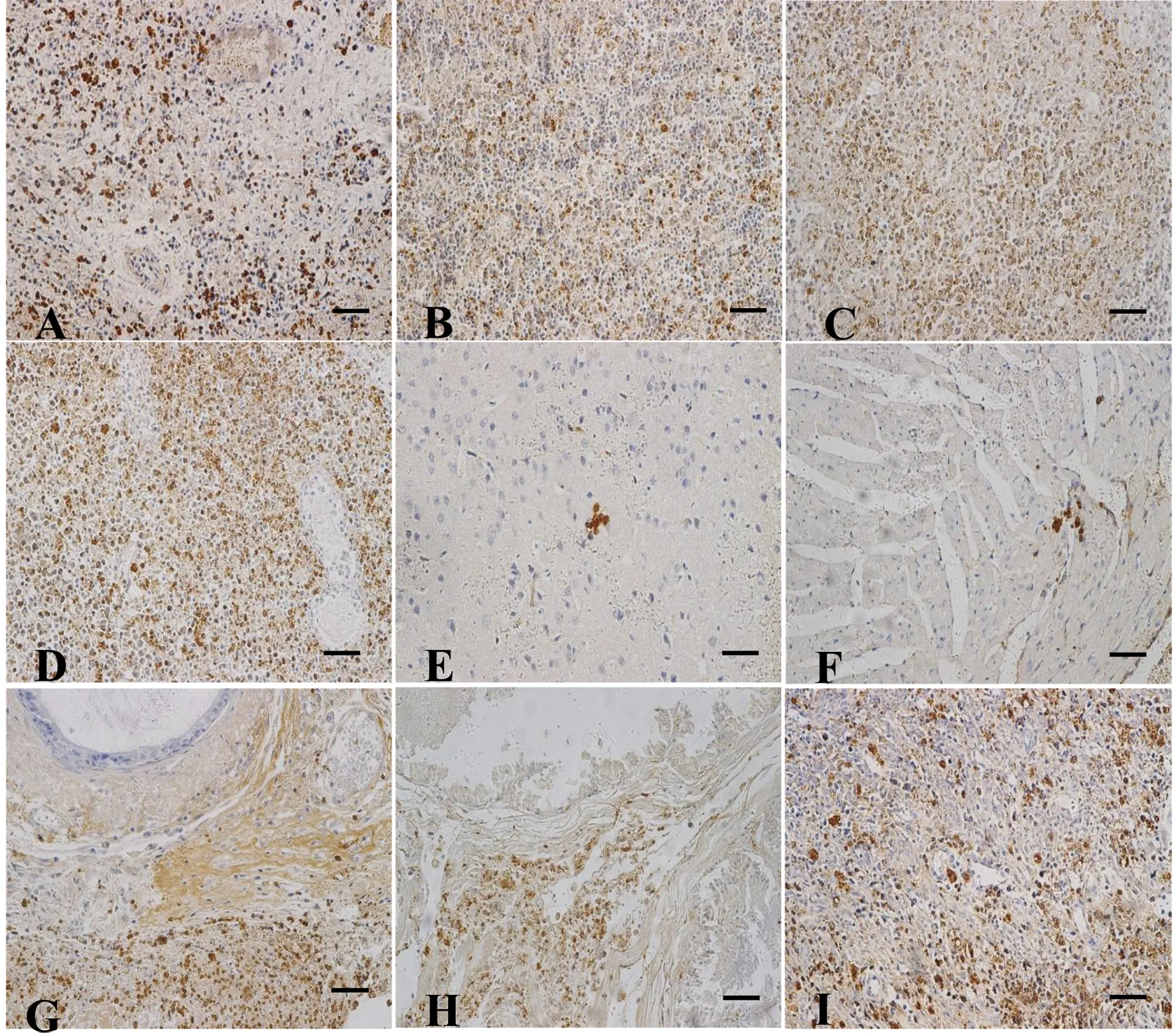
A-I are liver, mesenteric lymph nodes, spleen, adrenal, brain, heart, testis, prostate, uterus, respectively. IHC staining, bar=50 μm.圖3 Swiss小鼠感染TgSheepHn1弓形蟲后,各器官弓形蟲抗原的分布, 8 DPI.Fig.3 Antigens distribution of T. gondii in tissue of Swiss mice after infection TgSheepHn1 tachyzoites, 8 DPI
腹腔接種104濃度的TgSheepHn1弓形蟲速殖子后,小鼠在感染后約8 d死亡,對其病理損傷及蟲體抗原分布分析發現,大部分組織器官均表現不同程度的損傷,其中肺臟、脾臟、腸系膜淋巴結、回腸、生殖器官,腎上腺損傷較重,以組織細胞壞死,水腫為特征,且這些臟器弓形蟲抗原分布量較多。這與已報道的Ⅰ型強毒株CT1型弓形蟲不同濃度卵囊灌胃遠交系昆明小鼠后,104個卵囊即可導致小鼠在7 DPI時全部死亡,且急性死亡小鼠的各組織臟器損傷程度及抗原分布趨勢基本相同[9]。研究發現,108個VEG株弓形蟲的卵囊可導致昆明小鼠100%死亡,而從貓組織分離到的ToxoDB#17(TgCatCHn2)型和ToxoDB#9(TgCatCHn4)型弓形蟲,1個卵囊可引起小鼠感染,但隨著卵囊濃度的增加并不會引起小鼠死亡[10-13]。對比已研究的報道可推斷,TgSheepHn1弓形蟲對Swiss小鼠的毒力表現較強,介于強毒和弱毒之間。
對BALB/c小鼠的急性弓形蟲病理組織損傷研究發現,≥105濃度的VEG、ME49和GT1株弓形蟲卵囊對小鼠在4~10 d內急性感染期的組織損傷程度依次為腸系膜淋巴結、小腸、脾臟、肺臟和肝臟,大部分組織均出現損傷,其中回腸段損傷最重,回腸為卵囊灌胃弓形蟲的主要入侵門戶[7]。此綿羊分離株TgSheepHn1弓形蟲速殖子在急性感染期對昆明小鼠的各臟器侵染性較強,損傷與研究報道的也基本一致,但十二指腸、空腸和回腸的病理損傷程度無差異,推測腹腔注射弓形蟲速殖子對整個小腸腸道幾乎同時入侵,這種差異可能與接種方式和接種蟲體的狀態有關,也可能是蟲體固有毒力差異性的表現,具體原因還需驗證。另外,急性期感染弓形蟲對小鼠小腸潘氏細胞的破壞會引起溶菌酶表達缺失,強毒株ToxoDB#216型表現為腸隱窩損傷嚴重,弱毒株ToxoDB#17型、ME49株弓形蟲表現為腸隱窩輕度損傷,溶菌酶表達缺失[14-16]。TgSheepHn1弓形蟲可引起回腸腸腺萎縮,是否會引起溶菌酶缺失現象尚待進一步的研究。
本研究發現,急性期死亡小鼠多器官分布弓形蟲速殖子及其分泌蛋白抗原,其中脾臟、腎上腺、腸系膜淋巴結、整個小腸和生殖系統分布密度最高,其余組織如肺臟、肝臟、腎臟、心肌和大腦也可觀察到弓形蟲抗原分布,各臟器外膜抗原分布量高推測與腹腔接種弓形蟲速殖子有關,通過各臟器外膜的疏松結締組織侵入各器官。急性死亡期小鼠生殖系統和腎上腺的弓形蟲抗原分布較多,提示該蟲株具有潛在的嗜生殖系統能力(包括雌性和雄性),且已有報道綿羊弓形蟲可以通過精液傳播[17-18],但關于弓形蟲嗜腎上腺組織細胞和生殖系統間質細胞的能力未見相關研究報道。在研究綿羊分離株TgSheepHn1(ToxoDB#9)型弓形蟲對昆明小鼠的病理損傷以及抗原分布過程中,發現的這些現象還需要我們進一步深入探討,本報道為中國蟲株對動物機體的病理損傷及抗原分布特點做出補充。
[1] Dubey JP. Toxoplasmosis of animals and humans[M]. Boca Raton: CRC Press, Taylor & Francis Group, 2010: 1-313.
[2] Innes EA. A brief history and overview ofToxoplasmagondii[J]. Zoonoses Public Health, 2010, 57 (1): 1-7. DOI: 10.1111/j.1863-2378.2009.01276.x
[3] Innes EA, Bartley PM, Buxton D, et al. Ovine toxoplasmosis[J]. Parasitology, 2009, 136 (14): 1887-1894. DOI: 10.1017/S0031182009991636
[4] Zhou P, Zhang H, Lin RQ, et al. Genetic characterization ofToxoplasmagondiiisolates from China[J]. Parasitol Int, 2009, 58 (2): 193-195. DOI: 10.1016/j.parint.2009.01.006
[5] Yang YR, Feng YJ, Yao QX, et al. Seroprevalence, isolation, genotyping, and pathogenicity ofToxoplasmagondiistrains from sheep in China[J]. Front Microbiol, 2017, 8: 136. DOI: 10.3389/fmicb.2017.00136
[6] Wang L, Chen H, Liu D, et al. Genotypes and mouse virulence ofToxoplasmagondiiisolates from animals and humans in China[J]. PLoS One, 2013, 8 (1): e53483. DOI: 10.1371/journal.pone.0053483
[7] Dubey JP, Ferreira LR, Martins J, et al. Oral oocyst-induced mouse model of toxoplasmosis: effect of infection withToxoplasmagondiistrains of different genotypes, dose, and mouse strains (transgenic, out-bred, in-bred) on pathogenesis and mortality[J]. Parasitology, 2012, 139 (1): 1-13. DOI: 10.1017/S0031182011001673
[8] Li M, Mo XW, Wang L, et al. Phylogeny and virulence divergency analyses ofToxoplasmagondiiisolates from China[J]. Parasit Vectors, 2014, 7 (1): 133-144. DOI: 10.1186/1756-3305-7-133
[9] 付曉瑩, 孔陽光, 梁宏德, 等. 昆明小鼠感染CT1型弓形蟲卵囊的蟲體分布及病理組織學研究 [J]. 中國細胞生物學學報,2015, 37(10): 1377-1380.
[10] 陸瑤瑤, 馮永杰, 董輝, 等. VEG株弓形蟲卵囊對昆明小鼠的毒力研究 [J]. 中國人獸共患病學報,2017, 33(7): 624-627. DOI:10.3969/j.issn.1002-2694.2017.07.010
[11] Yang YR, Ying YQ, Verma SK, et al. Isolation and genetic characterization of viableToxoplasmagondiifrom tissues and feces of cats from the central region of China[J]. Vet Parasitol, 2015, 211 (3-4): 283-288. DOI: 10.1016/j.vetpar.2015.05.006
[12] 王凱, 馮永杰, 付曉瑩, 等. ToxoDB#17型弓形蟲卵囊對昆明小鼠致病性的研究 [J]. 中國人獸共患病學報,2017, 33(1): 49-52. DOI:10.3969/j.issn.1002-2694.2017.01.009
[13] Yang YR, Feng YJ, Lu YY, et al. Antibody detection, isolation, genotyping, and virulence ofToxoplasmagondiiin captive felids from China[J]. Front Microbiol, 2017, 8: 1414. DOI: 10.3389/fmicb.2017.01414
[14] 王凱, 陸瑤瑤, 劉振陽, 等. ToxoDB#17型弓形蟲感染小鼠引起小腸潘氏細胞溶菌酶缺失[J]. 中國細胞生物學學報,2017, 39 (2): 1-6.
[15] 張瓊方, 付曉瑩, 王凱, 等. 潘氏細胞在昆明小鼠弓形蟲病發病過程中的變化[J]. 中國細胞生物學學報,2015, 37 (10): 1381-1385.
[16] Raetz M, Hwang SH, Wilhelm CL, et al. Parasite-induced TH1 cells and intestinal dysbiosis cooperate in IFN-gamma-dependent elimination of Paneth cells[J]. Nat Immunol, 2013, 14 (2):136-142. DOI: 10.1038/ni.2508
[17] Consalter A, Silva AF, Frazao-Teixeira E, et al.Toxoplasmagondiitransmission by artificial insemination in sheep with experimentally contaminated frozen semen[J]. Theriogenology, 2017, 90: 169-174. DOI: 10.1016/j.theriogenology.2016.12.004
[18] Bezerra MJ, Cruz JA, Kung ES, et al. Detection ofToxoplasmagondiiDNA in fresh and frozen semen from rams in Brazil[J]. Reprod Dom Anim, 2014, 49 (5): 753-755. DOI: 10.1111/rda.12361

