ASAP1基因影響結核易感性的研究進展
, ,,
結核病(Tuberculosis,TB)是目前嚴重威脅人類健康的慢性傳染性疾病之一,主要由結核分枝桿菌(Mycobacteriumtuberculosis,Mtb)致病。大量研究表明, 人群暴露于結核分枝桿菌通常只有 1/3 會受到感染,其中約10% 感染者發展為不同程度的臨床結核病[1]。這間接說明,結核分枝桿菌僅僅是致病因素的一方面,由于其與宿主之間復雜的免疫學相互作用,結核病的易感程度還與個體的遺傳背景有關系,因此,摒棄宿主的易感決定基因而單純地研究結核分枝桿菌的致病性是片面的,菌體與宿主之間的免疫互作將得不到系統的闡述[2]。近年來,隨著全基因組測序和關聯性分析的飛速發展,人類多個結核病易感基因相繼被發現,主要有人類白細胞抗原(HLA)基因、自然抗性相關巨噬細胞蛋白 1(NRAMP 1)基因、維生素D受體 (VDR) 基因等[3]。本文綜述的ASAP1作為新發現的結核易感基因,首先由劍橋大學研究者通過GWAS(Genome-Wide Association Study)發現[4],之后國內外研究者在不同地區、種族人群中進行了ASAP1關聯性研究及連鎖分析,對ASAP1的功能和影響結核易感的機制作出了初步探究,為全面揭示結核易感性的遺傳差異機制奠定了方法學基礎且提供了理論指導。
1 ASAP1基因
ASAP1(ADP ribosylation factor-GTPase activating protein)基因位于人類第8號染色體(8q24),編碼蛋白約130 kD[5],蛋白一級結構如圖1所示。ASAP1是ADP-核糖基化因子(ADP-ribosylation factors,Arf)的GTP酶激活蛋白。Arf家族蛋白分子量約20 kDa,屬于小G蛋白,在真核生物中廣泛存在且進化上高度保守,主要參與膜泡轉運和細胞骨架的調節[6-7]。Arf在細胞中有兩種結合狀態,與 GTP結合為活性狀態,與GDP結合為非活性狀態,鳥苷交換因子 (Guanine nucleotide-exchange factor,GEF)和GTP酶激活蛋白(GTPase-activating protein,GAP)調控其在兩種結合狀態之間轉換。ASAP1屬于調控Arf的 GAP 蛋白,也稱為AMAP1或centaurinβ,是Arf的負調因子,識別Arf·GTP后誘導GTP水解形成Arf·GDP,使Arf功能失活。報道顯示[8]:當細胞發生內吞過程時,Arf應處于活性狀態,即Arf·GTP。首先將包被蛋白募集在膜上,內吞囊泡形成后向相應的亞細胞器轉運,當到達亞細胞器膜之前,Arf失活即Arf·GDP促進囊泡膜上的包被蛋白解離,進而成功與亞細胞器膜融合。也就是說,Arf的失活也即ASAP1等GAP 蛋白作用的Arf是囊泡與目的亞細胞器融合的必要條件。
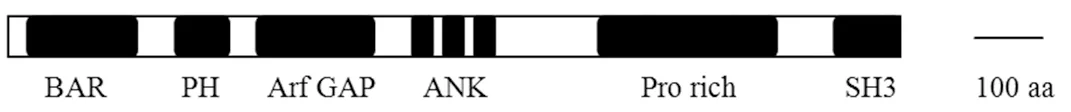
圖1 ASAP1蛋白示意圖[6,9]Fig.1 Schematic diagram of ASAP1 protein[6,9]
2 ASAP1 功能及其影響人類結核易感性的機制
關于ASAP1功能主要集中在與細胞內吞、細胞內膜泡轉運與細胞骨架的運動調控方面,還與腫瘤的轉移和擴散有關[10]。Haque[11]利用iRNA使ASAP1基因沉默來探究LPS誘導的RAW 264.7類巨噬細胞炎癥反應中ASAP1的作用,最終發現,ASAP1的沉默增強了細胞因子TNF-α、IL-6、IFN-β與NO的表達,且對NF-κB的下游信號通路起負調控作用。Tien[12]等也相應發現ASAP1對細胞內調節炎癥反應的轉錄因子NF-kB的信號通路起負向反饋調控作用,揭示ASAP1可能成為治療炎癥反應的新靶點。Ruggiero[13]發現一個定位于高爾基體的復合物KDELR 通過增加足突這種細胞結構發揮降解胞外基質的功能,而足突功能的發揮是依賴與KDELR對ASAP1的磷酸化實現的,間接反應出ASAP1對于胞外基質的降解是必須的。Davidso[14-15]等發現一種依賴于Arf 6 的細胞肌動蛋白重組機制能增強沙門菌的侵染,并且指出Arf GEFs 與Arf GAPs 的平衡關系也即Arf·GTP和Arf·GDP的循環有利于宿主細胞對沙門菌的吞噬。在NIH3T3小鼠成纖維細胞中,ASAP1蛋白的定位與黏著斑、環形背褶和足突相一致,與胞外基質的降解有一定聯系[16]。
目前針對ASAP1蛋白影響人類結核易感性的機制問題的研究尚處于探索階段,現主要集中在ASAP1蛋白表達對于免疫細胞遷徙能力的調控,進而影響人類對于TB的易感性。機體感染Mtb后,固有免疫細胞和適應性免疫細胞與Mtb的相互作用是一個動態發展的過程[17],其中巨噬細胞和樹突狀細胞發揮了舉足輕重的作用[18]。Mtb主要通過呼吸系統侵入機體,激活單核-巨噬細胞系統,一部分Mtb被巨噬細胞吞噬殺滅,抗原提呈在細胞表面,進而激活T淋巴細胞引發細胞免疫反應,另一部分Mtb在細胞的吞噬小體中潛伏下來,與宿主免疫細胞形成一種特征性的組織病理結構,即結核性肉芽腫。2016年Berg[19]分析了溶酶體貯積癥患者對Mtb的易感性問題,發現導致易感的根本原因為溶酶體貯積的巨噬細胞遷徙能力受到了抑制,不能及時對Mtb的感染作出清除吞噬反應,進而Mtb在溶酶體貯積癥患者體內較之于健康的免疫系統人群更容易擴散。Curtis[4]通過qRT-PCR 檢測感染Mtb的樹突狀細胞(dendritic cell, DC)中 ASAP1的mRNA表達量明顯降低,且受感染的DC游走能力與吞噬溶酶體形成能力都有所降低。Roberts[20]結合流式細胞術與共聚焦顯微技術發現了Mtb感染的樹突狀細胞表面表達的β2(CD18)整合素有明顯的減少,αL(CD11a)和αM(CD11b)整合素亞基也相應的減少,并且展示感染后DC對肺內皮細胞層黏附能力下降以及對淋巴趨化因子的遷徙能力減弱,最終削弱了固有免疫細胞對抗原的提呈延遲適應性免疫的發生,使得Mtb在體內得到更廣的擴散與分布。綜合以上現階段對于TB的易感機制探究和ASAP1蛋白的功能,推測ASAP1蛋白主要影響免疫細胞的遷徙能力,進而影響機體對于病原菌侵噬的免疫過程。
3 ASAP1基因與結核病易感性的相關研究報道
2015年Curtis[4]對來自世界TB高發區俄羅斯圣彼得堡的5 914份活動性TB患者和6 022份健康志愿者的全基因組關聯分析(GWAS)發現ASAP1的11個SNP(Single Nucleotide Polymorphisms)與TB易感性顯著相關,且全部分布于內含子中,并且對其中7個顯著相關的SNP做了進一步統計學分析,得出了4個關聯性最強的SNP位點(rs10956514,rs1469288, rs2033059,rs4733781)。文章初步得出ASAP1影響宿主易感性的機制為其削弱了DC的游走和對胞外基質的降解,使固有免疫過程減緩,增強了胞內寄生菌的生存力與侵染性。
2016年國內研究者Hu[21]對1 115例西部漢族人群和914例西藏人群應用iMLDR方法對ASAP1的7個SNP位點分型,再結合Meta 分析進一步探究ASAP1與TB的相關性,數據比較得出ASAP1與TB易感性在中國人群中無明顯相關性。Hu[21]的發現說明了人群異質性與種族遺傳背景差異影響TB的易感性。同年國內研究者Miao[22]在355例新近肺結核感染的中國人群中和395例健康人群中使用TaqMan等位基因鑒別法對ASAP1的2個SNP位點(rs10956514 和rs11774633)進行分析,發現ASAP1與TB易感性在中國人群中無明顯關聯。這也再次說明了基因多態性與疾病的關系強調種族的差異。
綜上所述,關于ASAP1基因與結核病易感性關聯的研究報道尚處于初級階段,根據現有的結論發現不同人群對結核病的易感程度是不相同的,這緣于①個體遺傳背景的復雜性:人體本身是一個復雜的微生態系統,人群對結核的易感性并非只受單個基因的影響,且基因間還存在連鎖不平衡現象,這些因素最終導致了個體遺傳背景的復雜性,進而使得單純研究某一基因對疾病的影響存在極大困難;②環境因素的影響:外界環境條件不僅影響了Mtb對人群的接觸程度,如干燥的環境更利于Mtb的播散,更主要的是使得個體在長期適應不同的氣候與地理環境的進化過程中造成了機體的異質性,致使不同人群抵抗病原菌的反應程度不同;③選取的樣本差異:研究條件和研究方法的限制造成一定程度的結果差異[3]。總之,結核病的發生是遺傳和環境多因素作用的結果。因此,研究基因對于結核病的易感性要充分考慮上述因素,保證實驗結果的可靠性與科學性,相信隨著生物信息學與細胞免疫生物學的深入發展,ASAP1基因影響結核病的易感程度與作用機理都將得到很好的闡釋。
[1] Qu HQ, Fisher-Hoch SP, Mccormick JB, et al.Knowledge gaining by human genetic studies on tuberculosis susceptibility[J]. J Hum Genet,2011, 56(3): 177-182. DOI: 10.1038/jhg.2010.164
[2] Pai M, Behr MA, Dowdy D, et al. Tuberculosis[J]. Nat Rev Dis Primers, 2016, 2: 16076. DOI: 10.1038/nrdp.2016.76
[3] M?ller M, Hoal EG. Currentfindings, challenges and novelapproaches in human genetic susceptibility to tuberculosis [J]. Tuberculosis (Edinb), 2010, 90(2):71-83. DOI: 10.1016/j.tube.2010.02.002
[4] Curtis J, Luo Y, Zenner HL, et al. Susceptibility to tuberculosis is associated with variants in the ASAP1 gene encoding a regulator of dendritic cell migration[J]. Nat Genet, 2015, 47(5): 523-527. DOI: 10.1038/ng.3248
[5] Waltl S. Regulator of dendritic cell migration, ASAP1 is associated with increased susceptibility to tuberculosis[J]. Clin Genet,2015, 88(6): 530-531. DOI: 10.1111/cge.12611
[6] Inoue H, Randazzo PA. Arf GAPs and their interacting proteins[J].Traffic,2007, 8(11): 1465-1475. DOI: 10.1111/j.1600-0854.2007.00624.x
[7] Furman C, Short SM, Subramanian RR, et al. DEF-1/ASAP1 is a GTPase-activating protein (GAP) for ARF1 that enhances cell motility through a GAP-dependent mechanism[J]. J Biol Chem, 2002, 277(10):7962-7969. DOI: 10.1074/jbc.M109149200.
[8] Anders N, Jurgens G. Large ARF guanine nucleotide exchange factors in membrane trafficking[J]. Cell Mol Life Sci, 2008, 65(21): 3433-3445. DOI: 10.1007/s00018-008-8227-7
[9] Kahn RA, Lambright DG. A PH Domain with dual phospholipid binding sites regulates the ARFGAP, ASAP1[J]. Structure, 2015, 23(11):1971-1973. DOI: 10.1016/j.str.2015.10.002
[10] Randazzo PA, Andrade J, Miura K, et al. The Arf GTPase-activating protein ASAP1 regulates the actin cytoskeleton[J]. Proc Natl Acad Sci U S A, 2000, 97(8): 4011-4016. DOI: 10.1073/pnas.070552297
[11] Haque A, Noman AS, Koide N, et al. An ADP ribosylation factor-GTPase activating protein negatively regulates the production of proinflammatory mediators in response to lipopolysaccharide[J]. Cancer Immunol Immunother, 2011, 60(10): 1439-1446. DOI: 10.1007/s00262-011-1048-9
[12] Tien DN, Kishihata M, Yoshikawa A, et al. AMAP1 as a negative-feedback regulator of nuclear factor-κB under inflammatory conditions[J]. Sci Rep, 2014, 28(4):5094. DOI: 10.1038/srep05094
[13] Ruggiero C, Fragassi G, Grossi M. et al. Golgi-based KDELR-dependent signaling pathway controls extracellular matrix degradation[J]. Oncotarget,2015, 6(5): 3375-3393. DOI: 10.18632/oncotarget.3270
[14] Davidson AC, Humphreys D, Brooks AB, et al. The Arf GTPase-activating protein family is exploited bySalmonellaenterica serovar Typhimurium to invade nonphagocytic host cells[J]. MBio,2015, 6(1). pii: e02253-e02214. DOI: 10.1128/mBio.02253-14
[15] Humphreys D, Davidson AC, Hume PJ, et al. Arf6 coordinates actin assembly through the WAVE complex, a mechanism usurped bySalmonellato invade host cells[J]. Proc Natl Acad Sci U S A, 2013, 110(42):16880-16885. DOI: 10.1073/pnas.1311680110
[16] Randazzo PA, Inoue H, Bharti S, et al. Arf GAPs as regulators of the actin cytoskeleton[J]. Biol Cell, 2007, 99:583-600.
[17] Cooper AM, Torrado E. Protection versus pathology in tuberculosis: recent insights[J]. Curr Opin Immunol, 2012, 24(4): 431-437. DOI: 10.1016/j.coi.2012.04.008
[18] Flynn JL,Chan J,Lin PL, et al. Macrophages and control of granulomatous inflammation in tuberculosis[J]. Mucosal Immunol, 2011, 4(3): 271-278. DOI: 10.1038/mi.2011.14
[19] Berg RD,Levitte S,O’Sullivan MP,et al. Lysosomal disorders drive susceptibility to tuberculosis by compromising macrophage migration[J]. Cell, 2016, 165(1):139-152. DOI: 10.1016/j.cell.2016.02.034
[20] Roberts LL,Robinson CM.Mycobacteriumtuberculosisinfection of human dendritic cells decreases integrin expression, adhesion and migration to chemokines[J]. Immunology, 2014, 141(1):39-51. DOI: 10.1111/imm.12164
[21] Hu X, Peng W, Chen X, et al. No Significant effect of ASAP1 gene variants on the susceptibility to tuberculosis in Chinese population[J]. Medicine (Baltimore),2016, 95(21): e3703. DOI: 10.1097/MD.0000000000003703
[22] Miao R, Ge H, Xu L, et al. Geneticvariants at 18q11.2 and 8q24 identified by genome-wide association studies were not associated with pulmonary tuberculosis risk in Chinese population[J]. Infect Genet Evol, 2016, 40: 214-218. DOI: 10.1016/j.meegid.2016.03.005

