宣痹通瘀方對急性冠脈缺血大鼠血管新生作用的影響
李雙娣 成光宇 劉迎輝 隋永朋 李洪禹 劉愛東
(長春中醫藥大學附屬醫院,吉林 長春 130021)
研究發現〔1~4〕,Notch信號通路在促進心肌再生、改善心肌缺血、誘導血管新生的過程中發揮作用,對損傷心肌發揮一定修復作用。本文主要觀察宣痹通瘀方對心肌缺血大鼠Notch通路的干預作用及血管新生的影響。
1 材料與方法
1.1實驗動物 110只清潔級SD大鼠,雌雄各半,重量220~250 g,由遼寧長生生物技術有限公司提供,動物合格證號:SCXK(遼)2015-0001。室內溫度(23±3)℃、室內相對濕度65%~70%,自然光線照明,普通飼料喂養,自由飲水。
1.2主要藥物和試劑 宣痹通瘀膠囊成分包括延胡索(酒炙)、三七、川芎、郁金、人參、冰片,由長春中醫藥大學附屬醫院新藥研發中心提供;陽性對照藥麝香保心丸,由上海和黃藥業有限公司生產(國藥準字231020068),規格:22.5 mg/每丸;單硝酸異山梨酯片20 mg/片,魯南制藥。跨膜受體蛋白Notch抗體:規格:1 ml/瓶,產品批號:JL0972R,美國Sigma公司產品;兔免疫球蛋白(Ig)G-免疫組化試劑盒(SABC即用型):產品批號:11H24J20,武漢博士徳生物工程有限公司產品。
1.3儀器設備 醫學圖像分析系統,型號:JEDR 801D,江蘇省捷達科技發展有限公司產品;倒置顯微鏡,型號:Nikon1671-HA,日本Nikon公司。生理信號采集系統,型號:Powerlab/8sp,澳大利亞埃德公司產品。醫學圖像分析儀,型號:BI-2000型,成都泰盟股份有限公司產品。全自動生化分析儀,型號:Selectra Junior,荷蘭威圖科學儀器公司產品。酶標儀,型號:BIOO680,美國伯樂公司產品。臺式高速低溫離心機,德國賀利氏公司產品。電子天平,型號:SQP,規格:PRACTUM313-1CN,序列號:0028892121。賽多利斯科學儀器(北京)有限公司產品。
1.4方法
1.4.1模型制備、分組、給藥 大鼠分籠飼養、穩定、適應環境1 w。實驗前,應用心電圖機對受試動物進行單導聯(Ⅱ導聯)檢測,篩選出心電圖正常的大鼠用于實驗(共108只)。采用快速開胸結扎冠狀動脈前降支方法制備急性心肌缺血動物模型〔5〕。具體方法如下:將大鼠置于密閉容器中,使其被迫吸入乙醚,進入淺麻醉狀態。將大鼠仰位固定于鼠板上,去除胸部的毛,碘伏局部消毒,在第4~5肋間開胸,鈍性分離肌層,打開胸腔,拉鉤擴胸,暴露心臟,在左心耳根部與肺動脈圓錐交界處,相當于左冠狀動脈起始處下2 mm穿一手術線結扎,迅速將心臟送回胸腔,排出進入胸腔的氣體及血液,縫合胸壁。再次用碘伏絡合碘消毒液進行皮膚表面消毒,并在腹腔注射適量青霉素,待動物蘇醒后,放入籠中常規飼養。造模5 min后,將所有結扎大鼠進行心電圖監測,運用Powerlab/8s型八導數據分析記錄儀描記一段Ⅱ導聯心電圖,與造模前每只大鼠觀測的心電圖相比較,觀察ST段偏移幅度,以ST段較前抬高0.2 mV定為造模成功。將造模成功的大鼠隨機分為:模型組(n=16);麝香保心丸組(n=15):給予麝香保心丸24.3 mg·kg-1·d-1;單硝酸異山梨酯組(n=15):給予單硝酸異山梨酯7.2 mg·kg-1·d-1,低、中、高劑量組(各n=15):分別給予宣痹通瘀方0.8、1.6、3.2 g·d-1·kg-1,假手術組(n=15):大鼠的操作方法同模型組,只穿線不結扎。不同劑量組給予不同濃度、相同體積的方法,灌胃體積均為10 ml·kg-1·次-1。術后次日開始給藥,灌胃給藥1次/d,連續給藥4 w。每天灌胃后1 h進行心電圖檢測。
1.4.2指標檢測
1.4.2.1各組大鼠血清指標檢測 梯度融化-80℃保存的各組血清,按試劑盒說明書要求測量血清肌鈣蛋白(cTn)I含量。
1.4.2.2各組大鼠心電圖ST段改變、心肌梗死面積對比 造模后第4周末將大鼠心肌經氯化硝基四氮唑藍(NBT)染色,通過形態學圖像分析系統計算出心肌梗死面積占心肌總面積的百分比。
1.4.2.3免疫組織化學法測定 取心肌組織切片,按照試劑盒流程對各組大鼠心肌組織進行Notch1指標檢測。光學顯微鏡下觀察、拍照。
1.5統計學方法 采用SPSS19.0軟件進行單因素方差分析(One-way ANOVA)。
2 結 果
2.1造模前后各組大鼠一般狀態比較 模型組大鼠精神萎靡,進食差,實驗結束后模型組大鼠死亡6只,其余各組大鼠精神狀態逐漸好轉,活動逐漸靈活自如,進食飲水正常,其中麝香保心丸組、單硝酸異山梨酯組大鼠死亡4只,高劑量組死亡2只,中、低劑量組各死亡4只、5只。
2.2各組大鼠心肌梗死面積及cTnI含量比較 假手術組心肌切片未形成梗死區域;麝香保心丸組、單硝酸異山梨酯組、高、中劑量組心肌梗死面積均明顯低于模型組(P<0.01,P<0.05);低劑量組心肌梗死面積與模型組比較有減小趨勢,但差異無統計學意義(P>0.05)。模型組cTnI含量顯著高于假手術組(P<0.001);麝香保心丸組、單硝酸異山梨酯組,高、中、低劑量組cTnI含量顯著低于模型組(P<0.05,P<0.01)。見表1。
2.3各組大鼠心電圖ST段比較 冠狀動脈結扎前,各組心電圖ST段均在正常值范圍,差異無統計學意義(P>0.05)。冠狀動脈結扎后5 min、給藥第1~7天與假手術組比較,模型組各心電圖ST段均明顯抬高(P<0.001,P<0.01,P<0.05)。給藥第2~7天,高劑量組心電圖ST段上移幅度均明顯低于模型組(P<0.01,P<0.05);給藥第3~6天,中劑量組心電圖ST段上移幅度均明顯低于模型組(P<0.05,P<0.01);給藥第3~5天低劑量組心電圖ST段上移幅度明顯低于模型組(P<0.05)。給藥第2~5天,麝香保心丸組、單硝酸異山梨酯組心電圖ST段上移幅度均明顯低于模型組(P<0.05)。見表2。
2.4各組心肌Notch1陽性表達染色面積及平均光密度比較 與假手術組比較,模型組Notch1陽性表達染色面積及平均光密度表達均顯著上升(P<0.001);與模型組比較,麝香保心丸組、單硝酸異山梨酯組、低劑量組Notch1陽性表達染色面積及平均光密度表達均有下降趨勢,但差異無統計學意義(P>0.05);高、中劑量組Notch1陽性表達染色面積及平均光密度表達均顯著下降(P<0.01,P<0.05)。與單硝酸異山梨酯組比較,高、中劑量組Notch1陽性表達染色面積及平均光密度表達均顯著下降(P<0.01,P<0.05)。見表3。
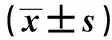
表1 各組大鼠心肌梗死面積及cTnI含量比較
與模型組比較:1)P<0.05;2)P<0.01;3)P<0.001,下表同

表2 各組不同時間點標準Ⅱ導聯心電圖ST段變化比較
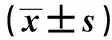
表3 各組Notch1陽性表達染色面積及平均光密度表達比較
與模型組比較 : 1)P<0.05,2)P<0.01,3)P<0.001;與單硝酸異山梨酯組比較:4)P<0.05,5)P<0.01
3 討 論
冠心病的病理基礎是冠脈粥樣硬化斑塊形成,造成管腔狹窄,使血流受阻,導致心肌缺血。冠心病的發病誘因有情緒激動、過勞、飽餐、寒冷等,其中因情緒激動誘發心絞痛的情況最為常見,西醫理論認為:情緒激動導致交感神經興奮,刺激冠脈血管痙攣收縮,引發心肌缺血,出現胸悶痛癥狀。中醫上冠心病屬于“胸痹”“心痛”“厥心痛”等范疇,對冠心病心絞痛的病因認識,中醫理論認為,情志不遂,肝失疏泄調達,氣機升降出入失常,氣行不暢,氣為血之帥,氣行則血行,氣滯則血停,血行不暢,瘀滯不通,不通則痛發為胸痹心痛。中西醫在各自理論的指導下,建立了獨立的治療方案。
本實驗模型組肌絲束溶解、斷裂,肌絲排列略松散、不整齊,提示急性心肌缺血大鼠模型制作成功。心電圖ST段改變是通過心臟電活動反應心肌缺血的一項評價指標,單硝酸異山梨酯作為治療冠心病的經典用藥,對急性心肌缺血心電圖ST段的干預作用是毋庸置疑的。本研究表明,宣痹通瘀方、麝香保心丸及單硝酸異山梨酯均有有改善心肌缺血及減少心肌梗死面積的作用。
在哺乳動物體內,目前發現Notch的4種受體和5種配體分別是Notch1、2、3、4及Delta like1、3、4和Jagged1、2〔6〕,其中受體Notch1、Notch4與配體Dell4主要在血管內皮細胞中表達,并在塑造血管的過程中發揮功能〔7〕。本實驗提示宣痹通瘀方可以通過調節Notch含量來發揮改善心肌缺血的作用,宣痹通瘀高、中、低劑量組干預Notch1的作用明顯強于單硝酸異山梨酯組,考慮與中藥發揮益氣化瘀、理氣通絡作用相關。
綜上,宣痹通瘀方和麝香保心丸能改善氣滯血瘀型急性心肌缺血大鼠的心肌梗死面積、心電圖ST-T改變,對心肌缺血有改善,其機制可能是宣痹通瘀方中重用活血化瘀、益氣通絡的藥物,能祛瘀生新,從而達到上調Notch的作用,進而促進血管新生而發揮改善心肌缺血的作用。
4 參考文獻
1Murphy E,Steenbergen C.Ion transport and energetics during cell death and protection〔J〕.Physiology(Bethesda),2008;23:115-23.
2Piper HM,Abdallah Y,Schafer C.The first minutes of reperfusion:a window of opportunity for cardioprotection〔J〕.Cardiovasc Res,2004;61(3):365-71.
3Varadarajan SG,An J,Novalija E,etal.Changes in 〔Na(+)〕(i),compartmental〔Ca(2+)〕,and NADH with dysfunction after global ischemia in intact hearts〔J〕.Am J Physiol Heart Circ Physiol,2001;280(1):H280-93.
4Tanno M,Miura T.Protecting ischemic hearts by modulation of SR calcium handling〔J〕.Cardiovasc Res,2007;75(3):453-4.
5王 旺,吳曉華,黃 文.結扎大鼠左冠狀動脈前降支造成心肌缺血模型的實驗研究〔J〕.現代預防醫學,2011;38(10):1899-900.
6Xie J,Wang W,Si JW,etal.Notch singnaling regulates CXCR4 expression and the migration of mesenchymal stem cell 〔J〕.Cell Immunol,2013;281(1):68-75.
7Kume T.Ligand-dependent Notch signaling in vascular formation 〔J〕.Adv Exp Med Biol,2012;727:210-22.

