二噁英暴露對成年男性血清類固醇激素的影響
沈 斌 ,施麗麗 ,董晶劍 ,馮 昊 ,沈林杰 ,項 菁 ,李文靜 ,羅 挺 ,城戶照彥 ,孫獻亮 ,*(.嘉興學院醫學院,浙江 嘉興 3400;.日本金澤大學醫藥保健學院保健學系,日本 金澤 908640)
二噁英是多氯代二苯并二噁英(PCDDs)、多氯二苯并呋喃(PCDFs)的統稱,主要來源于金屬冶煉、礦石燒結、水泥制造、廢物焚燒等大型工業生產及生活垃圾焚燒[1-4].二噁英作為一種持久性有機污染物,脂溶性高,極難降解,在生物體內的半衰期約為 7~11a,影響持久[5],對環境和人類健康造成嚴重危害.長期接觸二噁英會造成免疫系統、發育中的神經系統、內分泌系統以及生殖功能的損害[6],其中最主要的危害是對內分泌的干擾.動物實驗發現,二噁英類物質中毒性最強的四氯二苯并二噁英(TCDD)通過影響小鼠芳香烴受體(AhR)的表達,降低類固醇激素孕酮、雄烯二酮、睪酮和雌二醇水平[7],此外,TCDD通過影響芳香酶(CYP19A1)的活化,降低雌二醇分泌[8].流行病學研究發現,二噁英的潛在暴露會導致兒童類固醇激素睪酮、雌二醇水平降低[9],脫氫表雄酮水平升高[8].而成年女性暴露二噁英導致皮質醇和可的松水平升高[11].近年關于越南戰爭期間服役的美軍退役士兵的研究中發現,TCDD暴露導致男性士兵睪酮水平降低[12],患前列腺癌癥的風險提高[13-14].然而上述動物實驗與美軍退役士兵的研究中并未對其他種類的二噁英同類物進行測定.
在越南戰爭期間美軍使用了大量含有二噁英的枯葉劑,對當地環境和居民健康造成了嚴重危害.雖然二噁英的使用(1962~1971年)已經過去了40多a,但是污染地區土壤中、周邊居民血液中的二噁英濃度仍比非污染地區高出 3-5倍[15-16].由于二噁英分析屬于超痕量分析,分析成本高,故在越南國內關于二噁英對人體健康危害的研究較少.為了解二噁英暴露對越南成年男性類固醇激素分泌的干擾,本研究于 2011~2012年對二噁英污染地區的50名成年男性和非污染地區的48名成年男性的血清中9種類固醇激素和17種二噁英同類物進行了調查分析.
1 材料與方法
1.1 研究區域
污染地區選擇了越南Bien Hoa地區,在越南戰爭期間存放了大量農藥并大量噴灑使用. Bien Hoa位于越南Dong Nai省,是越南南部3個具有代表性的二噁英污染地區之一[15-16].研究區域詳見圖1.
圖1 研究區域Fig.1 Map of Vietnam and study areas
1.2 樣品采集
本研究隨機選取二噁英污染地區50名男性和非污染地區48名男性為受試者,所有被試者的年齡均在50歲以上,在調查地區居住時間40a以上,為確保類固醇激素檢出的準確性,所有樣品的采集均在上午8:00~10:00之間進行,采集血液樣本 10mL,離心后血清放入采樣小瓶內,保存于放有干冰的冷藏盒內.采樣結束后統一存放于-30℃低溫冰箱內直到分析測試.
1.3 樣品處理與分析
1.3.1 血清中二噁英的測定(1)實驗材料 正已烷、甲苯(色譜純,美國Heneywell公司);二氯甲烷(色譜純,德國 Merck公司);乙酸乙酯(色譜純,日本Wako公司);硅藻土(德國Merck公司);二噁英標準物質(除去 2,3,7,8-TeCDF、2,3,7,8-TeCDD濃度為40ng/mL,OCDD、OCDF濃度為400ng/mL,其他濃度均為200ng/mL)、13C12標記的二噁英回收內標標準溶液(除13C12濃度為200ng/mL外,其余濃度均為100ng/mL)、13C12標記的二噁英添加內標標準溶液(濃度為200ng/mL)(美國Well-labs,Wellington公司).
(2)樣品前處理
取4mL血清加入10μL13C12標記的二噁英標準溶液,然后轉移至少量硅藻土上,在-40℃冰箱冷凍 6h后,放入冷凍干燥機干燥.凍干后樣品加入適量硅藻土研磨混勻后,加于快速溶劑提取儀的萃取池中(ASE350,美國 Thermo Fisher Scientific公司),配制體積比為1:1的正己烷與二氯甲烷混合溶劑作提取溶劑,用 ASE350提取樣品中的二噁英.
(3)樣品的純化
將提取液轉移至250mL茄形瓶中,濃縮至恒重,稱取并記錄脂肪重量,加入10μL13C12標記的二噁英標準溶液和150mL正己烷混勻,在45℃下減壓旋蒸至 5mL,以全自動凈化系統進行凈化(Fluid Management System,美國 FMS 公司),收集含有二噁英的洗脫液.將收集的二噁英洗脫液過酸性硅膠柱,洗脫液濃縮至微干,加 5μL13C12標記的二噁英作為內標標準溶液,并轉至錐形樣品瓶中待上機檢測.
(4)儀器分析
采用HP6890HRGC(美國Hewlett Packard公司)和 JEOL JMS-S700HRMS(美國 Therm Finnigan公司)聯用分析儀.
色譜條件:DB-5MS(60m×0.25mm×0.25L)色譜柱對17種二噁英單體進行分離.色譜柱升溫程序:初始溫度80℃保持2min,以20℃/min速率升至180℃,再以5℃/min速率升至300℃保持3min.
質譜條件:電離方式,ESI源;電離能量,35eV;采用選擇離子(SIM)測定;離子源溫度,300℃.
(5)質量控制
嚴格按照美國國家環保局EPA1613方法對樣品分析過程進行質量控制,確保數據的準確.采用13C同位素內標稀釋定量法對血清中二噁英進行定量.背景干擾以扣除實驗空白為準.結果表明,空白實驗組的回收率介于 33.4%~119%;樣品回收率范圍:30%~120%,在EPA檢測方法的可接受范圍之內.
1.3.2 血清中類固醇激素的測定(1)主要儀器和試劑 API4000三重四極桿質譜儀(加拿大MDS Sciex公司);Agilent1100高效液相色譜系統及PTC自動進樣器(德國 Waldbronn公司);高速離心機(日本Shimadazu公司)等.
皮質醇、可的松、孕酮、雄烯二酮、雌酮(Estrone)、睪酮、雙氫睪酮、脫氫表雄酮、雌二醇標準品(德國 Merck公司);甲醇(色譜純,美國Heneywell公司);乙酸乙酯(色譜純,日本Wako公司);羥胺(日本 Wako公司)等.
(2)混合標準溶液的配置
分別稱取適量標準品用乙酸乙酯準確定容,然后分裝并放置-70℃保存備用.取少量標準品乙酸乙酯溶液用甲醇準確定容稀釋成濃度為100ng/mL的標準溶液,置于-30℃保存.按照9種類固醇激素在人體血清中的大致含量將標準品按比例配制成混合標準品,再用生理鹽水稀釋到不同濃度.配制濃度為 100ng/mL的皮質醇-2H4(1ng),脫氫表雄酮-2H4(100pg),孕酮-13C3(100pg),雌酮-13C4(100pg)和雌二醇-13C4(100pg)混合內標水溶液備用.
(3)樣品前處理
取 200μL血清加入 1.5mL離心管中,加100ng/mL混合內標溶液 20μL,再加入 600μL乙酸乙酯,渦旋振蕩 10min,12000×g離心 5min,4℃靜置30min后取上清液用氮吹儀吹干,加入羥胺100μL,混勻振蕩 10min,再放入恒溫箱 60℃衍生化反應1h,待上機檢測.
(4)儀器分析
采用AT1000LC和API4000MS聯用分析儀(LC-MS/MS).
色譜條件:采用 Phenomenex C18反相色譜柱(100mm×2.1mm, 2.6μm)和 PhenomenexC18 預保護柱.流動相A為H2O(含0.1%甲酸),流動相B為甲醇(含 0.1%甲酸).柱溫為 35℃,進樣體積為20μL.
質譜條件:電離方式, ESI源;采用多反應監測(MRM)的質譜掃描模式.噴霧電壓(IS)為5500V;碰撞氣(CAD)為 Medium;氣簾氣(CUR)為40kPa;離子源霧化氣(GS1)和加熱輔助氣(GS2)均為60kPa;去溶劑溫度為550℃.
1.4 統計學方法
采用 SPSS 12.0軟件和 JMP @ 9軟件包(SAS institute,Cary,NC,USA)進行數據統計分析.本文中數據由均值±SD或由中位數及四分位數間距來表示.采用 Student t檢驗(正態分布)或Mann-Whitney U檢驗(非正態分布)進行組間比較.由于血清中的二噁英濃度和類固醇激素濃度均為非正態分布,故采用 spearman相關分析法,進行相關分析.
2 結果
2.1 兩個地區受試者人群特征的比較
本文隨機選取二噁英污染地區的 50名成年男性及非污染地區的 48名成年男性作為受試者.如表1所示,兩個地區的受試者年齡、體質指數(BMI)、受教育程度上沒有顯著性差異.在居住時間上,污染地區的受試者的居住時間明顯長于非污染地區的受試者,且所受試者在該地區的居住時間均在50a以上.從而確保了受試者在越南戰爭期間到調查實施期間都居住在所調查地區.

表1 兩個地區受試者人群特征的比較Table 1 Demographic characteristics of participants in the two areas
2.2 兩個地區受試者血清中類固醇激素水平的比較
兩個地區男性受試者血清類固醇激素水平如表 2所示,二噁英污染地區及非污染地區受試者體內皮質醇、可的松、孕酮、雄烯二酮、雌酮水平沒有顯著性差異(P>0.05).污染地區受試者血清中睪酮、雙氫睪酮、雌二醇的水平均高于非污染地區,而脫氫表雄酮的水平低于非污染地區,差異均有統計學差異(P<0.05).
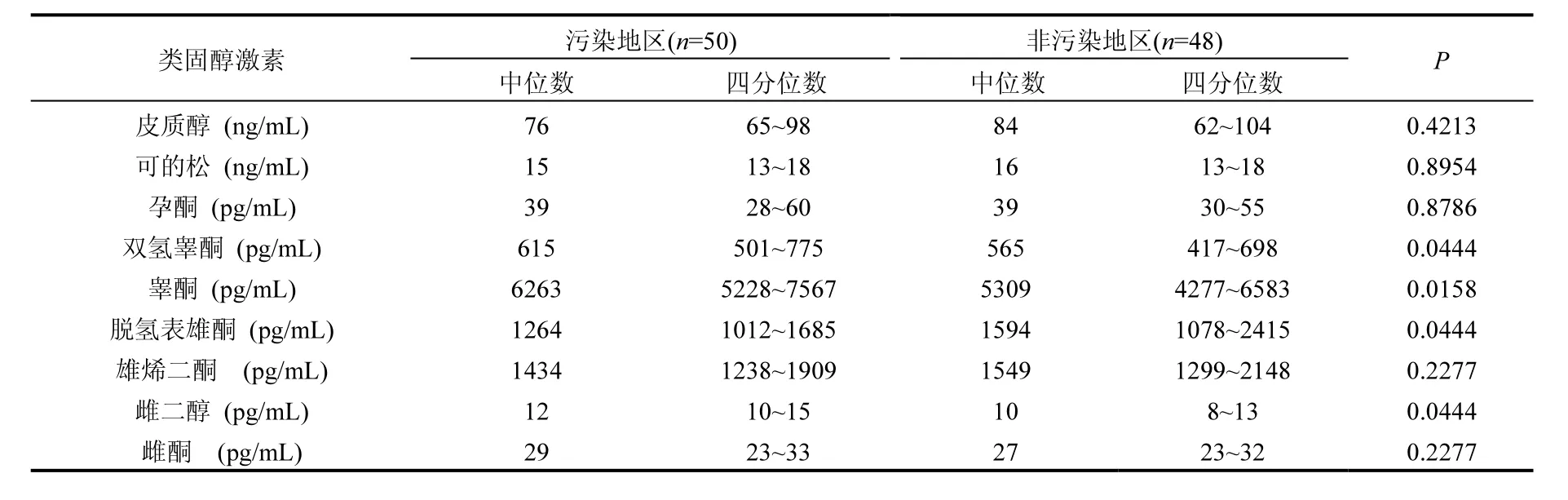
表2 兩個地區男性受試者血清類固醇激素水平的比較Table 2 Comparison of serum levels of steroid hormones in males from the two areas
2.3 兩個地區受試者血清中二噁英濃度的比較
表 3是對兩個地區男性受試者血清中 17種二噁英同類物濃度的比較.從結果可知,在二噁英污染地區受試者血清中的各二噁英同類物中除2378-TeCDF、12378-PeCDF、123789-HxCDF、1234789-HpCDF、OCDF外,其他 12種二噁英同類物及PCDDs、PCDFs、PCDD/DFs毒性當量均高于非污染地區,各差異均有統計學意義(P<0.05).其中 12378-PeCDD、123678-HxCDD、1234678-HpCDD、OCDD、123478-HxCDF、123678- HxCDF、1234678-HpCDF的濃度比非污染地區高 5~10倍.PCDDs、PCDFs、PCDD/DFs毒性當量比非污染地區高3倍以上.
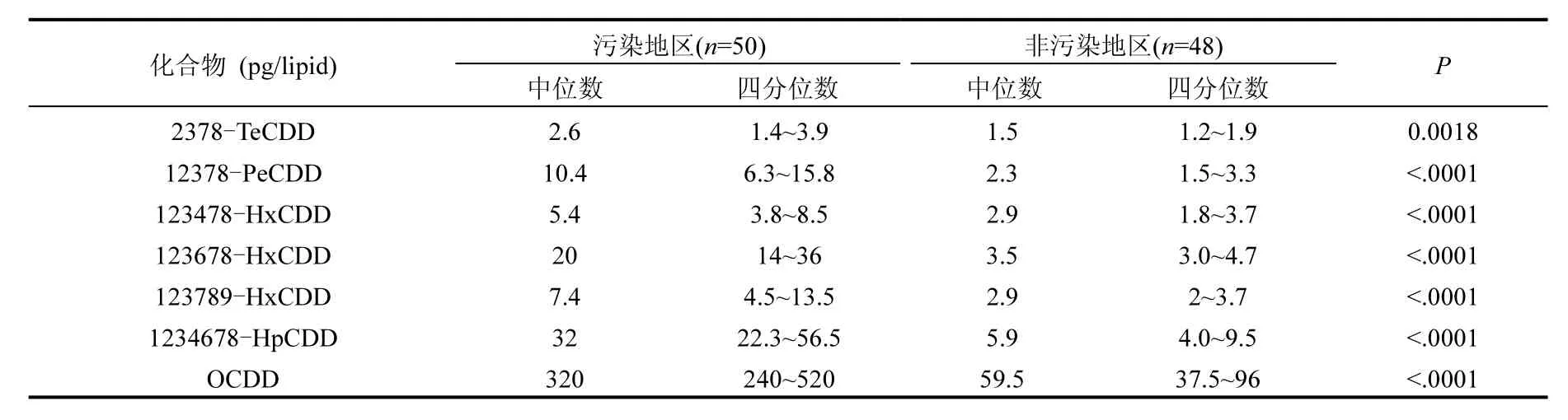
表3 兩個地區男性受試者血清中二噁英水平的比較Table 3 Comparison of serum levels of dioxins in males from the two areas
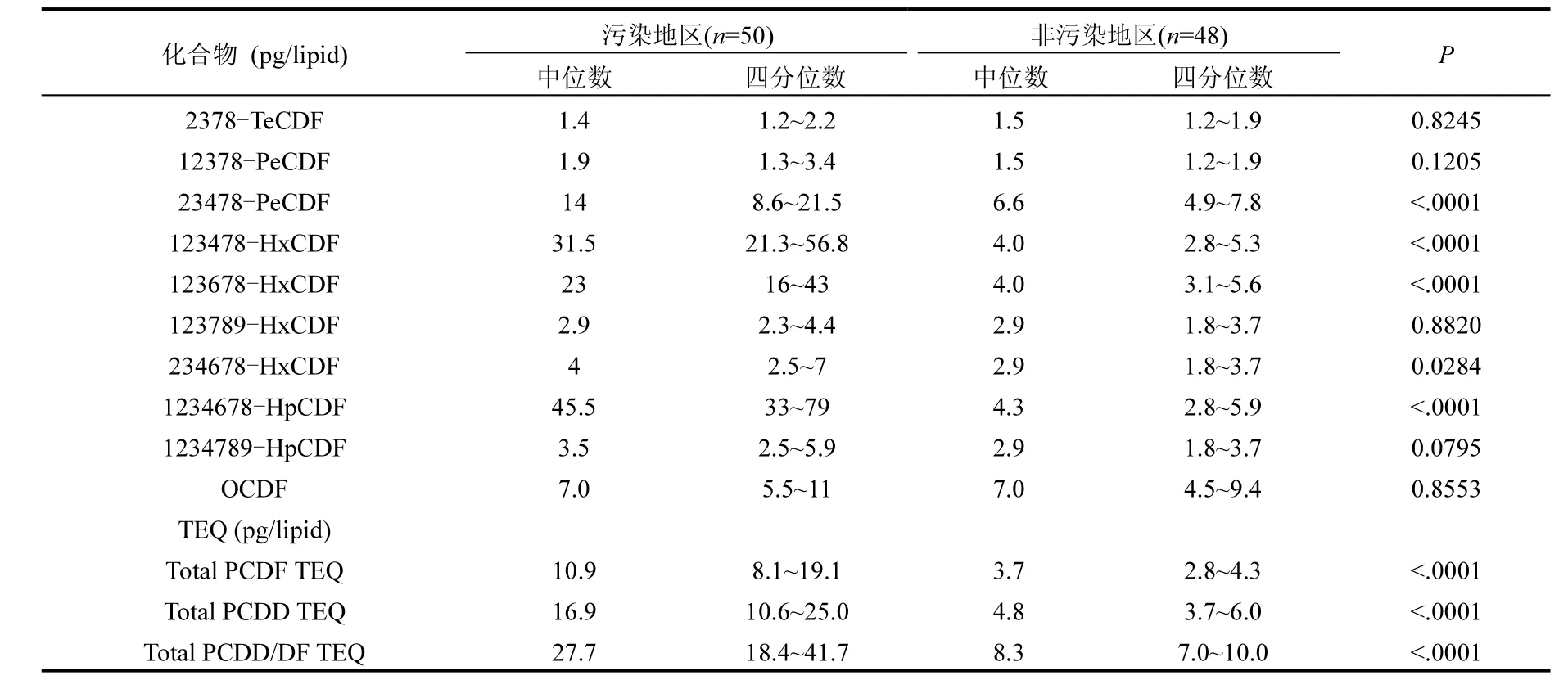
續表3
2.4 兩個地區受試者血清中類固醇激素與二噁英的相關性
表4可見,雌二醇的水平與17種二噁英同類物 12378-PeCDD、123678-HxCDD、1234678-HpCDD、1234678-HpCDF呈顯著性正相關.睪酮的水平與 123678-HxCDD、1234678-HpCDD、OCDD、1234678-HpCDF呈顯著性正相關,雙氫睪酮的水平與1234678-HpCDD、OCDD呈顯著性正相關.脫氫表雄酮的水平與 123678-HxCDD呈顯著性負相關.皮質醇、可的松、孕酮、雄烯二酮、雌素酮的水平與二噁英濃度沒有顯著性相關(數據未顯示).
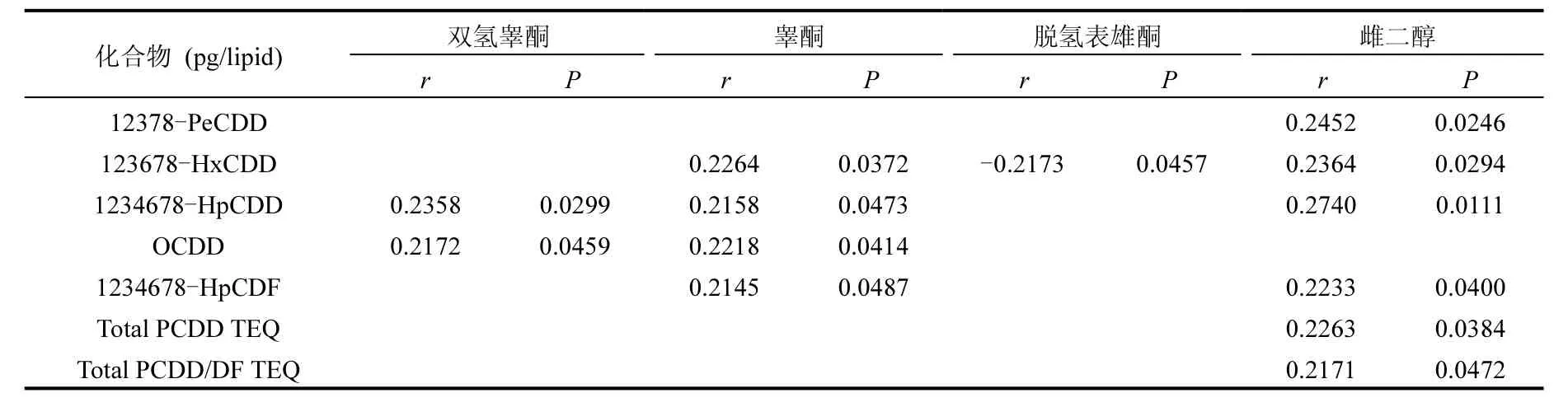
表4 兩個地區類固醇激素與二噁英的相關性Table 4 Correlation between steroid hormones and dioxins in the two areas
2.5 年齡與類固醇激素的相關性
表 5可見,污染地區成年男性血清中睪酮、雙氫睪酮、雌二醇的水平隨年齡的增長而增高,而脫氫表雄酮的水平隨著年齡增長而降低,以上相關性均具有統計學意義(P<0.05).二噁英非污染地區男性血清中雙氫睪酮、睪酮、雌酮、脫氫表雄酮的水平變化與普通男性變化趨勢一致[17-19].

表5 年齡與類固醇激素的相關性Table 5 Correlation of steroid hormones and age

續表5
3 討論
越南戰爭已經過去了40多a,二噁英在人體血清中的濃度大幅降低[16,20],但本研究污染地區成年男性血清中二噁英毒性當量仍比非污染地區高出3倍以上.
本研究發現,睪酮的水平與二噁英同類物123678-HxCDD、1234678-HpCDD 、OCDD、1234678-HpCDF呈顯著性正相關,二噁英污染地區睪酮水平明顯高于非污染地區,且水平隨著年齡的增長而升高.男性睪酮由睪丸分泌,腎上腺亦分泌少量睪酮,一般成年男性的睪酮水平隨年齡的增長而降低[19].動物實驗研究發現雄性大鼠的腦垂體可能是二噁英的靶器官,二惡英的暴露導致腦垂體機能下降,從而干擾血漿睪酮、雌二醇之間的正常反饋機制,導致睪酮、雌二醇水平異常[21].然而Araki等[22]在人群實驗研究中發現,嬰兒臍帶血中睪酮水平的變化與其睪丸間質細胞和血清細胞相關.因此,我們認為二噁英對人體類固醇激素睪酮的影響機制與動物不同,本研究中污染地區成年男性睪酮水平的增高可能是由二噁英直接作用與睪丸間質細胞和血清細胞引起.
雙氫睪酮可由睪丸直接生成,也可由睪酮與人體內 5α-轉化酶反應后生成[23].本研究發現,雙氫睪酮的水平與1234678-HpCDD、OCDD呈顯著性正相關,二噁英污染地區雙氫睪酮水平明顯高于非污染地區,且水平隨著年齡的增長而升高.研究發現,二噁英暴露與 5α-轉化酶活性之間沒有顯著的相關性[24].本研究中雙氫睪酮水平的增高可能與睪酮水平的增高相似,即由二噁英直接作用與睪丸間質細胞和血清細胞引起.
本研究發現,雌二醇的水平與 12378-PeCDD、123678-HxCDD、1234678-HpCDD、1234678-HpCDF呈顯著性正相關,二噁英污染地區成年男性血清中雌二醇的水平明顯高于非污染地區,且水平隨年齡的增長而增高.作為男性雌激素中活性最高的雌二醇,其水平的變化與睪酮水平相關,睪酮在芳香化酶作用下可轉化為雌二醇[25].最新的研究發現,二噁英暴露導致腫瘤塊中芳香烴受體表達水平增加,雌二醇可能通過雌激素受體與芳香烴受體之間的相互作用而影響芳香烴受體的表達[26].本研究中二噁英污染地區雌二醇水平的升高可能是,二噁英暴露導致的芳香烴受體與雌激素受體表達變化與睪酮水平升高共同作用的結果.
多項研究表明,高水平的睪酮與低水平的性激素結合球蛋白會導致成年男性患前列腺癌癥風險增加[27-28],雌二醇與雄激素協調作用會誘發前列腺疾病[29].另外研究發現,低水平雙氫睪酮的成年男性罹患前列腺癌的分險系數較低[30].前列腺作為睪酮、雙氫睪酮和雌二醇的目標器官被人們熟知.由此推測,二噁英暴露導致的睪酮、雙氫睪酮和雌二醇水平的增高可能會誘發前列腺疾病.由于本次研究并未對被試前列腺疾患進行診斷,因此,這一結論有待在今后的研究中進一步驗證.
研究表明,人體脫氫表雄酮水平隨年齡的增長而降低,是人類衰老的生物標志物[31].本研究中,脫氫表雄酮的水平與123678-HxCDD呈顯著性負相關,二噁英污染地區成年男性脫氫表雄酮水平隨年齡降低的趨勢明顯大于非污染地區(污染地區vs非污染地區r= -0.3177vs r= -0.1957),二噁英暴露可能加速人體衰老.此外發現,二噁英暴露會導致促腎上腺皮質激素水平降低[32],脫氫表雄酮作為腎上腺激素,受促腎上腺皮質激素調節[33-34],這可能是導致本研究中脫氫表雄酮水平降低的主要原因.
本次研究中,17種二噁英同類物中氯數最少毒性最強的TCDD與類固醇激素無相關性,而氯數更多脂溶性更強的 12378-PeCDD、123678-HxCDD、1234678-HpCDD、OCDD、1234678-HpCDF與上述類固醇激素呈顯著性相關(P<0.05).這一結果與我們之前所作的關于母乳中二噁英暴露對其子代類固醇影響的研究結果相似,即氯數更多脂溶性更強的二噁英同類物與類固醇激素表現出更強的相關性[10,35].二噁英同類物對人體的毒性作用需要在今后做進一步的研究和討論.
4 結論
4.1 二噁英暴露導致成年男性性激素睪酮(污染地區6263pg/mLvs非污染地區5309pg/mL)和雌二醇(污染地區 12ng/mLvs非污染地區10ng/mL)水平增高,可能誘發患前列腺疾病風險增高.
4.2 二噁英暴露導致成年男性脫氫表雄酮水平隨年齡增長而降低趨勢明顯(污染地區 r=-0.3177vs非污染地區r= -0.1957),致快速衰老的風險增高.
[1]付建平,韓靜磊,于曉巍,等.幾種可能來源對廣東某地空氣中二噁英的影響 [J]. 環境科學, 2017,38(2):502-509.
[2]俞明鋒,李曉東,侯霞麗,等.生活垃圾焚燒飛灰中元素分布與二噁英的關聯性分析 [J]. 環境污染與防治, 2017,39(1):28-34.
[3]齊 麗,任 玥,李 楠,等.垃圾焚燒廠周邊大氣二噁英含量及變化特征—以北京某城市生活垃圾焚燒發電廠為例 [J]. 中國環境科學, 2016,36(4):1000-1008.
[4]雷 鳴,海 景,程 江,等.小型生活垃圾熱處理爐二惡英和重金屬的排放特征 [J]. 中國環境科學, 2017,37(10):3836-3844.
[5]Milbrath M O, WengerY, Chang C W, et al. Apparent half-lives of dioxins, furans, and polychlorinated biphenyls as a function of age, body fat, smoking status, and breast-feeding [J].Environmental Health Perspectives, 2009,117(3):417-425.
[6]WHO. Dioxin and their effects on human health [R]. Updated October 2016. http://www.who.int/mediacentre/factsheets/fs225/en/.
[7]Karman B N, Basavarajappa M S, Craig Z R, et al. 2,3,7,8-Tetrachlorodibenzo-p-dioxin activates the aryl hydrocarbon receptor and alters sex steroid hormone secretion without affecting growth of mouse antral follicles in vitro [J]. Toxicology and applied pharmacology, 2012,261(1):88-96.
[8]Sechman A, Antos P, Katarzyńska D, et al. Effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin on secretion of steroids and STAR, HSD3B and CYP19A1mRNA expression in chicken ovarian follicles [J]. Toxicology Letters, 2014,225(2):264-274.
[9]Su PH, Huang PC, Lin CY et al. The effects in utero exposure to dioxins and polychlorinated biphenyls on reproductive development in eight years-old children [J]. Environment International, 2012,39(1):181-187.
[10]Anh L T, Kido T, Honma S, et al. A relationship in adrenal androgen levels between mothers and their children from a dioxin-exposed region in Vietnam [J]. Science of the Total Environment, 2017,607-608:32-41.
[11]Kido T, Tung V D, Manh H D, et al. High cortisol and cortisone levels are associated with breast milk dioxin concentrations with breast milk dioxin concentrations in Vietnamese women [J].European Journal of Endocrinology, 2013,170(1):131-139.
[12]Gupta A, Ketchum N, Rothrborn C G, et al. Serum dioxin,testosterone, and subsequent risk of benign prostatic hyperplasia:a prospective cohort study of air force veterans [J]. Environmental Health Perspectives, 2006,114(11):1824—1831.
[13]Ansbaugh N, Shanonon J, Mori M, et al. Agent Orange as a risk factor for high grade prostate cancer [J]. Cancer, 2013,119(13):2399—2404.
[14]Yi S W, Ohrr H. Agent Orange exposure and cancer incidence in Korean Vietnam veterans: A prospective cohort study [J]. Cancer,2014,120(23):3699—3706.
[15]Hue N T M, Nam V D, Thuong N V, et al. Determination of PCDD/Fs in breast milk of women living in the vicinities of Da Nang Agent Orange hot-spot (Vietnam) and estimation of the infant’s daily intake [J]. Science of the Total Environment, 2014,491-492:212-218.
[16]Manh H D, Kido T, Okamoto R, et al. Serum dioxin levels in Vietnamese men more than 40years after herbicide spraying [J].Environmental Science and Technology, 2014,48(6):3496-3503.
[17]Wu F C, Tajar A, Pye S R, et al. Hypothalamic-pituitarytesticular axis disruptions in older men are differentially linked to age and modifiable risk factors: the European male aging study[J]. Journal of Clinical Endocrinology and Metabolism, 2008,93(7):2737-2745.
[18]Perheentupa A, Makinen J, Laatikainen T, et al. A cohort effect on serum testosterone levels in Finnish men [J]. European Journal of Endocrinology, 2013,168(2):227-233.
[19]Zirkin B R, Tenover J L. Aging and declining testosterone: past,present, and hopes for future [J]. Journal of Andrology, 2012,33(6):1111-1118.
[20]Schecter A, Christiane P F, Peapke O, et al. Dioxin dibenzofurans and selected chlorinated organic compounds in human milk and blood from Cambodia, Germany, Thailand, the USA, the USSR and Vietnam [J]. Chemosphere, 1991,23(11/12):1903—1912.
[21]Bookstaff R C, Moore R W, Peterson R E. 2,3,7,8-tetrachlorodibenzo-p-dioxin increases the potency of androgens and estrogens as feedback inhibitors of luteinizing hormone secretion in male rats [J]. Toxicology and Applied Pharmacology,1990,104(2):212—224.
[22]Araki A, Mitsui T, Miyashita C, et al. Association between maternal exposure to di(2-ethylhexyl) phthalatae and reproductive hormone levels in fetal blood: The Hokkaido study on environment and chikdren’s health [J]. PLoS One, 2014,9(10):1-10.
[23]Parsons, J K, Carter, H B, Platz, E A, et al. Serum testosterone and the risk of prostate cancer: Potential implications for testosterone therpy [J]. Cancer Epidemiology, Biomarkers and Prevention, 2005,14(9):2257—2260.
[24]Ko K, Theobald H M, Moore R W, et al. Evidence that inhibited prostatic epithelial bud formation in 2,3,7,8-tetrachlorodibenzop-dioxin-exposed C57BL/6J fetal mice is not due to interruption of androgen signaling in the urogenital sinus [J]. Toxicological Sciences, 2004,79(2):360-369.
[25]Chen C, Weiss N S, Stanczyk F Z, et al. Endogenous sex hormones and prostate cancer risk: a case—control study nested within the Carotene and Retinol Efficacy Trial [J]. Epidemiology,Biomarkers and Prevention, 2003,12(12):1410—1416.
[26]Go R E, Hwang K A, Kim C W, et al. Effect of dioxin and 17β-estradiol on the expression of cytochrome P450 1A1gene via an estrogen receptor dependent pathway in cellular and xenografted models [J]. Environment Toxicology, 2017,32(10):2225-2233.
[27]Walsh P C, Wilson J D. The induction of prostatic hypertrophy in the dog with androstanediol [J]. Journal of Clinical Investigation,1976,57(4):1093-1097.
[28]Gann P H, Hennekens C H, Ma J, et al. Prospective study of sex steroid hormone levels and risk of prostate cancer [J]. Jnci Journal of the National Cancer Institute, 1996,88(16)1118—1126.
[29]Parsons J K, Carter H B, Platz E A, et al. Serum testosterone and the risk of prostate cancer: potential implications for testosterone therpy [J]. Cancer Epidemiology Biomarkers & Prevention 2006,14(9):2257—2260.
[30]Muller R L, Gerber L, Moreira D M, et al. Serum testosterone and Dihydrotestosterone and Prostate Cancer Risk in the Placebo Arm of the Reduction by Dutasteride of Prostate Cancer Events Trial[J]. European Urology, 2012,62(5):757—764.
[31]Rutkowski K, Sowa P, Retkow-Talipska J, et al.Dehydroepiandrosterone (DHEA): Hypes and Hopes [J]. Drugs,2014,74(11):1195-1207.
[32]Bestervelt L L, Cai Y, Piper D W, et al. TCDD alters pituitaryadrenal function. I: adrenal responsiveness to exogenous ACTH[J]. Neurotoxicology & Teratology, 1993,15(6):365—370.
[33]Starka L, Duskova M, Hill M. Dehydroepiandrosterone: a neuroactive steroid [J]. Journal of Steroid Biochemistry &Molecular Biology, 2015,145:254—260.
[34]Rege J, Nakamura Y, Satoh F, et al. Liquid chromatography—tandem mass spectrometry analysis of human adrenal vein 19-carbon steroids before and after ACTH stimulation [J].Journal of Clinical Endocrinology & Metabolism, 2013,98(3):1182—1188.
[35]Kido T, Honma S, Nhu D D, et al. Inverse association of highly chlorinated dioxin congeners maternal breast milk with dehydroepiandrosterone levels in three-year-old Vietnamese children [J]. Science of the Total Environment, 2016,550:248-255.

