蘆薈多糖對炎癥性腸病小鼠免疫功能及OX40、OX40L表達的影響*
劉 達 諸凡凡 向正國△
(1.解放軍第101醫院,江蘇 無錫 214000;2.江蘇省無錫市中醫醫院,江蘇 無錫 214000)
炎癥性腸病(IBD)是發生于結腸、直腸和回腸的一種特發于腸道的炎癥性疾病,包括潰瘍性結腸炎和克羅恩病[1]。IBD一般多伴隨反復持續性腹瀉、腹痛、血便等臨床癥狀。隨著人們生活方式的改變和生活水平的提高,IBD的發生率呈逐漸增加趨勢[2],然而其發病機制尚不清楚。中醫學認為,本病是由勞心過度、寒涼不謹引起,基本病機是脾虛失運、氣滯血瘀、濕熱邪毒等,屬于“腸澼”“痢疾”等范疇[3]。 蘆薈多糖是提取自蘆薈的有效成分之一,具有抗感染、瀉下、抗腫瘤等藥理活性[4]。據報道,蘆薈多糖可有效促進損傷組織的再生和修復,改善造血功能,對應激性潰瘍等疾病具有良好的治療作用[5],但其作用機制尚不清楚。本研究通過構建IBD小鼠模型,觀察蘆薈多糖對IBD模型小鼠結腸黏膜組織中免疫功能,以及對結腸黏膜組織中OX40、OX40L表達的影響,以期揭示蘆薈多糖改善炎癥性腸病的分子機制。現報告如下。
1 材料與方法
1.1 實驗動物 60只雄性健康SPF級BALB/c小鼠,體質量(22±2)g,廣東省醫學實驗動物中心,許可證號:SCXK(粵)-2013-0002。于本院實驗動物中心常規飼養,自由飲水,飲食。所有實驗均經本院動物實驗倫理委員會批準。
1.2 試劑與儀器 蘆薈多糖,純度98%,規格1 g,上海源葉科技生物公司,批號20161108;柳氮磺吡啶(SASP)腸溶片(信宜),規格 0.25 g,購自上海福達制藥有限公司, 批號 20160605;2,4,6-三硝基苯磺酸(TNBS,貨號 P2297),規格 10 mL,購自美國 Sigma 公司;戊巴比妥鈉(貨號096956-001),購自北京華業寰宇化工公司;HE染色試劑盒(貨號E607318-0200)、蛋白提取試劑盒(貨號C006225-0050)、BCA試劑盒(貨號 C503021-0500)、DAB 顯色試劑盒(貨號 E670033),購自上海生工生物技術公司;Anti-OX40(貨號ab213894)、Anti-CD134/OX40L(貨號 ab80677)、Anti-GAPDH (貨號ab181602),均購自美國Abcam公司。Olympus CX41光學顯微鏡,日本Olympus公司;石蠟烤片機、切片機,購自德國Leica公司;蛋白電泳儀、半干轉膜儀,購自美國Bio-Rad公司;Tanon 5500發光成像系統,購自上海天能公司等。
1.3 造模與分組 采用TNBS法構建IBD小鼠模型[6]。造模開始前小鼠禁食不禁水24 h,術前給予小鼠1.5%戊巴比妥鈉(0.5 mL/100 g)腹腔注射麻醉,采用100 mg/kg TNBS造模,將無菌輸液管插入小鼠肛門上段約8 cm處,采用1 mL注射器抽吸TNBS原液(0.2 mL/100 g)后,抽吸 0.25 mL 50%乙醇,混合均勻后,經無菌輸液管輕輕推入混合試劑,維持小鼠肛門高位狀態2 min,將小鼠轉移至飼養籠中。術中、術后維持小鼠體溫均在(37±0.5)℃。正常對照組正常飼喂,不做任何處理。每日記錄小鼠攝食量、飲水量、大便性狀、活動情況等。本研究造模未造成小鼠死亡,共計50只小鼠造模成功。隨機分為模型組、SASP組及蘆薈多糖低、中、高劑量組,每組10只,另設正常對照組10只。
1.4 給藥方法 蘆薈多糖低、中、高劑量組每天按時予蘆薈多糖 150、300、600 mg/(kg·d) 灌胃治療;SASP組予 SASP 514 mg/(kg·d)灌胃治療,相當于人臨床用藥劑量的12倍;正常對照組及模型組予等量0.9%氯化鈉注射液灌胃,各組均連續灌胃給藥10 d。
1.5 標本采集與檢測 末次給藥結束后,麻醉處死小鼠,迅速取出其結腸黏膜組織,分為2份,一份置于4%多聚甲醛中固定,制備石蠟切片;一份置于液氮中速凍,-80℃保存。1)小鼠疾病活動指數(DAI)評分變化。按照Okayasu等評分標準[7],對各組小鼠大便性狀、體質量變化、大便隱血情況進行觀察并評分,計算各小鼠疾病活動指數積分。2)小鼠結腸黏膜組織病理變化。對小鼠結腸黏膜組織石蠟切片進行脫蠟、水化處理。按照HE法染色流程對切片進行染色,中性膠封片,置于光學顯微鏡下,觀察小鼠結腸黏膜組織形態并拍照。3)小鼠胸腺、脾臟系數測定及碳粒廓清試驗。藥物作用第10日,稱取小鼠體質量。將印度墨汁注射進各小鼠尾靜脈后立即計時,分別于第30、300 s從小鼠內眥靜脈處采血15 μL,加入2 mL 0.1%Na2CO3,混勻。同樣方法取正常對照組小鼠靜脈血校零,于675 nm處測定血清光密度(OD)值,分別記為OD1、OD2。計算吞噬指數 K,K=(lgOD1-lgOD2)/270。第 2次內眥靜脈處采血1后,麻醉處死小鼠,立即取其胸腺和脾臟,除去表面污血,精密稱量小鼠胸腺、脾臟、肝臟質量,計算各臟器系數和校正吞噬指數α。胸腺系數(mg/g)=胸腺質量(mg)/體質量(g),脾臟系數(mg/g)=脾臟質量(mg)/體質量(g),α=體質量/(肝臟質量+脾臟質量)×K1/3。4)小鼠血清溶血素水平測定。藥物作用第4日,將0.2 mL綿羊紅細胞注射進小鼠腹腔。第10日給藥1后,從小鼠內眥靜脈處采血200 μL。2000 r/min離心10 min,取5 μL血清加入1 mL 0.9%氯化鈉注射液中 (稀釋200倍),混勻后加入0.5 mL 10%綿陽紅細胞(SRBC)懸液,再加入1 mL 10%豚鼠血清,室溫靜置10 min后冰浴10 min,2000 r/min離心10 min,以0.9%氯化鈉注射液校零,于540 nm處測定上層液OD值,另取0.25 mL 100 g/L SRBC,加入3.75 mL都氏試劑,同樣方法測定OD值,作為SRBC半數溶血值。計算小鼠血清半數溶血值 (HC50),可表示血清溶血素含量,HC50=小鼠血清吸光度/SRBC半數溶血值×稀釋倍數。5)蛋白印記(WB)法檢測OX40、OX40L蛋白表達水平。將小鼠結腸黏膜冷凍組織在液氮中研磨,加入1.2 mL蛋白裂解液(含protease inhibitor),提取總蛋白,BCA試劑盒測定蛋白總量。SDS-凝膠電泳后,半干轉印至PVDF膜上;5%脫脂奶粉,封閉1 h;分別加入一抗Anti-OX40、Anti-OX40L、Anti-GAPDH(1∶500),4 ℃孵育過夜;加入二抗(1∶5000),室溫孵育 1 h。 經化學發光法進行檢測,Tanon軟件拍攝圖像并進行半定量分析。1.6 統計學處理 應用SPSS 22.0統計軟件。計量數據以(±s)表示,兩兩比較采用t檢驗,多組間比較采用方差分析。P<0.05為差異有統計學意義。
2 結 果
2.1 各組小鼠疾病活動指數積分比較 見表1。正常組小鼠飲食、活動度、體質量及大便情況均正常,小鼠疾病活動指數積分為0。模型組小鼠表現出厭食、厭動、體質量減輕及稀水樣便等結腸炎病癥,小鼠疾病活動指數積分顯著升高。藥物處理10 d后,與模型對照組比較,SASP組及蘆薈多糖低、中、高劑量組小鼠結腸炎病癥顯著減輕,小鼠疾病活動指數積分顯著降低,蘆薈多糖高劑量組降低程度大于蘆薈多糖中劑量組 (均P<0.05)。
表1 各組小鼠疾病活動指數積分比較(分,±s)
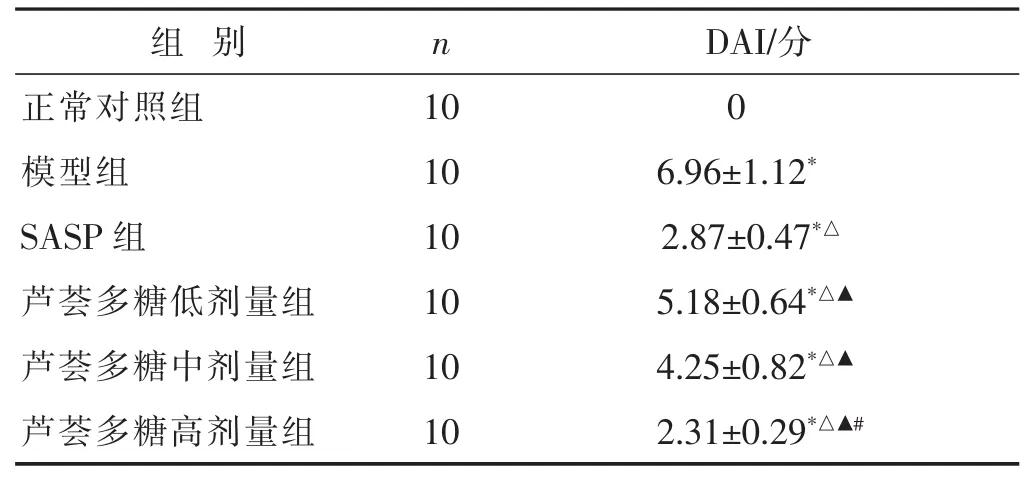
表1 各組小鼠疾病活動指數積分比較(分,±s)
與正常對照組比較,*P<0.05;與模型組比較,△P<0.05;與蘆薈多糖低劑量組比較,▲P<0.05;與蘆薈多糖中劑量組比較,#P<0.05。下同。
?
2.2 各組小鼠結腸黏膜組織結構比較 見圖1。正常對照組小鼠結腸黏膜組織結構完整、層次清晰、細胞排列規則有序、無炎性細胞浸潤;與正常對照組比較,模型組小鼠結腸黏膜組織細胞排列稀疏紊亂、上皮細胞大量缺失,可見大量炎性細胞浸潤;藥物作用10 d后,蘆薈多糖高、中、低劑量組小鼠結腸黏膜細胞組織結構逐漸恢復完整,細胞排列基本規則,可見少量炎性細胞。
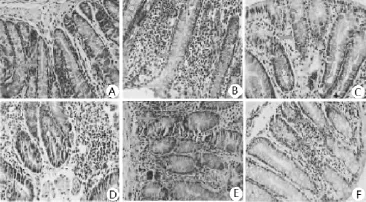
圖1 各組小鼠結腸黏膜組織形態結構的影響(HE染色,400倍)
2.3 各種小鼠免疫功能指標比較 見表2。與正常對照組比較,模型組小鼠胸腺系數、脾臟系數、吞噬指數 K、校正吞噬指數α、半數溶血值均明顯增高(P<0.05);藥物作用10 d后,與模型組比較,蘆薈多糖低、中、高劑量組小鼠胸腺系數、脾臟系數、吞噬指數K、校正吞噬指數α、半數溶血值均顯著降低(P<0.05),呈劑量依賴效應。
表2 各組小鼠免疫功能指標比較(±s)
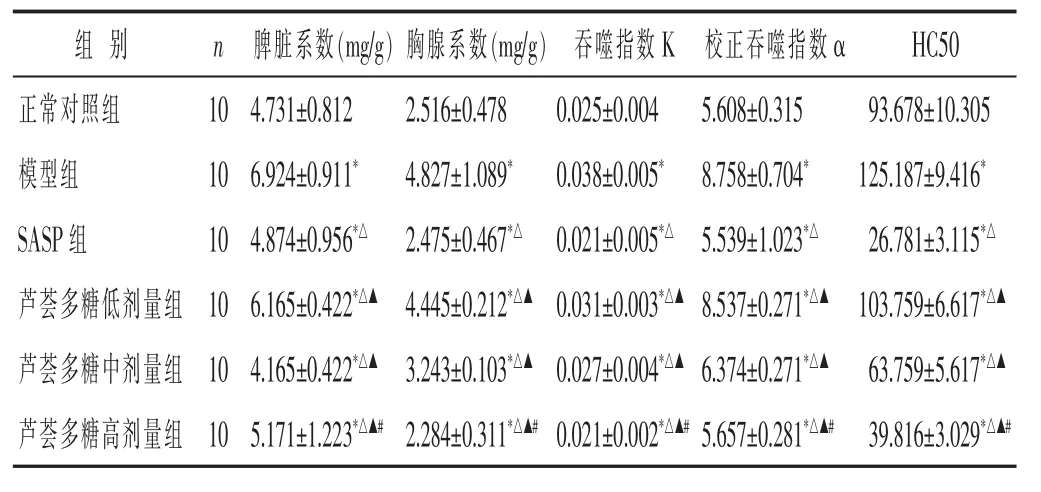
表2 各組小鼠免疫功能指標比較(±s)
?
2.4 各組小鼠結腸黏膜組織中OX40、OX40L蛋白表達比較 見圖2、表3。與正常對照組比較,模型組小鼠結腸黏膜組織中OX40、OX40L蛋白表達水平顯著升高(P<0.05);藥物作用10 d后,與模型組比較,低、中、蘆薈多糖高劑量組小鼠結腸黏膜組織中OX40、OX40L蛋白表達水平均顯著降低(P<0.05),呈劑量依賴效應。

圖2 各組小鼠結腸黏膜組織中OX40、OX40L蛋白表達水平
表3 各組小鼠結腸黏膜組織中OX40、OX40L蛋白表達比較(±s)

表3 各組小鼠結腸黏膜組織中OX40、OX40L蛋白表達比較(±s)
?
3 討 論
IBD發生時,機體腸道免疫作用處于過度激活狀態,黏膜組織分泌的促炎癥細胞因子增多,抗炎癥細胞因子相對較少,從而引起腸道免疫功能發生紊亂,導致炎癥因子在結腸等處累積,引起潰瘍性結腸炎的發生[8]。蘆薈多糖因其抗感染、促進損傷修復、提高免疫等藥理活性,已被證明對實驗性口腔潰瘍、實驗性結腸炎等炎癥性疾病具有治療作用[9-10]。本研究發現,造模期間,模型組小鼠表現出厭食、厭動、體質量減輕及稀水樣便等潰瘍性結腸炎病癥,疾病活動指數積分顯著升高。蘆薈多糖干預10 d后,與模型對照組比較,蘆薈多糖組小鼠腸炎癥狀明顯減輕,疾病活動指數積分顯著降低,表明蘆薈多糖具有治療潰瘍性結腸炎的功效。結腸黏膜HE染色結果顯示,蘆薈多糖可不同程度地減輕潰瘍性結腸炎小鼠結腸黏膜組織病理損傷,不同程度地改善炎性細胞浸潤情況,細胞排列逐漸規則,結腸黏膜結構趨于完整,表明蘆薈多糖對潰瘍性結腸炎小鼠結腸黏膜組織損傷具有一定保護作用,對結腸黏膜病變具有改善作用。
潰瘍性結腸炎是指結腸或直腸粘膜及黏膜下層發生炎癥性病變,導致患者出現體質量減輕、嘔吐、腹痛、便血等癥狀,目前認為是由于免疫、遺傳、感染及心理等多種因素相互作用的結果[11]。研究發現,腸道免疫調節異常在炎癥性腸病尤其是潰瘍性結腸炎的發生過程中具有重要作用,當機體受到細菌、病毒等感染后,腸道免疫作用過度激活[12]。胸腺是哺乳動物重要的中心免疫器官,免疫活性細胞在胸腺組織中產生、增殖、分化,發揮調節全身免疫反應等重要作用[13];脾臟則是重要的外周免疫器官,免疫細胞再此聚集,產生特異性抗體等活性物質,通過一系列免疫應答,清除外源病原物[14]。研究表明,動物臟器系數在一定程度上可反映該器官的生物學功能的強弱,血清中抗體含量則是衡量特異性免疫應答水平的直接指標[15]。本研究發現,模型組小鼠胸腺系數、脾臟系數、半數溶血值明顯高于正常對照組小鼠,蘆薈多糖作用后,低、中、蘆薈多糖高劑量組小鼠胸腺系數、脾臟系數、半數溶血值均顯著降低,呈一定劑量依賴效應。胸腺和脾臟系數的降低表明小鼠胸腺和脾臟免疫功能的降低,半數溶血值的降低表明小鼠血清中抗體含量的下降,提示蘆薈多糖具有減弱小鼠免疫功能、抑制腸道免疫過度激活的作用。巨噬細胞是負責吞噬和清除外源病原物的重要免疫活性細胞,其吞噬能力的強弱可反映非特異性免疫功能的強弱,一般采用巨噬細胞吞噬百分率來評價其吞噬能力[16]。本研究發現,與正常對照組比較,模型組小鼠吞噬指數K、校正吞噬指數α均明顯升高,與模型組比較,低、中、高劑量蘆薈多糖作用后小鼠吞噬指數K、校正吞噬指數α均顯著減小,呈劑量依賴效應,提示蘆薈多糖可抑制巨噬細胞的過度吞噬作用,抑制小鼠的非特異性免疫反應的過度激活。
有報道稱,IBD是一種自身免疫性疾病,其發生與腸道免疫反應紊亂有關,由Th1/Th2平衡被打破所致[17]。研究發現,潰瘍性結腸炎發生時,機體免疫細胞處于過度活化狀態,產生并釋放多種炎性因子,一系列的腸道免疫功能過度激活是造成IBD發生的原因之一[18]。OX40/OX40L是T細胞-抗原呈遞細胞應答過程中的一對重要的協同刺激分子,T細胞表面的OX40與抗原呈遞細胞表面的OX40L結合時,可將一個協同刺激信號傳遞給T細胞,進而促進細胞克隆,增強其效應功能,OX40主要作用于T細胞效應的晚期階段,可促進機體產生更多的記憶T細胞[19]。在疾病發生過程中,OX40只在炎癥浸潤部位的活化CD4+T細胞表面,OX40L則表達于炎癥浸潤部位的吞噬細胞、B細胞、樹突狀細胞等抗原呈遞細胞表面[20],因此OX40/OX40L表達水平可作為自身免疫應答反應的強弱,為臨床診斷和疾病治療提供一定參考。本研究發現,模型組小鼠結腸黏膜組織中OX40、OX40L蛋白表達水平均顯著高于對照組,不同劑量蘆薈多糖作用后,潰瘍性結腸炎小鼠結腸黏膜組織中OX40、OX40L蛋白表達水平顯著低于模型組,且呈一定劑量依賴效應,表明蘆薈多糖作用后OX40/OX40L表達水平下調,提示蘆薈多糖可能抑制T細胞-抗原呈遞細胞應答過程,抑制小鼠自身免疫反應的過度激活。
綜上所述,蘆薈多糖可能通過下調OX40、OX40L表達抑制T細胞-抗原呈遞細胞應答過程及免疫功能的過度激活,從而發揮對潰瘍性結腸炎所致結腸黏膜損傷的保護作用。
[1]Podolsky DK.Inflammatory bowel disease[J].N Engl J Med,2002,347(6):417-429.
[2]Burisch J,Munkholm P.Inflammatory bowel disease epidemiology[J].Curr Opin Gastroenterol,2013,29(4):357-362.
[3]劉玉暉,胡婕,易文鳳,等.參苓白術散治療炎癥性腸病與腸上皮細胞緊密連接的關系探討[J].中國實驗方劑學雜志,2015,21(3):130-133.
[4]張雙,高鷹,李黎仙,等.蘆薈提取物對脂多糖誘導的人牙周膜細胞炎性反應的抑制作用[J].實用口腔醫學雜志,2017,33(4):522-525.
[5]Tabandeh MR,Oryan A,Oryan A,et al.Polysaccharides of Aloe vera induce MMP-3 and TIMP-2 gene expression during the skin wound repair of rat[J].Int J Biol Macromol,2014,65(5):424-430.
[6]Dubuquoy L,Jansson EA,Deeb S,et al.Impaired expression of peroxisome proliferator-activated receptor gamma in ulcerative colitis[J].Gastroenterology,2003,124(5):1265-1276.
[7]Okayasu I,Hatakeyama S,Yamada M,et al.A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J].Gastroenterology,1990,98(3):694-702.
[8]Matsuoka K,Kanai T.The gut microbiota and inflammatory bowel disease[J].Semin Immunopathol,2015,37(1):47-55.
[9]王哲哲,張雪,高永峰.蘆薈多糖對實驗性口腔潰瘍大鼠NF-κB和MMP2表達的影響[J].中國藥理學與毒理學雜志,2017,31(5):483-484.
[10]張文志,歐水平,吳會超,等.蘆薈多糖對實驗性結腸炎大鼠腸黏膜的保護作用及其機制研究[J].實用醫學雜志,2016,32(3):352-355.
[11]Stecher B.The roles of inflammation,Nutrient availability and the commensal microbiota in enteric pathogen infection [J].Microbiol Spectr,2015,3(3):1128-1134.
[12]Cantorna MT,Mcdaniel K,Bora S,et al.Vitamin D,immune regulation,the microbiota, and inflammatory bowel disease[J].Exp Biol Med,2014,239(11):278-284.
[13]Luis TC,Luc S,Mizukami T,et al.Initial seeding of embryonic thymus by immune-restricted lympho-myeloid progenitors[J].Nat Immunol,2016,17(12):1424-1435.
[14]Jung WC,Levesque JP,Ruitenberg MJ.It takes nerve to fight back:The significance of neural innervation of the bone marrow and spleen for immune function[J].Semin Cell Dev Biol,2016,20(6):60-70.
[15]葉穎霞,林嵐,趙菊香,等.杜仲葉多糖對免疫抑制小鼠免疫功能的影響[J].中藥材,2015,38(7):1496-1498.
[16]Pennathur S,Pasichnyk K,Bahrami NM,et al.The macrophage phagocytic receptor CD36 promotes fibrogenic pathways on removal of apoptotic cells during chronic kidney injury[J].Am J Pathol,2015,185(8):2232-2245.
[17]Yang X,He Q,Guo Z,et al.MicroRNA-425 facilitates pathogenic Th17 cell differentiation by targeting forkhead box O1(Foxo1) and is associated with inflammatory bowel disease[J].BiochemBiophysResCommun,2018,496(2):352-358.
[18]Hisamatsu T,Kanai T,Mikami Y,et al.Immune aspects of the pathogenesis of inflammatory bowel disease[J].Pharmacol Ther,2013,137(3):283-297.
[19]Papadopoulos C,Terzis G,Papadimas GK,et al.OX40-OX40L expression in idiopathic inflammatory myopathies[J].Anal Quant Cytopathol Histpathol,2013,35(1):17-26.
[20]Kinnear G,Wood KJ,Fallah-Arani F,et al.A diametric role for OX40 in the response of effector/memory CD4+T cells and regulatory T cells to alloantigen[J].J Immunol,2013,191(3):1465-1475.

