胎膜早破時MONO、PMN含量與新生兒感染的關系研究
楊智輝 , 劉媛媛,劉 輝
1.北大醫療淄博醫院兒科(淄博 255069) ,2.山東省濟寧市第一人民醫院呼吸科(濟寧 272011)
胎膜早破指臨產前胎膜自然破裂,為臨產前常見病理現象,與感染、胎膜發育不良、宮腔內壓力異常、子宮頸功能不全、機械性刺激、創傷等因素密切相關[1]。流行病學調查發現若胎膜早破>24 h,可誘發新生兒敗血癥、多臟器功能損害、感染等,嚴重情況下危及母兒生命,而胎膜早破母體新生兒出生后感染率普遍高于足月正常分娩新生兒,其敗血癥、膿毒癥等感染率高達1%~10%[2],故早期發現感染并予以及時救治,對改善患兒預后具有重要意義。目前,常規感染預測指標C反應蛋白(C-reactive protein,CRP)、白細胞介素-6(Interleukin-6,IL-6)等對新生兒細菌感染具有較好的預測價值,但其靈敏度、特異度有所欠缺[3]。近年來,有報道稱[4]炎癥標志物可溶性髓樣細胞觸發受體-1(Triggering receptor expressed on myeloid cells-1,TREM-1)、中性粒細胞CD64(Leukocyte surface antigens CD64,CD64)對新生兒細菌感染具有較好的診斷意義,但關于臍血單核細胞計數(Monocyte count,MONO)、中性粒細胞(Polymorphonuclear neutrophil,PMN)表面TREM-1、CD64的表達水平預測胎膜早破母體新生兒感染鮮有報道。本文主要探究胎膜早破時MONO、PMN含量對新生兒感染的預測價值,報道如下。
資料與方法
1 一般資料 納入2014年8月至2017年8月于我院收治的110例足月胎膜早破新生兒為觀察組,其中男58例,女52例,胎齡37~40(38.40±0.75)周,新生兒體重3.5~5.2(3.40±0.25)kg;產婦年齡21~34(27.42±1.38)歲;新生兒評分(Apgar評分):1 min時為(9.75±0.52)分,5 min時為(9.90±0.35)分;并選取同期正常新生兒110例為對照組,其中男60例,女50例,胎齡38~40(38.68±0.45)周,新生兒體重3.7~5.4(3.52±0.27)kg;產婦年齡23~33(27.53±1.35)歲;Apgar評分:1 min時為(9.72±0.54)分,5 min時為(9.94±0.28)分。本研究獲我院醫學倫理委員會批準,兩組新生兒性別、胎齡、體重等一般資料比較差異無統計學意義(P>0.05)。納入標準:①符合《臨床婦產科學》[5]中相關診斷標準,伴陰道流液,經陰道窺器檢查發現羊水自宮頸口流出;微鏡下陰道液干燥涂片試驗可見羊齒狀結晶;石蕊試紙測測試pH>7;②單胎頭位妊娠,胎齡≥37周;③新生兒家屬對本研究知情且簽署同意書。排除標準: ①新生兒合并先天性免疫缺陷、先天性發育畸形、代謝障礙等疾病;②巨大兒或極低體質量新生兒;③產婦伴臨床細菌感染、先天性心臟病或HPV感染陽性者。
2 研究方法
2.1 儀器與試劑:采用北京時代北利離心機DT5-1型(北京時代北利有限公司),FACScalibur型流式細胞儀、溶血素均購自美國Becton Dickinson公司,酶標儀為美國Bio-Rad公司產品,37℃恒溫箱、微量加樣器、真空采血管(EDTA-K2抗凝)均源自德國Hereaus公司,TREM-1-PE單克隆抗體、CD45-Krome Orange單克隆抗體、CD64 PerCp-CY 5.5單克隆抗體、IgG1 Krome Orange、IgG1-PE、IgG1 PerCp-CY 5.5均購自美國Becton-Dickinson公司。
2.2 臍血標本采集:待新生兒娩出后采集EDTA抗凝臍靜脈血3 ml,即刻送至流式細胞實驗室待測。準備測定管與同型對照管,每管保持100 μl,將TREM-1-PE、CD45-Krome Orange、CD64 Per Cp-CY 5.5(均為10 μl)分別置入測定管中,并將IgG1-PE、IgG1 Krome Orange、IgG1 PerCp-CY 5.5(均為10 μl)分別置入同型對照管中。送至室溫孵育,維持20 min后添加溶血素,待振蕩混勻處理后送至室溫,待孵育10 min后加入無鈣離子PBS緩沖液3 ml,按照1500 r/min速度離心5 min。棄上清后將細胞懸浮于0.5 ml無鈣離子PBS緩沖液中,振蕩混勻于30 min內予以上機檢測。注意每個樣本獲取≥10000個目標細胞,應用Kaluza軟件予以數據分析。
2.3 胎盤標本采集:待胎盤盤娩出后留取胎膜組織、大小胎盤(約1cm×1cm),立即將標本置入4%多聚甲醛固定。待固定處理后予以脫水、浸蠟、石蠟包埋、切片處理,注意切片厚度維持5 μm。由3名經過系統培訓的檢驗醫師行雙盲法閱片,判斷是否為絨毛膜羊膜炎。絨毛膜羊膜炎診斷標準:參考《臨床婦產科學》[5],當胎膜或胎盤任何一處中性粒細胞浸潤每高倍視野≥11個即可確診。
2.4 外周血炎癥指標檢測方法 : 嚴格參考《全國臨床檢驗操作規程》,由3名經過專業培訓的檢驗醫師應用酶聯免疫法(Enzyme-Linked Immunosorbent Assay,ELISA)檢測血清CRP、IL-6、降鈣素原(Procalcitonin,PCT)、血小板計數(Peripheric platelet count,PLT),并采用全自動血細胞分析儀檢測外周血白細胞計數(White blood cell,WBC)。
2.5 TREM-1、CD64表達水平檢測方法:由3名通過專業培訓的檢驗醫師嚴格參照《全國臨床檢驗操作規程》,采用雙抗體夾心法與流式細胞術檢測TREM-1、CD64水平,比較MONO表面TREM-1 MFI比值、MONO表面CD64 MFI比值、PMN表面TREM-1 MFI比值、PMN表面CD64 MFI比值。
3 觀察指標 觀察兩組外周血炎癥指標變化,包括CRP、IL-6、WBC、PLT,并分析胎盤病理診斷結果、新生兒感染情況及臍血TREM-1、CD64表達水平。新生兒感染診斷標準:參考《實用新生兒學(第4版)》[6],DNA或病原菌抗原檢測呈陽性;非特異性檢查≥2條:①于新生兒出生2 h后采血,WBC減少<5×109/L,或增多(其中>3 d者WBC>20×109/L,<3d者WBC>25×109/L);②桿狀核細胞/中性粒細胞比值≥0.16;③炎癥發生6~8 h后CRP明顯升高;④微量血沉≥15 mrn/lh;⑤PLT≤100×109/L。存在感染臨床表現且具備以上任意一條即可確診。

結 果
1 兩組外周血炎癥指標比較 觀察組CRP、WBC、PLT、IL-6、PCT水平較對照組顯著升高(t=12.595、3.043、4.446、106.043、13.265,P=0.000、0.003、0.000、0.000、0.000),見表1。
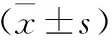
表1 兩組外周血炎癥指標比較
2 兩組胎盤病理診斷結果與新生兒感染率比較 經胎盤組織病理診斷發現,觀察組絨毛膜羊膜炎發生率為34.55%,對照組為11.82%,差異有統計學意義(χ2=14.702,P=0.000);于產后1周(圍產兒期)內,觀察組新生兒感染率為22.73%(25/110),對照組為6.36%(7/110),差異有統計學意義(χ2=11.848,P=0.001),見表2。
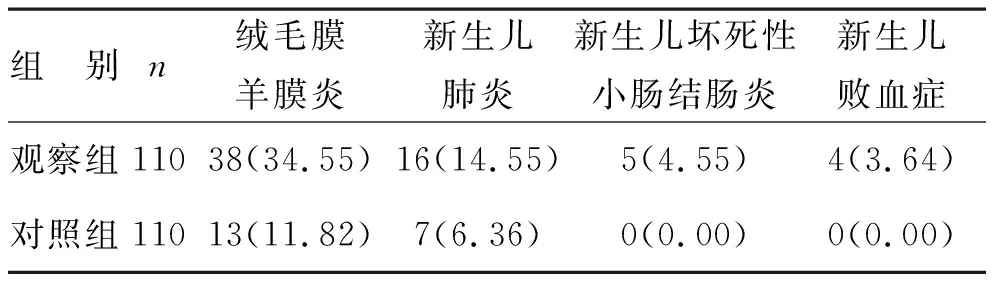
表2 兩組胎盤病理診斷結果與新生兒感染率比較[例(%)]
3 兩組臍血TREM-1、CD64表達水平比較 觀察組臍血MONO、PMN表面TREM-1、CD64 MFI比值顯著高于對照組(t=14.888、8.345、11.919、35.767,P=0.000、0.000、0.000、0.000),見表3。
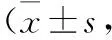
表3 兩組臍血TREM-1、CD64表達水平比較%)
4 感染組與未感染組TREM-1、CD64表達水平比較 感染組臍血MONO、PMN表面TREM-1、CD64 MFI比值顯著高于對照組(t=2.064、2.452、2.007、2.148,P=0.041、0.016、0.047、0.034),見表4。
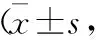
表4 感染組、未感染組臍血TREM-1、CD64表達比較%)
討 論
有報道稱新生兒,尤其是早產兒,其免疫系統發育尚未完全成熟,免疫功能并不完善,感染風險較高,嚴重情況下會出現膿毒血癥,具有較高的病死率[7]。伴隨著臨床診療技術的不斷發展,譬如各種內鏡檢查、穿刺、導管插管留置、透析療法等在臨床得到了廣泛應用,但新生兒感染發病率未明顯下降。目前,國內外檢測技術較為成熟,外周血血常規、CRP、IL-6、PCT等炎癥檢測指標在新生兒感染性疾病早期診斷中得到了廣泛推廣。
本文研究結果顯示,觀察組CRP、WBC、PLT、IL-6、PCT 水平較對照組明顯升高,絨毛膜羊膜炎、產后1周(圍產兒期)內新生兒感染率明顯高于對照組,證實早期新生兒感染時上述外周血炎癥指標異常升高,易誘發病原菌經臍帶血侵入圍生兒機體,致使新生兒感染。CRP為感染預測及監控的急性時相反應蛋白,正常狀況下其水平較低,一旦機體遭受傷害性刺激或微生物侵入時,于短時間內該因子大量合成并釋放入血,待感染消退后逐漸恢復正常水平[8]。有報道稱IL-6與多種病原微生物、細菌、病毒等誘發的機體感染密切相關,一旦遭受病原微生物侵入即可激活轉化為蛋白,刺激IL-6基因啟動因子,促使其表達水平異常激活,誘發促炎癥反應[9]。黃麗嬌等[10]報道胎膜早破患者逆行宮內感染能誘導血CRP、IL-6水平明顯上升,一定程度上會促使炎癥反應加重。此外,對于宮內感染的胎膜早破患者來講,胎兒遭受病原微生物侵入的風險較高,而胎兒娩出后新生兒感染風險隨之升高,故胎膜早破外周血CRP、IL-6對新生兒感染存在一定預測價值。WBC計數為臨床感染鑒別常用指標,但部分新生兒感染WBC計數無明顯變化,單一依據WBC計數診斷是否出現感染,其結果準確性欠佳。PCT屬于降鈣素前肽物質,為一種無激素活性糖蛋白,由116個氨基酸組成,正常生理狀況下由甲狀腺C細胞形成,血漿內含量較低,細菌感染時會由甲狀腺以外組織大量產生,PCT水平異常升高,這與本文結論吻合[11]。
此外,本研究發現觀察組臍血MONO、PMN表面TREM-1、CD64 MFI比值明顯高于對照組,且感染組上述指標較對照組明顯升高,證實胎膜早破及新生兒感染與臍血TREM-1、CD64表達水平密切相關,而胎膜早破>24 h,臍血PMN、MONO表面TREM-1、CD64表達可能被激活,CD64、TREM-1參與了胎膜早破與新生兒感染的炎癥反應過程。TREM-1屬于免疫球蛋白超家族中重要成員,可在成熟單核細胞、CD14+單核/巨噬細胞、中性粒細胞等髓系細胞中表達,為炎癥反應上游因子。作為先天免疫效應細胞模式識別受體,當機體遭受病原微生物侵入后基于TREM-1刺激下可觸發并放大級聯反應與宿主反應,利用TREM-1表達水平能對機體感染嚴重程度進行判斷,具有放大、激發炎癥反應,并可促進抗炎因子下調[12]。有研究證實,伴隨著細胞因子的參與與炎癥反應的逐漸加劇,會促使機體出現急性失控性炎癥反應,引起早期新生兒感染,這與本研究結果相符,證實臍血TREM-1對胎膜早破是否并發早期新生兒感染進行預測[13]。CD64屬于免疫球蛋白IgG Fc段受體1,于MONO、樹突狀細胞、巨噬細胞表面分布,對IgG單體的親和力較高,能對免疫球蛋白進行識別,并依次作用于介導細胞免疫與體液免疫過程,調控二者平衡。正常狀況下,CD64于PMN表面呈低表達,機體感染下PMN表面CD64 表達呈明顯升高趨勢。近年來,有研究發現新生兒感染與母血、胎盤組織、羊水中CD64表達升高有關,在胎膜早破孕產婦中,尤其是針對宮內感染者,中性粒細胞表面CD64被異常激活,呈高度表達,故其對孕產婦早期感染與新生兒感染中存在一定預測價值[14]。有報道稱胎膜早破孕產婦基于病原微生物侵襲下容易出現宮內感染,母血TREM-1、CD64水平呈過度表達,而病原微生物經臍血直接作用于胎兒,進一步增加了圍生兒感染風險,證實母血TREM-1、CD64表達水平與胎膜早破孕產婦新生兒存在明顯關聯,這與本文研究結論吻合。
本文雖證實胎膜早破及新生兒感染與臍血PMN、MONO表面TREM-1、CD64表達密切相關,但本文仍存在一些不足之處,如選取樣本量有限,可能存在抽樣誤差;于入院后即刻檢測母血CRP、PLT、IL-6、CD64、TERM-1等水平,關于其水平變化趨勢是否對新生兒感染產生影響仍需深入研究;胎膜早破發生孕周是否對結果產生影響,尚需大樣本數據進一步驗證
綜上所述,臍血PMN、MONO表面TREM-1、CD64表達對胎膜早破及新生兒感染具有預測價值,值得臨床積極推廣。
[1] 陳 虹, 鐘丹妮, 韋露明. 圍生期因素對早產兒出生后早期腎功能的影響[J]. 廣西醫科大學學報, 2016, 33(5):787-790.
[2] Vand MI, De JR, Duvekot J,etal. Maternal and Neonatal Outcomes ofPreterm Premature Rupture of Membranes before Viability[J]. Klinische Padiatrie, 2016, 228(2):69-76.
[3] Souza AS, Patriota AF, Guerra GV,etal. Evaluation of perinatal outcomes in pregnant women with preterm premature rupture of membranes[J]. Revista Da Associacao Medica Brasileira, 2016, 62(3):269-275.
[4] Sim WH, Araujo JE, Da SCF,etal. Maternal and neonatal outcomes following expectant management of preterm prelabour rupture of membranes before viability[J]. Journal of Perinatal Medicine, 2016, 45(1):29-44.
[5] 顧美皎. 臨床婦產科學[M].北京:人民衛生出版社, 2011:96-107.
[6] 邵肖梅. 實用新生兒學[M].4版.北京:人民衛生出版社, 2011:209-214.
[7] 宓秀菊, 趙淑云, 王敬彩,等. 2014年度新生兒感染流行病學調查研究[J]. 中華醫院感染學雜志, 2015, 25(17):4039-4040.
[8] 邵民坤, 周 燕, 杜 坤,等. 炎性指標聯合檢測在鑒別診斷新生兒感染中的臨床評價[J]. 中華醫院感染學雜志, 2016, 26(7):1639-1641.
[9] Boskabadi H, Maamouri G, Tavakkol A J,etal. Combination of Serum Interleukin-1I2and 6 Levels in the Diagnosis of Perinatal Asphyxia[J]. Archives of Iranian Medicine, 2016, 19(5):312-316.
[10] 黃麗嬌, 莊 暉, 劉麗明. 聯合檢測PCT、IL-6和CRP水平在預測未足月胎膜早破患者并發絨毛膜羊膜炎及新生兒敗血癥的臨床價值研究[J]. 中國婦幼保健, 2016, 31(17):3471-3474.
[11] Kordek A, Torbe A, Tousty J,etal. The Determination of Procalcitonin Concentration in Early-Onset Neonatal Infection[J]. Clinical Pediatrics, 2017, 56(4):333-340.
[12] Bosco MC, Raggi F, Varesio L. Therapeutic Potential of Targeting TREM-1 in Inflammatory Diseases and Cancer[J]. Current Pharmaceutical Design, 2016, 22(41)::6209-6233.
[13] Chan GJ, Lee AC, Baqui A H,etal. Prevalence of early-onset neonatal infection among newborns of mothers with bacterial infection or colonization: a systematic review and meta-analysis.[J]. BMC Infectious Diseases, 2015, 15(1):118-223.
[14] 張庭艷, 關瑞蓮, 梁 紅,等. 中性粒細胞CD64對新生兒感染早期判斷的研究[J]. 實用醫學雜志, 2016, 32(13):2205-2208.

