櫻桃病毒PNRSV、CGRMV、PDV多重RT-PCR檢測方法的建立與應用
周登攀, 郝小軍, 向本春
(石河子大學農學院/新疆綠洲農業(yè)病蟲害治理與植保資源利用自治區(qū)普通高校重點實驗室,新疆石河子 832003)
櫻桃種植業(yè)素有“黃金種植業(yè)”之稱,已成為我國近年來果樹產業(yè)結構調整的重要樹種,櫻桃栽培面積和總產量逐年增長,目前在山東、遼寧、河北、北京、山西、江蘇、安徽、河南、甘肅、新疆等地均有栽培種植[1]。隨著櫻桃栽培規(guī)模不斷擴大,病毒病日益加重,已成為制約櫻桃種植產業(yè)發(fā)展及櫻桃產量、品質的主要因素[2]。可以侵染櫻桃的病毒達30多種,常見的約有20種[3-4],我國已報道的侵染櫻桃的病毒包括李屬壞死環(huán)斑病毒(prunus necrotic ring spot virus,簡稱PNRSV)、李矮縮病毒(prune dwarf virus,簡稱PDV)、櫻桃綠環(huán)斑駁病毒(cherry green ring mottle virus,簡稱CGRMV)、櫻桃病毒A(cherry virus A,簡稱CVA)、黃瓜花葉病毒(cucumber mosaic virus,簡稱CMV)、櫻桃壞死銹斑病毒(cherry necrotic rusty mottle virus,簡稱CNRMV)、蘋果褪綠葉斑病毒(apple chlorotic leaf spot virus,簡稱ACLSV)等12種病毒[5-11]。PNRSV和PDV屬于雀麥花葉病毒科(Bromoviridae)等軸不穩(wěn)環(huán)斑病毒屬(Ilarvirus),其中PNRSV是我國二類進境檢疫性有害生物[12];CGRMV屬于線形病毒科(Flexiviridae)凹陷病毒屬(Foveavirus),是在我國李屬植物中發(fā)現的一種新病毒[8]。目前,這3種病毒已成為侵染櫻桃較為普遍的病毒,不僅單獨危害櫻桃,表現出一定的癥狀,同時多種病毒常常復合侵染,引起櫻桃表現綜合癥狀,給櫻桃種植業(yè)帶來巨大的損失。因此,建立一種同時檢測這3種病毒的檢測方法十分必要。
目前,我國在對櫻桃病毒病病原的檢測方法主要有常規(guī)單重RT-PCR技術和酶聯免疫吸附測定(enzyme linked immunosorbent assay,簡稱ELISA)檢測。阮小風等利用單重 RT-PCR 技術對陜西、北京、大連、山東、河南等地區(qū)的甜櫻桃病毒病病原PNRSV、PDV、CGRMV、ACLSV、CVA、CNRMV等進行檢測[3,13-15];李青等利用ELISA法對北京地區(qū)櫻桃中PNRSV進行檢測[16]。然而這些方法往往只能對特定的某一種病毒的感染情況進行檢測,須要大量的重復工作,同時又會消耗大量的檢測試劑,單一病毒的RT-PCR檢測已經不能滿足檢測工作的需求。多重RT-PCR技術是在單重RT-PCR基礎上發(fā)展起來的一種檢測技術,不僅具有單重RT-PCR技術的優(yōu)點,且多重RT-PCR反應1次能同時快速檢測多種病原的優(yōu)點,能滿足生產上同時對多種病原進行檢測的要求。盡管2014年宗曉娟等建立了對PNRSV、PDV、櫻桃小果病毒2(Littie cherry virus-2,簡稱LChV-2)進行多重RT-PCR檢測的方法[17],但該方法并未對發(fā)病較為普遍的CGRMV進行多重RT-PCR檢測。因此,本試驗在前人研究的基礎上,對PNRSV、CGRMV、PDV等3種病毒多重RT-PCR檢測的方法進行研究,建立櫻桃這3種病毒特異、高效的多重 RT-PCR 檢測方法,以期對櫻桃大量樣品快速檢測以及櫻桃病毒病的防控等提供理論依據。
1 材料與方法
1.1 試驗材料
試驗材料為采自新疆八師石河子地區(qū)疑似病毒病癥狀的櫻桃葉片,以健康植株葉片為陰性對照。采集的樣品分別裝在不同的采集袋中,液氮速凍后置于-70 ℃冰箱中保存?zhèn)溆谩?/p>
RNA提取試劑盒(TransZolTMPlant)、TaqPCR酶及dNTPs Mix均購自TaKaRa公司;反轉錄試劑盒購自Thermo公司;瓊脂糖凝膠回收試劑盒、2 000 bp DNA marker均購自TransGen Biotech;其他化學試劑均為國產分析純級試劑。PCR引物合成及測序由北京華大科技有限公司完成。大腸桿菌DH5α菌株由筆者所在實驗室保存。
1.2 試驗方法
1.2.1 植物組織總RNA的提取 在單一RT-PCR中,分別稱取0.1 g感染病毒的葉片置于經高溫滅菌處理的研缽中,加液氮磨成粉末;在多重RT-PCR中稱取等量的分別感染3種病毒的櫻桃葉片置于處理過的研缽中,加液氮研成粉末;用RNA提取試劑盒提取總RNA,最后用35 μL RNase free H2O溶解提取的總RNA。
1.2.2 引物設計 根據GenBank中PNRSV(FR773524.2)、CGRMV(AJ291761)、PDV(KF718661.1)的基因組序列,應用Primer 5.0軟件分別設計3種病毒的特異性引物PNRSV-F/R、CGRMV-F/R、PDV-F/R。引物設計時盡可能保證各檢測引物退火溫度一致。引物序列的詳細信息見表1。
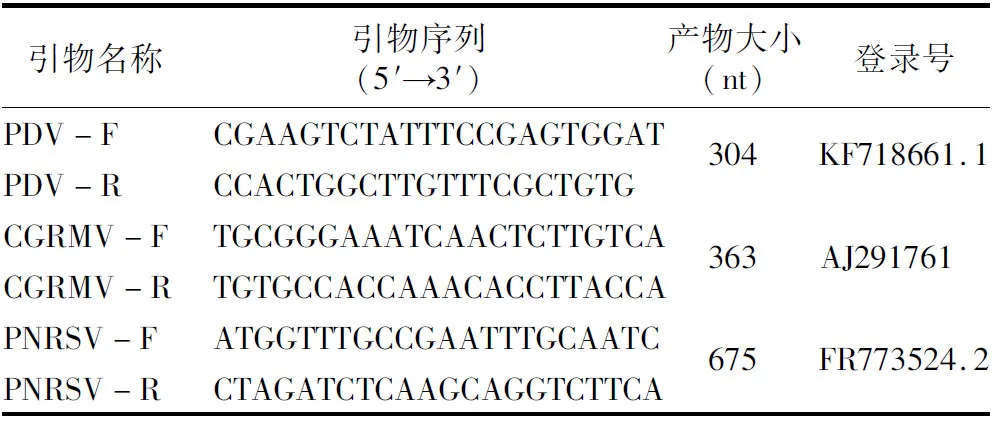
表1 RT-PCR法擴增病毒基因組特異性片段的引物
1.2.3 單重RT-PCR反應 cDNA第1鏈的合成:以5 μL提取的材料總RNA為模板、1 μL Oligo(dT)18為引物、1 μL隨機六聚體引物、1 μL無核酸酶的高純水輕輕混勻,65 ℃孵育5 min,迅速在冰上冷卻2 min,加入10 μL 2×ES Reaction Mix、1 μL gDNA Remover、1 μL RT Enzyme Mix,輕輕混勻,25 ℃ 孵育10 min后42 ℃孵育30 min,85 ℃加熱5 s終止反應,-20 ℃保存?zhèn)溆谩?/p>
PCR反應:以合成的cDNA第1鏈為模板進行PCR,選用表中各引物分別檢測甜櫻桃樣本中的3種病毒。25 μL反應體系:2.5 μL cDNA、2.5 μL 10×PCR buffer、1 μL dNTPs(2.5 mmol/L)、1 μL特異性引物(10 μmol/L)、0.3 μLTaqDNA聚合酶(5 U/μL),加16.7 μL ddH2O至終體積為 25 μL。PCR擴增條件:94 ℃預變性5 min;94 ℃變性30 s,50~64 ℃退火30 s(溫度根據引物設定),72 ℃延伸50 s,35個循環(huán);72 ℃延伸10 min,4 ℃保存。PCR產物用1.2%瓊脂糖凝膠電泳,用凝膠成像系統(tǒng)觀察結果并照相。PCR反應在擴增儀上進行。
1.2.4 多重RT-PCR 選取混合提取的3種病毒的總RNA,用隨機引物反轉錄成的cDNA第1鏈作為多重 RT-PCR 反應的模板。在同一個PCR反應體系中同時加入3種病毒引物組合,進行PCR反應。選用50 μL反應體系:10 μL cDNA 模板,加ddH2O至終體積為50 μL,其他條件與單重 RT-PCR 相同。
1.2.5 PCR產物的克隆、測序及分析 PCR擴增片段經回收純化后,連接至pMD18-T載體中,轉化大腸桿菌DH5α菌株后,通過菌落PCR以及酶切驗證的陽性克隆,送至北京華大科技有限公司進行測序。利用GenBank數據庫中的Blast程序對測序結果進行相似性檢索(http://blast.ncbi.nlm.nih.gov/Blast.cgi),序列分析采用DNAMAN軟件。
1.2.6 多重RT-PCR檢測方法的實際應用 從新疆石河子地區(qū)采集122份櫻桃病樣葉片,按照上述多重RT-PCR方法對部分樣品進行多重RT-PCR檢測,觀察并記錄試驗結果。
1.2.7 多重RT-PCR主要影響因素的優(yōu)化 在有效的多重RT-PCR條件下,采用單一變量法考察多重RT-PCR主要影響因素,考察某一影響因素時,其他因素不變。退火溫度分別設52、54、56、58、60、62、64、66 ℃等8個處理;dNTPs用量分別設0.1、0.2、0.4、0.6、0.8 mmol/L等5個處理;靈敏度分別設2、22、23、24、25、26倍等6個處理;循環(huán)數分別設25、30、35、40、45個循環(huán)等5個處理。
2 結果與分析
2.1 總RNA質量檢測
用RNA提取試劑盒可從櫻桃葉片上提取純度較高的總RNA,用微量核酸蛋白分析儀測量其D260 nm/D280 nm均在1.7~2.0之間,表明組織中蛋白質、多糖、多酚等物質基本去除,提取的RNA純度較理想,可用于后續(xù)研究。
2.2 單重RT-PCR驗證
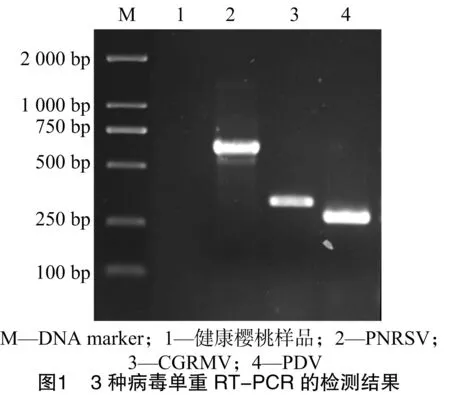
以設施櫻桃病株材料的反轉錄產物作為PCR反應的模板,采用單重RT-PCR技術對表中各對引物進行初篩。結果表明,引物PNRSV-F/R、CGRMV-F/R、PDV- F/R均能穩(wěn)定擴增出其各自的特異性片段,PCR產物經電泳觀察分別得到680、360、300 bp左右的條帶(圖1),每種病毒特異性引物擴增獲得的片段大小均與預期結果相同。
2.3 多重RT-PCR體系建立
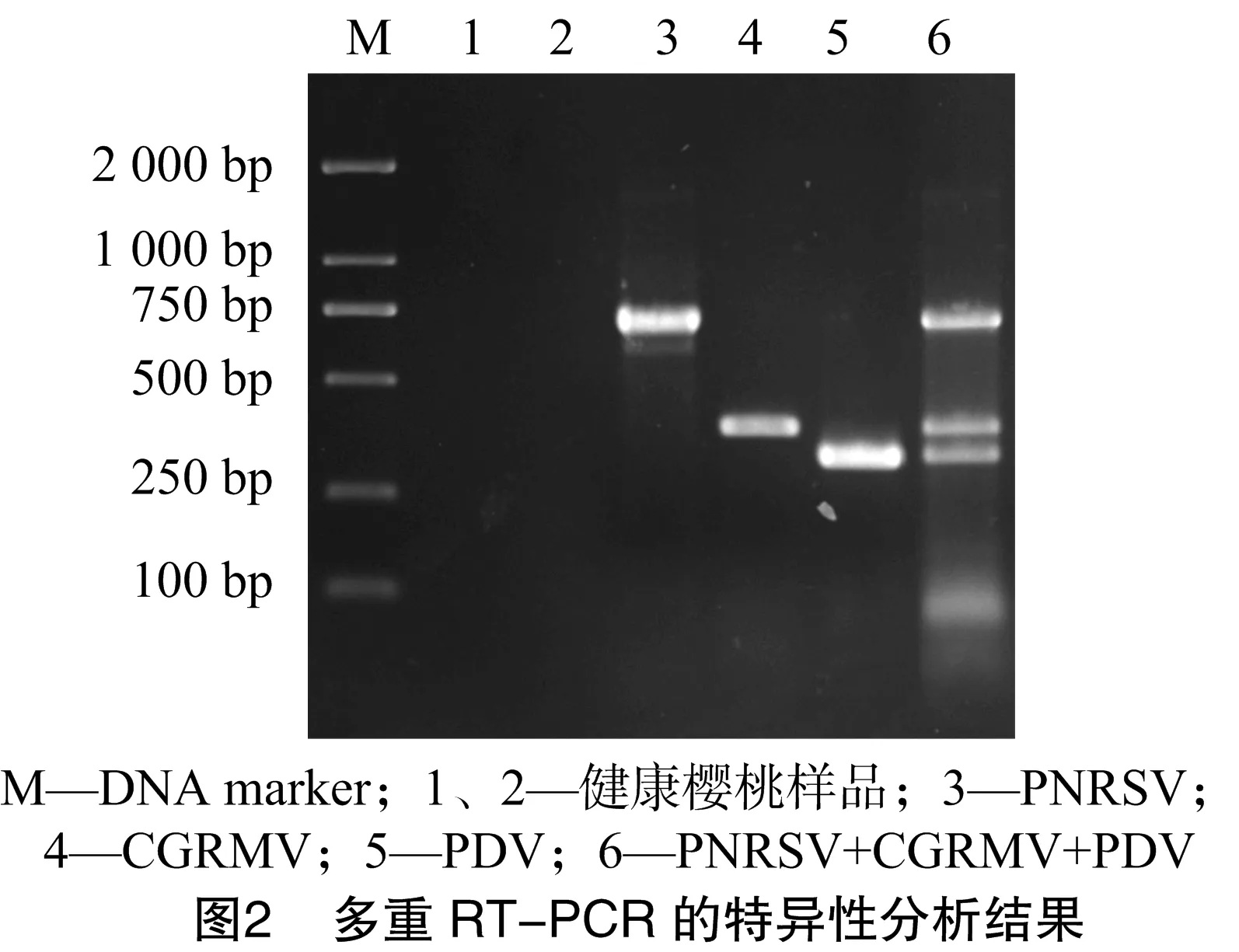
將混合提取的總RNA反轉錄的產物用于多重擴增PNRSV、CGRMV、PDV,結果能夠擴增出PNRSV(675 bp)、CGRMV(363 bp)、PDV(304 bp)目的條帶(圖2),與單重 RT-PCR 擴出的目的條帶一致,說明混合提取的3種病毒RNA的反轉錄產物能夠用于多重PCR的擴增;用相同的反轉錄產物及櫻桃健康葉片為樣本,對該引物組合多重RT-PCR擴增的特異性進行分析。由圖2可知,該引物組合均能特異性檢測出其各自的靶標病毒,擴出的各目的條帶與單重RT-PCR中各條帶的大小相同,而健康櫻桃樣品均未能出現特異性條帶,說明這3組引物組合可用于這3種病毒的多重 RT-PCR 檢測。
2.4 多重RT-PCR檢測體系優(yōu)化
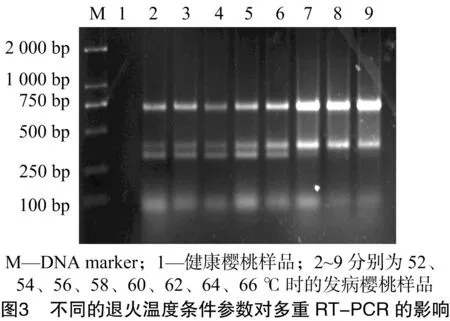
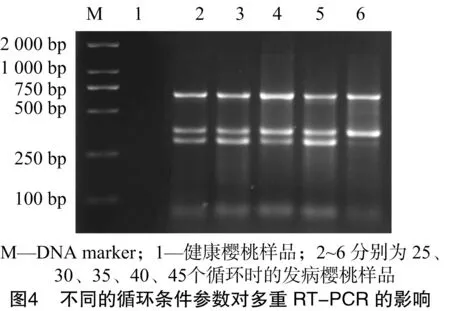
本研究對退火溫度和循環(huán)次數進行優(yōu)化,以相同稀釋濃度的發(fā)病櫻桃樣品的cDNA為模板,選擇不同的退火溫度及PCR擴增循環(huán)數對多重RT-PCR擴增條件進行優(yōu)化。由圖3可知,退火溫度為52~60 ℃條件下,均能進行特異性擴增,在58、60 ℃時條帶最亮;當退火溫度為62 ℃及以后時,PDV基本上不出現條帶,因此選擇最適退火溫度為58 ℃。由圖4可知,循環(huán)數對多重RT-PCR擴增的影響不大,25個循環(huán)即能達到檢測目的,隨著循環(huán)數的增加,擴增條帶的強度增加,但到45個循環(huán)時PDV不能擴增出條帶。為了兼顧檢測效率與擴增效果,實際操作時選擇35個循環(huán)。因此,多重 RT-PCR 的擴增條件最終選擇退火溫度為58 ℃,35個循環(huán)。
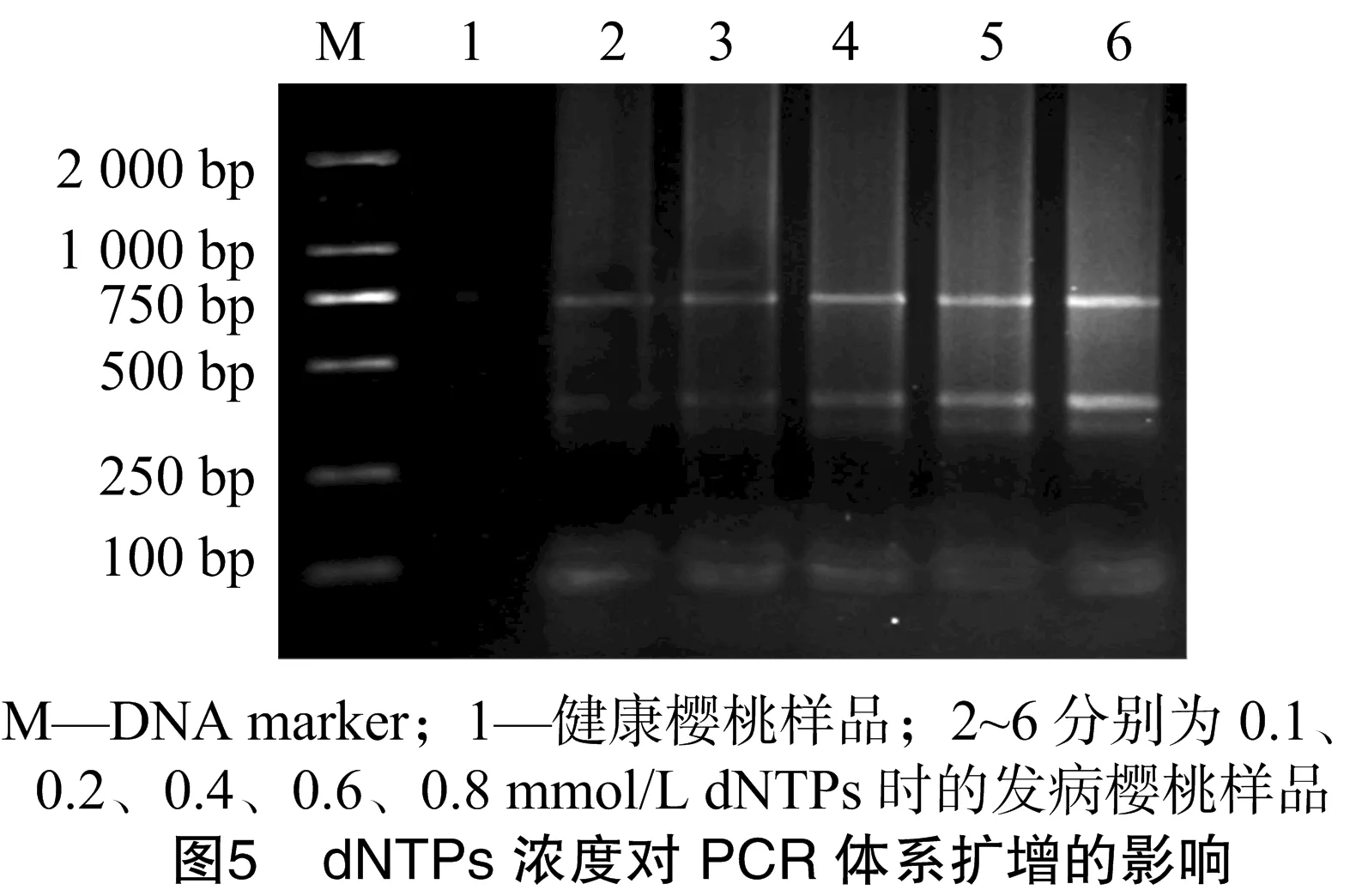
由圖5可知,當dNTPs的濃度在0.2~0.8 mmol/L時均能擴增出較好的條帶,對試驗結果影響不大,但0.4~0.8 mmol/L dNTPs可以產生較清晰明亮的條帶,因此優(yōu)化體系選擇dNTPs的濃度為0.6 mmol/L。
2.5 多重RT-PCR靈敏度的分析
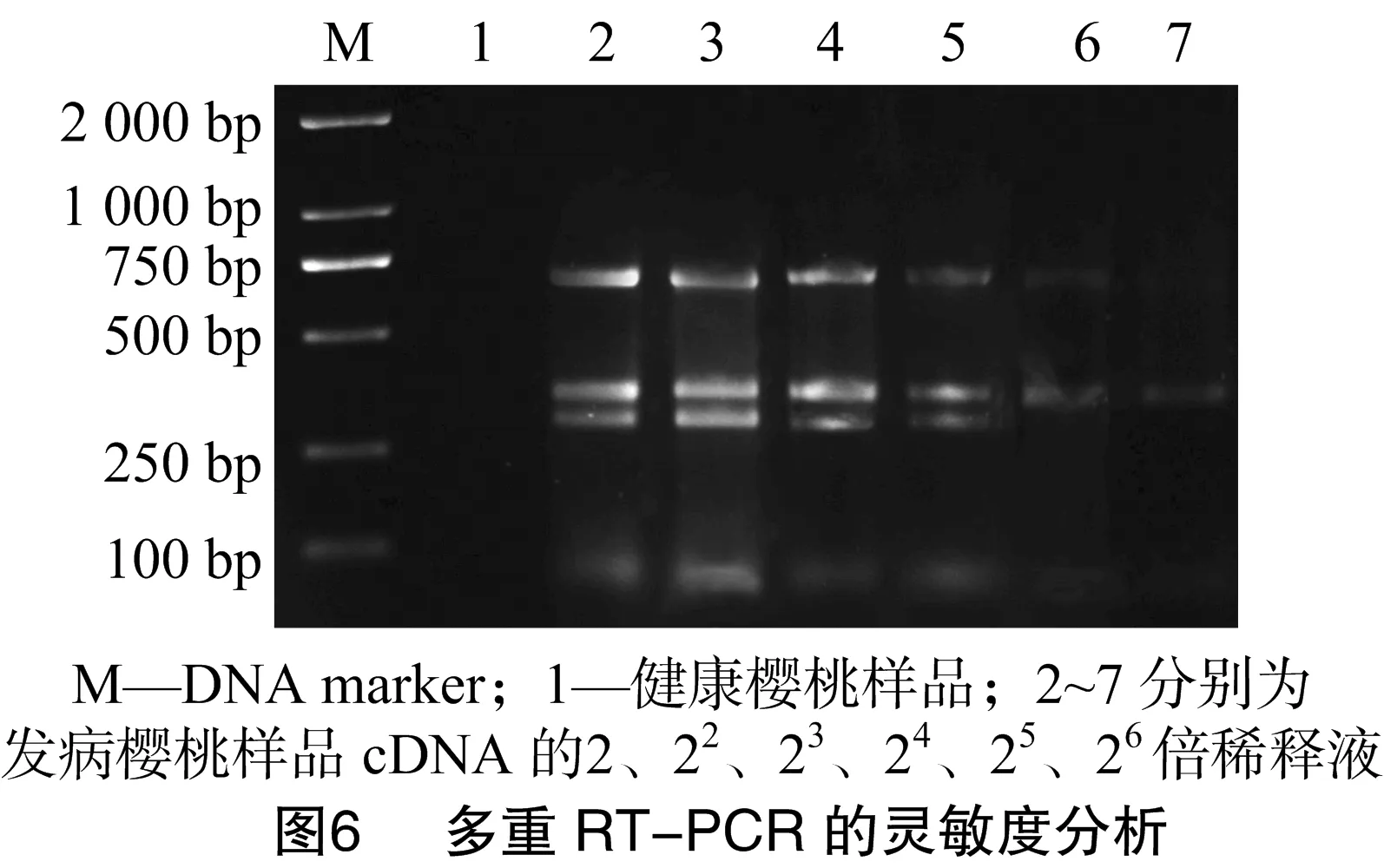
選取將混合提取的總RNA反轉錄產物為試驗樣本,采用紫外吸收法測定其初始濃度為958 ng/μL,將總RNA模板依次稀釋2、22、23、24、25、26倍,對靈敏度進行分析。由圖6可知,引物組合在稀釋24倍的cDNA中仍能特異性擴增,但引物PNRSV-F/R擴增出的條帶較微弱。稀釋24倍后,PNRSV、CGRMV的條帶很弱,引物組合幾乎檢測不到病毒條帶。因此,引物組合對植物cDNA的最低檢測濃度為 59.7 ng/μL。
2.6 擴增產物的測序結果及序列分析
將多重RT-PCR擴增的特異性條帶分別進行凝膠回收,純化后連接至pMD18-T載體,挑取陽性克隆測序。結果顯示,PNRSV、CGRMV、PDV的擴增產物分別由675、363、304個核苷酸組成,與預期產物大小相同,與GenBank中已報道的病毒分離物的核苷酸序列同源性分別為91%~99%、91%~99%、90%~99%,這證明了多重RT-PCR檢測結果的可靠性。
2.7 應用多重RT-PCR技術檢測新疆石河子地區(qū)櫻桃?guī)Ф厩闆r
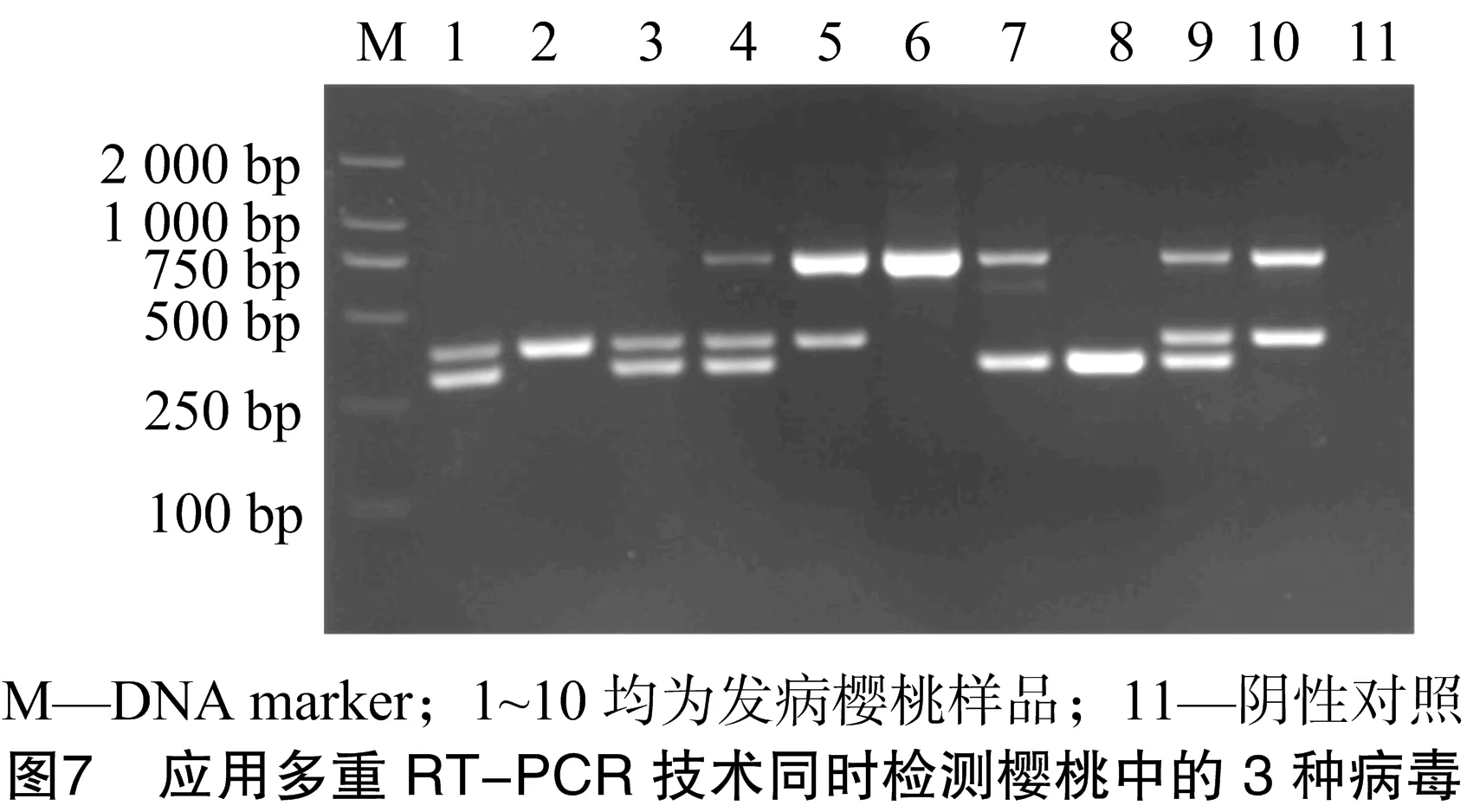
利用優(yōu)化后的多重RT-PCR體系對采集的櫻桃田間樣品進行檢測。由圖7可知,10個樣品均呈陽性,且多存在復合侵染;其中有3個樣品只感染1種病毒,樣品2感染CGRMV,樣品6感染PNRSV,樣品8感染PDV;有5個樣品感染2種病毒,樣品1、樣品3均感染CGRMV、PDV,樣品5、樣品10均感染PNRSV、CGRMV,樣品7感染PNRSV、PDV;樣品4和樣品9復合感染3種病毒。
3 結論與討論
近年來櫻桃栽培在我國發(fā)展較快,栽培面積不斷擴大以及栽培中的苗木引種和調運、無性繁殖代數增多等因素,加快了櫻桃病毒病的傳播。目前,櫻桃病毒病在我國已廣泛發(fā)生。苗木引種、病毒的檢測一直是檢疫系統(tǒng)的難點。由于病毒在木本植株體內的含量低、分布不均且具有復合侵染的特性[12],在檢疫工作中會出現漏檢、誤檢等現象。分子生物學可以有效解決這一難題,PCR方法靈敏度高,對含量較低的靶標病毒一般也不會出現漏檢情況,且對擴增產物進行測序,又能有效避免錯檢發(fā)生。多重RT-PCR在單一RT-PCR基礎上發(fā)展而來,具有快速、簡便、靈敏的特點。自1988年Chamberlain等首先將多重RT-PCR技術用以診斷杜氏肌營養(yǎng)不良征[18]以來,多重RT-PCR技術已被廣泛應用于煙草[19]、菊花[20]、葡萄[21]等作物及園藝植物的病毒檢測中。雖然宗曉娟等利用多重RT-PCR技術檢測了PNRSV、LChV-2、PDV等3種甜櫻桃病毒[17],但新疆地區(qū)尚未發(fā)現用多重 RT-PCR 技術檢測櫻桃病毒。PNRSV是一種世界范圍內分布的病毒,是我國二類進境檢疫性有害生物[12]。PDV、CGRMV雖未列入其中,但在我國多地均有檢出,且常伴有復合侵染,嚴重影響了設施櫻桃的產量和品質,危害嚴重。因此,本研究通過單一RT-PCR進行引物特異性篩選,確定出適合多重RT-PCR反應的引物組合,即PNRSV-F/R、CGRMV-F/R、PDV-F/R,特異性、靈敏度及克隆測序分析結果證明,該方法可應用于櫻桃的樣品檢測。并通過多重 RT-PCR 條件的優(yōu)化,確定出最佳RT-PCR反應條件:退火溫度為58 ℃、35個循環(huán)、dNTPs濃度為0.6 mmol/L、最低檢測濃度為59.7 ng/μL。通過最適反應條件對新疆石河子周圍團場及葡萄研究所采集的部分櫻桃樣品進行檢測,結果表明該地區(qū)櫻桃?guī)Ф韭瘦^高,且多為復合侵染。該方法與常規(guī)的單一RT-PCR檢測方法相比,成本低、操作簡便、快速、適用于3種病毒單一或復合感染樣品的檢測。
本研究經過多次優(yōu)化試驗條件建立了可同時檢測PNRSV、CGRMV、PDV的多重RT-PCR方法,該方法穩(wěn)定、快速、準確、靈敏、檢測成本低,可應用于櫻桃毒害單一或復合侵染的同步檢測。對控制我國櫻桃病毒病的傳播、櫻桃病毒病的檢測和及時防治具有重要意義。
參考文獻:
[1]Rao W L,Zhang Z K,Li R. Frist report of cherry virus A in sweet cherry trees in China[J]. Plant Disease,2009,93(4):425.
[2]盧美光,吳 冰,高 蕊,等. 我國部分地區(qū)櫻桃病毒病害初步調查和病原檢測[J]. 植物保護,2015,41(1):98-103.
[3]劉聰利,李 明,趙改榮,等. 河南甜櫻桃病毒病害調查及病原檢測[J]. 植物保護,2016,42(4):200-204.
[4]王文文,宗曉娟,陳立偉,等. 中國甜櫻桃病毒病及其檢測技術研究進展[J]. 湖北農業(yè)科學,2012,51(18):3929-3933,3940.
[5]Isogai M,Aoyagi J,Nakagawa M,et al. Molecular detection of five cherry viruses from sweet cherry trees in Japan[J]. Journal of General Plant Pathology,2004,70(5):288-291.
[6]Zhou Y Y,Ruan X F,Wu C L,et al. First report of sweet cherry viruses in China[J]. Plant Disease,1996,80(12):1429.
[7]Tan H D,Li S Y,Du X F,et al. First report of cucumber Mosaic virus in sweet cherry in the People’s Republic of China[J]. Plant Disease,2010,94(11):1378.
[8]Zhou J F,Wang G P,Kuang R F,et al. First report of cherry green ring mottle virus on cherry and peach grown in China[J]. Plant Disease,2011,95(10):1319.
[9]Rao W L,Li F,Zuo R J,et al. First report of little cherry virus 2 in flowering and sweet cherry trees in China[J]. Plant Disease,2011,95(11):1484-1485.
[10]Zhou J F,Wang G P,Qu L N,et al. First report of cherry necrotic rusty mottle virus on stone fruit trees in China[J]. Plant Disease,2013,97(2):290-291.
[11]Lu M G,Gao R,Chen R R,et al. First report of little cherry virus 1 in sweet cherry trees in China[J]. Plant Disease,2015,99(8):1191.
[12]周灼標,鄭雷青,管 維,等. 用二重PCR方法檢測李痘病毒和李壞死環(huán)斑病毒[J]. 植物保護,2006,32(4):107-109.
[13]阮小鳳,楊 勇,馬書尚,等. 甜櫻桃病毒病的ELISA檢測研究[J]. 山東農業(yè)大學學報(自然科學版),1998,29(3):277-282.
[14]侯義龍,楊俊玲,李春敏. 李矮縮病毒RT-PCR方法建立及檢測應用[J]. 中國農業(yè)科學,2005,38(2):425-427.
[15]王文文,宗曉娟,王甲威,等. 環(huán)渤海灣地區(qū)甜櫻桃小果病毒及櫻桃病毒A的鑒定與調查[J]. 植物保護,2013,39(2):128-133.
[16]陳君幟,李 青. 李屬植物脫毒技術及病毒檢測研究進展[J]. 北京林業(yè)大學學報,2001,23(5):71-74.
[17]宗曉娟,王文文,魏海蓉,等. 3種甜櫻桃病毒PNRSV、PDV及LChV-2的多重RT-PCR檢測方法的建立與應用[J]. 中國農業(yè)科學,2014,47(6):1111-1118.
[18]Chamberlain J S,Gibbs R A,Ranier J E,et al. Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J]. Nucleic Acids Research,1988,16(23):11141-11156.
[19]Dai J,Cheng J,Huang T,et al. A multiplex reverse transcription PCR assay for simultaneous detection of five tobacco viruses in tobacco plants[J]. Journal of Virological Methods,2012,183(1):57-62.
[20]Song A,You Y,Chen F,et al. A multiplex RT-PCR for rapid and simultaneous detection of viruses and viroids in chrysanthemum[J]. Letters in Applied Microbiology,2013,56(1):8-13.
[21]裴光前,董雅鳳,張尊平,等. 4種葡萄卷葉伴隨病毒多重RT-PCR檢測[J]. 植物病理學報,2010,40(1):21-26.

