miR-34a-5p對HaCaT細胞增殖及其靶基因Notch1表達的影響
朱 杰 王慧琴 趙宗峰 張 慧 康曉靜 吳衛東
銀屑病是一種常見的慢性炎癥性皮膚病,是臨床表型、遺傳、環境和免疫因素相互作用的結果。四十多年的臨床和基礎研究闡明了銀屑病的許多潛在致病機制。目前已有研究證明miR-34a-5p參與細胞自噬和細胞衰老的調節[1-3],且miR-34a-5p及其靶基因Notch1在銀屑病皮損中的表達呈正相關性[4],然而miR-34a-5p對人角質形成細胞生物學性狀的影響尚不清楚,故本實驗在前期研究基礎上進一步驗證miR-34a-5p對HaCaT細胞增殖的影響,以及對靶基因Notch1調控情況的研究。
1 材料與方法
1.1 材料 miR-34a-5p模擬物、抑制物及SiRNA均有Qiagen公司設計合成,HaCaT細胞株(購自于上海富衡生物科技有限公司培養的銀屑病患者外周正常皮膚角質細胞),DMEM培養基,胎牛血清(德國Gibco公司),0.25%的胰酶,轉染試劑、RNA抽提試劑盒(均購于Qiagen公司),CO2培養箱,倒置顯微鏡,熒光定量PCR儀。
1.2 實驗方法
1.2.1 細胞培養 用含有10%胎牛血清的DMEM培養基培養HaCaT細胞,待HaCaT細胞生長至80%~90%融合時,用胰酶將培養的細胞制備成單細胞懸液,用于后續實驗。
1.2.2 優化轉染試劑濃度 如表1配置3組轉染復合物,轉染后2 h在倒置熒光顯微鏡下觀察轉染前后細胞的死亡率、轉染效率,選出最佳轉染濃度。

表1 根據SiRNA選擇最佳轉染試劑濃度
1.2.3 MTT(CCK-8試劑)檢測轉染后HaCaT細胞的增殖活力 制備HaCaT單細胞懸液1.5~3.5×104/mL,每孔200 μL接種于96孔培養板,置37℃、5% CO2培養箱培養,細胞貼壁后,根據優化的轉染試劑濃度分5組進行轉染:mimic組、NC組、inhibitor組、inhibitor NC組、空白對照組(只添加培養基),每組設6個復孔,分別培養6、24、48、72 h后終止培養。避光條件下每孔加入CCK-8溶液20 μL,繼續孵育2 h,在酶標儀上測定450 nm波長處的吸光度值(OD值),實驗重復3次,以時間為橫坐標,OD值為縱坐標,繪制生長曲線并計算細胞增殖活力,細胞活力=(處理組-空白對照組)/(NC組-空白對照組)×100%。
1.2.4 提取細胞總RNA 共設4組進行轉染,即mimic組,NC組,inhibitor組,inhibitor NC組。根據優化的轉染濃度配置轉染復合物進行轉染,轉然后48 h,用miRNeasy Mini kit分別抽提4組細胞的總RNA。
1.2.5 反轉錄熒光定量(RT-qPCR) 根據miScript-II-RT-Kit-EN-反轉錄試劑盒說明書,將4組RNA分別反轉錄成cDNA,每組設置三個復孔,以GAPDH為內參擴增Notch1.通過PCR儀的系統軟件得出內參基因和目的基因的Ct值,再計算出4組的△Ct值,△△Ct值以及2-△△Ct,比較4組間基因表達的差異。
2 結果
2.1 miR-34a-5p對人HaCaT細胞活力的影響 MTT法檢測結果表明,與轉染空白對照組相比,在不同時間點不同濃度的mimic組MTT實驗OD值均有升高,轉然后48 h,mimic組、inhibitor組、inhibitor NC組HaCaT細胞的增殖活力分別為:39.7%、15.7%、20.7%,與NC組(21.3%)相比,差異有統計學意義(P<0.05)。實驗結果顯示轉然后mimic組HaCaT細胞增殖活力明顯增強,inhibitor組HaCaT細胞增殖活力下降,NC組和inhibitor NC組HaCaT細胞增殖活力與空白對照組相比無明顯變化。
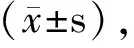

a:轉染前 b:轉染后2小時 c:轉染后2小時熒光顯微鏡下
根據圖a和圖b比較轉染前后死亡細胞數,評估細胞死亡率<10%,根據圖b和圖c比較轉染后普通顯微鏡及熒光顯微鏡下轉染成功細胞數,評估轉染效率>75%,故當轉染試劑為3 μL時,即可達最優轉染效率。
圖1 HiPerFect Reagent 3 μL時,轉染前后細胞情況

表2 轉染后各組Notch1的表達量
3 討論
最新的研究表明銀屑病有一個特定的miRNA表達譜,miRNA-217、181 b、146 a等均參與銀屑病發生發展的調控[5-7]。本課題組前期研究顯示與正常皮損相比miRNA-34a在銀屑病皮損組織中表達增高,表現為表皮全層高表達[4]。miRNA-34a通過次氮基三乙酸鐵誘導氧化應激促進癌組織中血管再生,且miRNA-34a有促進細胞增殖的作用[8],這與銀屑病皮損中血管迂曲擴張、細胞過度增殖的特點相一致,并與本實驗結果相符。本實驗結果表明,轉染了miRNA-34a-5p mimic的HaCaT細胞增殖活力明顯增強,轉染了miRNA-34a-5p inhibitor的HaCaT細胞增殖活力明顯下降,兩組與NC組相比差異有統計學意義(P<0.05),提示miRNA-34a-5p能促進HaCaT細胞增殖。
Notch1是miRNA-34a-5p靶基因之一。參與調控細胞的基因調控機制,包括細胞命運決定、干細胞維持、增殖、分化和存活[9,10]。文獻報道Notch1在正常組織和銀屑病皮損中均有表達,但在銀屑病皮損中表達更高,Notch1在細胞核表達可以加劇銀屑病惡化[11]。故Notch1參與銀屑病發生發展的調控。本實驗結果顯示,HaCaT細胞轉染后,mimic組和inhibitor組Notch1表達量分別為2.78±1.30和0.37±0.46,與NC組相比,差異有統計學意義(P<0.05)。由此推測miRNA-34a-5p參與對Notch1的調控作用,miRNA-34a在人HaCaT細胞中有上調Notch1的作用。綜上所述,miRNA-34a可促進人HaCaT細胞增殖,上調Notch1 mRNA表達,故miRNA-34a促進HaCaT細胞增殖的機制可能與Notch1表達上調有關。
由此推測,下調miRNA-34a-5p以抑制下游靶基因Notchl表達,可能對銀屑病的發展過程有一定的抑制作用。以miRNA-34a-5p為靶點來進行研究,有望為尋常型銀屑病的發病機制及治療的研究提供一個新的思路,為本課題組進一步的研究奠定了基礎。
[1] Bernard A, Klionsky DJ. Defining the membrane precursor supporting the nucleation of the phagophore[J]. Autophagy,2014,10(1):1-2.
[2] Wiggins JF, Ruffino L, Kelnar K, et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34[J]. Cancer Res,2010,70(14):5923-5930.
[3] Lodygin D, Tarasov V, Epanchintsev A, et al. Inactivation of miR-34a by aberrant CpG methylation in multiple types of cance[J]. Cell Cycle,2008,7(16):2591-2600.
[4] 吳衛東, 陳春麗,趙宗峰,等.尋常型銀屑病患者皮損中miRNA-34a及其靶基因Notch1的表達及意義[J].皮膚性病診療學雜志,2015, 22: 423-427.
[5] Zhu HG, Hou LY, Liu JJ, et al. MiR-217 is down-regulated in psoriasis and promotes keratinocyte differention via targetiong GRHL2[J]. Science Direct,2016,471:169-176.
[6] Feng C, Bai M, Yu NZ, et al. MicroRNA-181b negulates the proliferation of human epidermal keratinocytes in psoriasis through targeting TLR4[J]. Cell,2017,21(2):278-285.
[7] Srivastava A, Nikamo P, Lohcharoenkal W, et al. MicroRNA-146a suppresses IL-17-mediated skin inflammation and is genetically associated with psorasis[J]. J Auergy Clin Immunol,2017,139(2):550-561.
[8] Khokon KD, Yi Z, Yu TL, et al. Association of microRNA-34a overexpression with proliferation is cell type-dependent[J]. Cancer Science,2007, 98:1845-1852.
[9] Jacques T, Paticia R, Bertrand F, et al. Notch signalling is linked to epidermal cell differentiation level in basal cell carcinoma, psoriasis and wound healing[J]. BMC Dermatol,2002,2(7):1-12 .
[10] Tami O, Susumu T, Tatsuya T, et al. Notch signaling may be involved in the abnormal differentiation of epidermal keratinocytes in psoriasis[J]. Acta Histochem Cytochem,2014,47:175-183.
[11] Asmaa GA, Alaa HM, Amany S, et al. Up-regulation of Notch-1 in psoriasis: an mmunohistochemical study[J]. Ann Diagn Pathol,2012, 16: 177-184.

