表觀彌散系數(shù)在原發(fā)中樞神經(jīng)淋巴瘤與膠質(zhì)母細(xì)胞瘤鑒別診斷中的作用
林月,張帥,李春媚,陳敏
原發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤(primary central nervous system lymphoma,PCNSL)是一種罕見的且僅發(fā)生在中樞神經(jīng)系統(tǒng)(包括眼睛)內(nèi)的惡性淋巴瘤[1]。膠質(zhì)母細(xì)胞瘤(glioblastoma,GBM)是成人中最常見且最具有侵襲性的原發(fā)性腦腫瘤[2];兩種疾病影像表現(xiàn)相似,但治療手段及預(yù)后不盡相同,所以在術(shù)前準(zhǔn)確鑒別兩種疾病具有重要的臨床意義。筆者回顧性分析該兩種疾病的磁共振成像形態(tài)學(xué)表現(xiàn)、增強(qiáng)后的強(qiáng)化方式以及對(duì)兩種疾病的表觀彌散系數(shù)(apparent diffusion coefficient,ADC)[3]以及相關(guān)的參數(shù)分別進(jìn)行定量分析,以期提高對(duì)PCNSL與GBM的診斷和鑒別診斷水平,為臨床進(jìn)一步治療提供有價(jià)值的幫助。
1 材料與方法
1.1 一般資料
回顧性搜集北京醫(yī)院放射科圖片存檔及通信系統(tǒng)(picture archiving and communication system,PACS)中2010~2017年間的所有經(jīng)手術(shù)、病理或穿刺活檢證實(shí)的PCNSL及GBM的患者。納入標(biāo)準(zhǔn)為:(1)各例均無免疫性疾病史、無接受免疫抑制劑治療史,無獲得性免疫缺陷癥(AIDS)病史;(2)所有病例均經(jīng)體格檢查、CT或超聲檢查除外中樞神經(jīng)系統(tǒng)之外的淋巴瘤,并且隨訪3~6個(gè)月確定排除多發(fā)淋巴瘤;(3)所有病例均在掃描前未進(jìn)行過任何治療,包括:放療、化療、穿刺等;(4)圖像質(zhì)量佳,所有患者均于同一臺(tái)磁共振機(jī)器掃描。排除標(biāo)準(zhǔn):(1)追蹤隨訪時(shí)間內(nèi)發(fā)現(xiàn)全身多發(fā)淋巴瘤;(2)掃描前患者經(jīng)過放、化療等治療手段;(3)圖像質(zhì)量差或者是重復(fù)圖像。最終共納入41名患者,其中17名(41.5%)診斷為PCNSL [5名女性和12名男性;平均年齡(55.3±19.1)歲]。24名(58.5%)診斷為GBM [7名女性和17名男性;平均年齡(58.2±15.1)歲]。
1.2 設(shè)備與方法
使用GE公司1.5 T超導(dǎo)型磁共振機(jī)(GE Medical Systems,TwinSpeed,Excite),采用標(biāo)準(zhǔn)頭線圈,進(jìn)行MRI掃描。掃描序列包括:軸面和矢狀面T1FLAIR T1WI:TR 1750 ms,TE 24 ms,TI 720 ms;軸面和冠狀面FRFSE(fast recovery FSE) T2WI:TR 2690~3600 ms,TE 81.3~83.9 ms;軸面T2 FLAIR T2WI:TR 8400 ms,TE 145 ms,TI 2288 ms。軸面SE/EPI DWI:TR 4541 ms,TE 70 ms,b0=0 s/mm2,b1=1000 s/mm2。所有序列均采用5 mm層厚(除冠狀面T2WI層厚為3~4 mm外),無間隔掃描,視野240 mm×180 mm~240 mm×240 mm,矩陣除擴(kuò)散加權(quán)成像(diffusion weighted imaging,DWI)為128×128外,其他序列均為320×256。增強(qiáng)掃描使用對(duì)比劑Gd-DTPA,按0.2 mmol/kg體重,靜脈快速注射后進(jìn)行冠狀、矢狀、軸位SE T1WI掃描。
1.3 數(shù)據(jù)測(cè)量及處理
ADC值測(cè)量方法:在AW工作站上,選取病變最大面積所在層面,在病灶強(qiáng)化明顯的病灶實(shí)質(zhì)部分(避開囊變壞死、出血區(qū)及靠近腦溝區(qū))及同層對(duì)側(cè)相應(yīng)部位正常腦白質(zhì)區(qū)各取5個(gè)感興趣區(qū)(regions of interest,ROI),每個(gè)ROI面積為0.25 cm2,分別測(cè)量ADC最大值、最小值以及其平均值。淋巴瘤組ADC值與正常組ADC值之比用rADCL表示,膠質(zhì)瘤組ADC值與正常組ADC值之比用rADCG表示。
1.4 圖像資料分析
所有的圖像都由2名有十多年中樞神經(jīng)影像診斷經(jīng)驗(yàn)的放射學(xué)專家在不知道病理結(jié)果的情況下,通過PACS系統(tǒng)依靠下面定性指標(biāo)進(jìn)行診斷[4-5]:(1)腫瘤的部位:①病變單純發(fā)生于腦葉者;②病變累及胼胝體、丘腦及基底節(jié)區(qū)等深部腦組織。(2)腫瘤形態(tài):①規(guī)則;②不規(guī)則。(3)囊變、壞死、出血:①有;②無。(4)瘤周水腫:①無;②輕度(水腫帶≤腫瘤直徑1/2);③中度(腫瘤直徑1/2<水腫帶≤腫瘤直徑);④重度(水腫帶>腫瘤直徑)。(5)病灶數(shù)量:①單發(fā);②多發(fā)。(6) T1、T2信號(hào):①低信號(hào);②等信號(hào);③高信號(hào)。(7)強(qiáng)化特征:①明顯均勻強(qiáng)化;②明顯不均勻強(qiáng)化。
1.5 統(tǒng)計(jì)學(xué)方法
采用SPSS 19.0軟件包進(jìn)行數(shù)據(jù)分析。對(duì)所有計(jì)量資料采用Kolmogorov-Smirnov檢驗(yàn)進(jìn)行正態(tài)性檢驗(yàn),符合正態(tài)分布的計(jì)量資料以(±s)表示,兩組間比較采用t檢驗(yàn);分類變量采用卡方檢驗(yàn)和Fisher確切概率檢驗(yàn);對(duì)于兩種疾病有鑒別意義的定性指標(biāo)進(jìn)行二元logistic回歸分析;P<0.05表示差異有統(tǒng)計(jì)學(xué)意義。最佳診斷閾值用受試者工作特征(receiver operating characteristic,ROC)曲線,確定淋巴瘤組與膠質(zhì)瘤組組間病變面積、病變ADC值及兩組間rADC的最佳診斷閾值(optimun threshold,OT)及敏感性和特異性,即以此值作為閾值時(shí)診斷腦淋巴瘤與膠質(zhì)瘤的敏感性與特導(dǎo)性之和最大。
2 結(jié)果
2.1 PCNSL與GBM臨床數(shù)據(jù)
PCNSL與GBM患者的平均年齡和性別特征沒有顯著不同(P值分別為0.501、0.986)。在診斷為PCNSL17個(gè)患者中,B型淋巴瘤為16個(gè)(94.1%),T型淋巴瘤為1個(gè)(5.9%),主訴癥狀主要為認(rèn)知功能障礙(4例),偏身肢體無力(3例),頭痛(10例);而24個(gè)GBM患者也表現(xiàn)多發(fā)的臨床癥狀,主要包括頭痛(15例),偏身肢體無力(5例),癲癇(4例)。可以看出兩種疾病的患者臨床表現(xiàn)并不存在明顯差異,所以要想準(zhǔn)確的鑒別兩種疾病,影像學(xué)檢查顯得尤其重要。
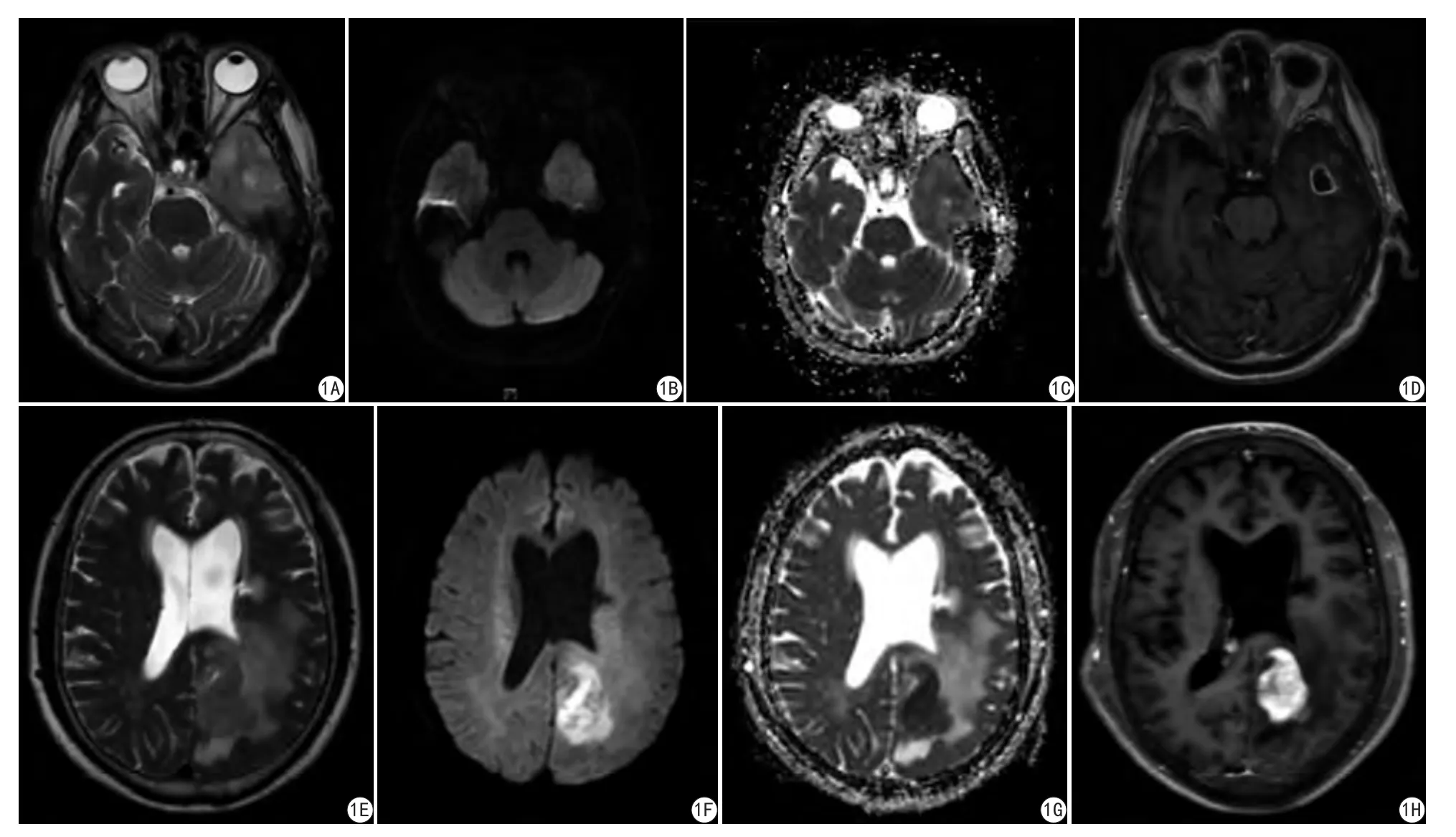
圖1 A~D:男,76歲,左側(cè)顳葉膠質(zhì)母細(xì)胞瘤,左側(cè)顳葉囊實(shí)性占位,大小約3.4 cm×2.3 cm×2.7 cm,邊界不清。A:T2WI軸位病灶呈高信號(hào)為主混雜信號(hào),周圍大片水腫;B:DWI呈輕-中不均勻擴(kuò)散受限;C:ADC圖病灶呈等低信號(hào);D:增強(qiáng)示病灶不規(guī)則環(huán)形明顯強(qiáng)化。E~H:男,68歲,左側(cè)側(cè)腦室后角旁淋巴瘤,左側(cè)側(cè)腦室后角旁實(shí)性占位,大小約4.7 cm×3.6 cm×2.4 cm,邊界不清;E:T2WI軸位病灶呈等信號(hào),周圍大片水腫;F:DWI呈重度不均勻擴(kuò)散受限;G:ADC圖病灶呈等低信號(hào);H:增強(qiáng)示病灶不規(guī)則環(huán)形明顯均勻強(qiáng)化Fig. 1 A—D: Male, 76 years old, left temporal lobe glioblastoma, left temporal lobe solid cystic tumor, the size is about 3.4 cm×2.3 cm×2.7 cm, the border is unclear. A: On T2WI axial lesion is high-signal-based mixed signals around the large edema. B: DWI shows inhomogeneous restricted diffusion. C: ADC figure lesions in low signal. D: The enhancement shows irregular circular reinforcement. E—H: Male, 68 years old, left lateral ventricular posterior horn lymphoma, left ventricular posterior horn solid lesion,the size is about 4.7 cm×3.6 cm×2.4 cm, not well-defined. E: T2WI axial lesion is low-mixed signal around the large edema. F: DWI shows significantly inhomogeneous restricted diffusion. G: ADC figure lesions in low signal. H: The enhancement shows irregular lesions significantly enhanced.
2.2 PCNSL與GBM定性指標(biāo)的鑒別
PCNSL與GBM MRI定性特征(包括病變累及部位、病變數(shù)量、形態(tài)規(guī)則、囊變、壞死、出血以及明顯均勻強(qiáng)化)歸納于表1,PCNSL的MRI特征與GBM相比(圖1);另外,PCNSL的患者中在T1WI上表現(xiàn)為等信號(hào)的有2例(2/17),低信號(hào)的有12例(12/17),高信號(hào)的有3例(3/17);在T2WI上表現(xiàn)為等信號(hào)的有1例(1/17),低信號(hào)的有2例(2/17),高信號(hào)的有14例(14/17)。而GBM患者在T1WI上表現(xiàn)為等信號(hào)的有4例(4/24),低信號(hào)的有18例(18/24),高信號(hào)的有2例(2/24);在T2WI上表現(xiàn)為等信號(hào)的有3例(3/24),低信號(hào)的有1例(1/24),高信號(hào)的有20例(20/24)。PCNSL的患者表現(xiàn)為無水腫的有3例(3/17),輕度水腫的有7例(7/17),中度水腫的有2例(2/17),重度水腫的有5例(5/17);GBM表現(xiàn)為無水腫的有3例(3/24),輕度水腫的有7例(7/24),中度水腫的有4例(4/24),重度水腫的有10例(10/24)。上述三種定性指標(biāo)在兩種疾病中并沒有表現(xiàn)出明顯的差異,P值分別為0.638、0.540、0.760(排列順序依次是兩種疾病的T1信號(hào)、T2信號(hào)、周圍水腫程度)。但是,進(jìn)行多元logistic回歸分析時(shí),并沒有發(fā)現(xiàn)哪一種指標(biāo)能夠成為鑒別上述兩種疾病的獨(dú)立預(yù)測(cè)指標(biāo)。
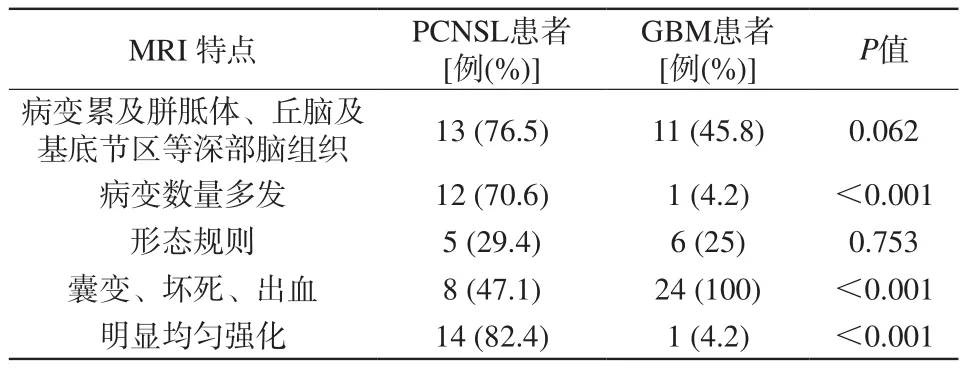
表1 原發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤與膠質(zhì)母細(xì)胞瘤定性指標(biāo)的鑒別Tab. 1 Differential diagnosis of primary central nervous system lymphoma and glioblastoma
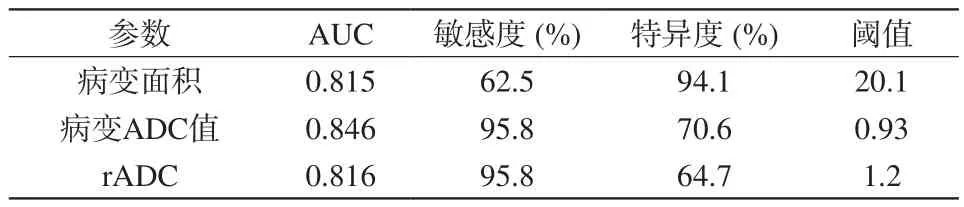
表2 病變面積、病變ADC平均值和rADC這三個(gè)因素評(píng)估膠質(zhì)母細(xì)胞瘤的診斷表現(xiàn)Tab.2 The diagnostic value of glioblastoma was evaluated by three factors: lesion area, the ADCmean value and the rADC
2.3 PCNSL與GBM定量指標(biāo)的鑒別
PCNSL與GBM的MRI定量特征總結(jié)如下:PCNSL比GBM腫瘤實(shí)質(zhì)部分ADC平均值低[(0.86±0.34)×103mm2/s和(1.47±0.57)×103mm2/s,P=0.019]。PCNSL比GBM腫瘤實(shí)質(zhì)部分rADC值低(1.16±0.63、1.83±0.38,P=0.020);然而,PCNSL與GBM病變面積[(9.5±7.8) cm2和(23.2±13.5) cm2,P=0.052],以及ADC最大值[(1.31~1.50)×103mm2/s和(2.23~2.54)×103mm2/s,P=0.34)和ADC最小值低[(0.47~0.62)×103mm2/s和(0.86~1.34)×103mm2/s,P=0.137)并沒有表現(xiàn)出明顯的差異。ROC曲線(圖2)用來表示兩種疾病病變處ADC平均值及其rADC值鑒別兩種疾病的診斷效能。ROC曲線下面積(area under curve,AUC),敏感度、特異度及其閾值總結(jié)在表2。從曲線中我們可以看出病變處面積、ADC平均值及其rADC值的AUC分別為0.815、0.846、0.816。綜合分析,ADC平均值及rADC值這兩種指標(biāo)可以作為鑒別PCNSL與GBM的有效指標(biāo)。
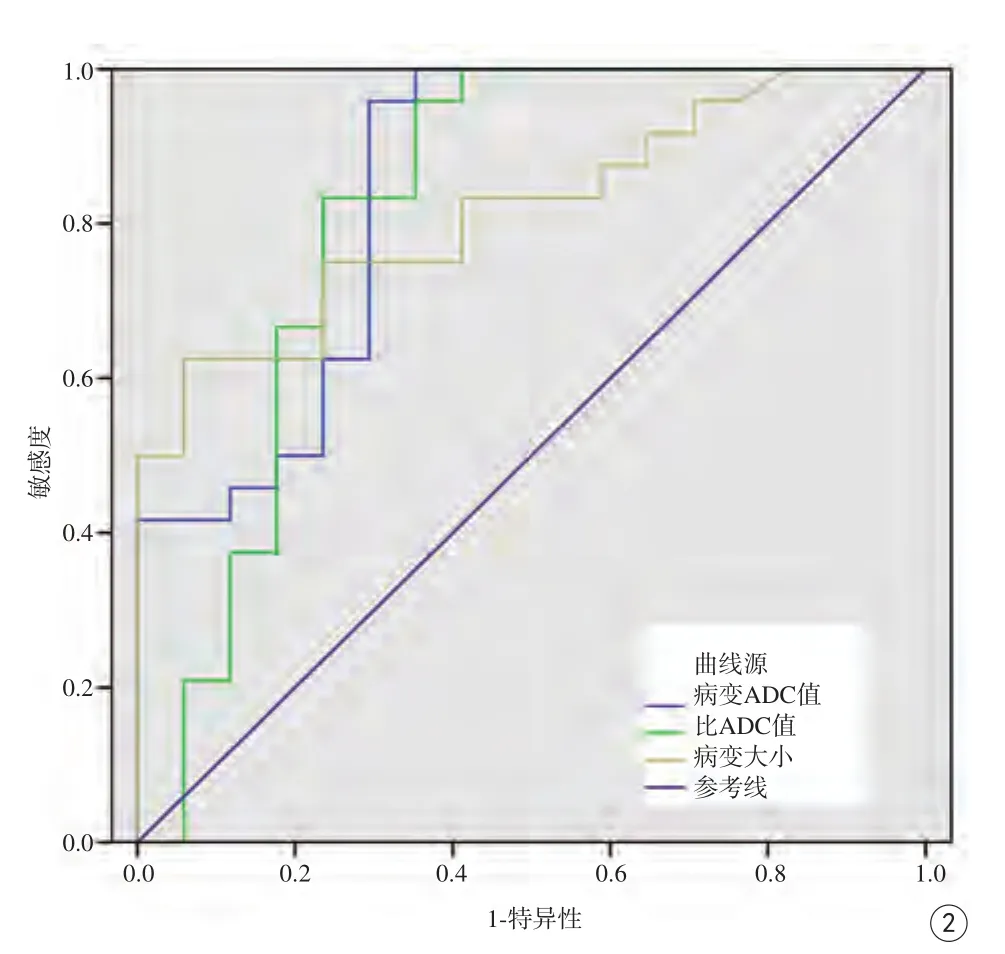
圖2 病變ADC平均值、rADC值、病變大小值鑒別診斷膠質(zhì)母細(xì)胞瘤細(xì)胞與原發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤的ROC曲線Fig. 2 ROC curves in differential diagnosis of the ADC mean value, the ratio of ADC and the size of lesion of PCNSL and GBM.
3 討論
3.1 兩種模型的差異及相關(guān)性
本研究不僅詳盡地對(duì)其從形態(tài)學(xué)上進(jìn)行鑒別比較,而且還用反映不同組織彌散微觀結(jié)構(gòu)的ADC值[6]進(jìn)行定量分析,且對(duì)ADC從最大值、最小值及平均值進(jìn)行三方面分析,并且為最大程度減小人為誤差,也對(duì)rADC值進(jìn)行比較。
3.1 PCNSL與GBM MRI形態(tài)學(xué)分析
研究結(jié)果顯示,PCNSL與GBM患者的平均年齡和性別特征沒有顯著不同(P值分別為0.501、0.986),也就是說從本實(shí)驗(yàn)結(jié)果看這兩種疾病發(fā)生并沒有明顯的年齡及性別的傾向性,并不能通過患者的年齡及性別去鑒別該兩種疾病;其次,在診斷為PCNSL17個(gè)患者中,B型淋巴瘤為16個(gè)(94.1%),T型淋巴瘤為1個(gè)(5.9%),與其他研究結(jié)果一致[7],B型淋巴瘤好發(fā)率明顯高于T型淋巴瘤。PCNSL的MRI特征與GBM相比,包括病變數(shù)量多發(fā)(P<0.001),明顯均勻強(qiáng)化(P<0.001)顯然更加常見。這種結(jié)果是跟以前的研究結(jié)果[5]一致。因?yàn)榱馨土雠c膠母細(xì)胞瘤相比,屬于具有多中心性生長特性的全腦性疾病,易在基底節(jié)區(qū)、胼胝體、丘腦及大腦半球的深部白質(zhì)通路多灶性分布,甚至可跨越中線結(jié)構(gòu),與高級(jí)別膠質(zhì)瘤浸潤性生長相似,所以病變數(shù)量可多發(fā)。病理上[8],PCNSL中的血管壁大部分被腫瘤細(xì)胞浸潤被破壞,導(dǎo)致有孔的毛細(xì)血管內(nèi)皮,甚至在血管腔和基底膜之間沒有內(nèi)皮,而GBM中的血管基膜盡管內(nèi)皮細(xì)胞增殖是完整的,這也就解釋了與GBM相比,PCNSL明顯均勻強(qiáng)化更多見的原因。而GBM與PCNSL相比,囊變、壞死、出血(P<0.001)顯示地更加明顯。GBM較PCNSL浸潤性強(qiáng),具有不斷生成其增殖所依賴的新生腫瘤血管,血流灌注明顯增加,瘤中心常壞死,瘤周水腫顯著,占位效應(yīng)明顯,可伴有出血和鈣化。顱內(nèi)惡性淋巴瘤的起源一直有爭(zhēng)議,因?yàn)橹袠猩窠?jīng)系統(tǒng)沒有內(nèi)在淋巴組織或淋巴循環(huán),因此,多數(shù)學(xué)者認(rèn)為其組織來源可能為腦組織血管周圍未分化的多潛能間葉細(xì)胞,即繼發(fā)的淋巴組織,其腫瘤細(xì)胞生長方式主要有兩種:(1)腫瘤細(xì)胞聚集在血管周圍間隙內(nèi),圍繞血管周圍生長,形成血管袖套,浸潤周圍腦組織,并且在血管周圍腫瘤細(xì)胞密集,遠(yuǎn)離血管則稀疏。(2)腫瘤細(xì)胞彌漫性浸潤性生長,在瘤周,瘤細(xì)胞浸潤周圍正常的腦組織,在正常腦組織的小血管周圍亦形成袖套,該特征是病理上診斷PCNSL的一個(gè)很有價(jià)值的特征,也導(dǎo)致了淋巴瘤病變較均勻,出現(xiàn)囊變、出血、壞死率較GBM瘤低。PCNSL級(jí)GBM在T1及T2信號(hào)上,并沒有顯示明顯的差異,P值分別為0.638、0.540,但是PCNSL也有一定的特異性信號(hào),T1WI呈等或稍低信號(hào),T2WI呈稍低或等信號(hào),這是由它的病理特征決定的。Guo等[8]通過組織病理學(xué)計(jì)量測(cè)定核漿比率發(fā)現(xiàn),PCNSL是高細(xì)胞密度腫瘤,由巨大淋巴樣瘤細(xì)胞簇在腦組織中堆積形成,瘤細(xì)胞排列異常緊密,遠(yuǎn)高于高級(jí)別星形細(xì)胞瘤;細(xì)胞間質(zhì)少,間質(zhì)內(nèi)分布較為豐富的網(wǎng)狀纖維;其核、漿比例(1.45±0.94)遠(yuǎn)高于高級(jí)別星形細(xì)胞瘤(0.24±0.18)。而兩種疾病周圍的水腫并沒有顯示出明顯的區(qū)別(P=0.760),這主要是因?yàn)椴⒉荒軆H從MRI形態(tài)學(xué)上鑒別出這些是腫瘤周圍水腫還是腫瘤浸潤造成的,所以對(duì)進(jìn)一步鑒別周圍水腫[3]和腫瘤浸潤,還需要進(jìn)一步研究證明。
3.2 PCNSL與GBM ADC值和rADC值的對(duì)比分析
PCNSL比GBM腫瘤實(shí)質(zhì)部分ADC平均值低[5](P=0.019),PCNSL由巨大淋巴樣瘤細(xì)胞簇在腦組織中堆積性生長,細(xì)胞大、排列緊密、細(xì)胞間質(zhì)少。其彌散障礙現(xiàn)象與高細(xì)胞密度的病理改變密切相關(guān)。而GBM囊變、壞死較多,自由水較豐富,彌散受限沒有PCNSL那么明顯。為了消除腦白質(zhì)彌散差異性的影響,我們引入了rADC值概念,即腫瘤組織ADC值與對(duì)側(cè)半球?qū)?yīng)正常部位腦白質(zhì)ADC值的比值。結(jié)果是PCNSL比GBM腫瘤實(shí)質(zhì)部分rADC值低(P=0.020),結(jié)果仍是PCNSL的rADC值比GBM的rADC值低。Guo等[8]通過直接比較CNS淋巴瘤與高級(jí)別星形細(xì)胞瘤的細(xì)胞密度與ADC值的相關(guān)性,并進(jìn)一步通過組織病理學(xué)計(jì)量測(cè)定核/漿比率與ADC值的相關(guān)性研究認(rèn)為:是腫瘤細(xì)胞密度而不是核/漿比率與組織的彌散程度呈負(fù)相關(guān)。我們也比較了兩種疾病病變處與對(duì)側(cè)正常腦實(shí)質(zhì)T2及T1信號(hào)強(qiáng)度。但本組結(jié)果也證實(shí)兩種疾病之間的信號(hào)差異并不明顯(P值分別為0.638、0.540)。本研究的目的是通過MRI掃描圖像定性、定量兩種指標(biāo)最大程度上去鑒別兩種疾病,疾病的信號(hào)表現(xiàn)盡管目前還沒有確切的文獻(xiàn)表示對(duì)這兩種疾病的鑒別有明確的意義[9-12],但是信號(hào)是MRI成像的特點(diǎn),也是不能忽視的優(yōu)點(diǎn),所以筆者在鑒別兩種疾病時(shí)還是把信號(hào)加入其中。盡管這兩種疾病在信號(hào)上沒有明顯差異,但是也是提醒我們?cè)贛RI上鑒別疾病的時(shí)候,一定要考慮信號(hào)的改變及差異。綜上所述,我們?cè)阼b別PCNSL與GBM[13]的時(shí)候,主要要從病變數(shù)量,強(qiáng)化方式,是否有囊變、壞死、出血[14-15],病變的ADC值及其rADC值,這5個(gè)方面考慮,必然會(huì)提高鑒別診斷的準(zhǔn)確率。
當(dāng)然,PCNSL不僅要跟GBM鑒別,還需要和生殖細(xì)胞瘤和腦轉(zhuǎn)移瘤[14]鑒別。生殖細(xì)胞瘤好發(fā)年齡在25歲以下,好發(fā)于松果體區(qū)、鞍區(qū)及基底節(jié)區(qū),它的好發(fā)部位及好發(fā)年齡是重要的鑒別點(diǎn)。腦轉(zhuǎn)移瘤常表現(xiàn)為環(huán)狀強(qiáng)化伴腫瘤周圍水腫,但是并沒有彌散受限,這也是最主要的鑒別點(diǎn)。
同時(shí),本研究也有幾處局限。(1)由于本病發(fā)病率不高,本研究樣本量太小,盡管結(jié)果與以前結(jié)果一致,但是并沒有很好的代表性,還需要加大樣本,進(jìn)行更加細(xì)致的研究。(2)在測(cè)量ADC值時(shí),盡管多次測(cè)量取平均值,但仍存在人為誤差,希望以后能進(jìn)一步改善。(3)本研究是回顧性研究,在挑選病例時(shí),沒辦法做到完全隨機(jī),摻雜人為因素,以后研究盡量做到完全隨機(jī),不要出現(xiàn)偏倚。
綜上所述,本研究證實(shí)從MRI形態(tài)學(xué)表現(xiàn)、強(qiáng)化方式及其測(cè)量得到的ADC平均值及rADC值是完全可以去鑒別PCNSL與GBM。
參考文獻(xiàn) [References]
[1]Johnson DR, Guerin JB, Giannini C, et al. 2016 Updates to the WHO brain tumor classification system: what the radiologist needs to know.Radiographics, 2017, 37(7): 2164-2180.
[2]Schramm P, Xyda A, Klotz E, et al. Dynamic CT perfusion imaging of intra-axial brain tumours: differentiation of high-grade gliomas from primary CNS lymphomas. Eur Radiol, 2010, 20(10):2482-2490.
[3]Server A, Kulle B, Maehlen J, et al. Quantitative apparent diffusion coefficients in the characterization of brain tumors and associated peritumoral edema. Acta Radiol, 2009, 50(6): 682-689.
[4]Malikova H, Koubska E, Weichet J, et al. Can morphological MRI differentiate between primary central nervous system lymphoma and glioblastoma? Cancer Imaging, 2016, 16(1): 40.
[5]Lin X, Lee M, Buck O, et al. Diagnostic accuracy of T1-weighted dynamic contrast-enhanced-MRI and DWI-ADC for differentiation of glioblastoma and primary CNS lymphoma. AJNR Am J Neuroradiol, 2017, 38(3): 485-491.
[6]Kickingereder P, Sahm F, Wiestler B, et al. Evaluation of microvascular permeability with dynamic contrast-enhanced MRI for the differentiation of primary CNS lymphoma and glioblastoma:radiologic-pathologic correlation. AJNR Am J Neuroradiol, 2014,35(8): 1503-1508.
[7]Boonzaier NR, Larkin TJ, Matys T, et al. Multiparametric MR imaging of diffusion and perfusion in contrast-enhancing and nonenhancing components in patients with glioblastoma. Radiology,2017, 284(1): 180-190.
[8]Guo AC, Cummings TJ, Dash RC, et al. Lymphomas and high grade astrocytomas: comparison of water diffusibility and histologic characteristics. Radiology, 2002, 224(1): 177-183.
[9]Chawla, S, Zhang Y, Wang S, et al., Proton magnetic resonance spectroscopy in differentiating glioblastomas from primary cerebral lymphomas and brain metastases. J Comput Assist Tomogr, 2010,34(6): 836-841.
[10]Yamashita K, Yoshiura T, Hiwatashi A, et al. Differentiating primary CNS lymphoma from glioblastoma multiforme: assessment using arterial spin labeling, diffusion-weighted imaging, and(1) (8) F-fluorodeoxyglucose positron emission tomography.Neuroradiology, 2013, 55(2): 135-143.
[11]Aburano H, Ueda F, Yoshie Y, et al. Differences between glioblastomas and primary central nervous system lymphomas in 1H-magnetic resonance spectroscopy. Jpn J Radiol, 2015, 33(7): 392-403.
[12]Nakajima S, Okada T, Yamamoto A, et al. Differentiation between primary central nervous system lymphoma and glioblastoma: a comparative study of parameters derived from dynamic susceptibility contrast-enhanced perfusion-weighted MRI. Clin Radiol, 2015,70(12): 1393-1399.
[13]Lee J, Choi SH, Kim JH, et al. Glioma grading using apparent diffusion coefficient map: application of histogram analysis based on automatic segmentation. NMR Biomed, 2014, 27(9): 1046-1052.
[14]Lu S, Gao Q, Yu J, et al. Utility of dynamic contrast-enhanced magnetic resonance imaging for differentiating glioblastoma, primary central nervous system lymphoma and brain metastatic tumor. Eur J Radiol, 2016, 85(10): 1722-1727.
[15]Choi YS, Lee HJ, Ahn SS, et al. Primary central nervous system lymphoma and atypical glioblastoma: differentiation using the initial area under the curve derived from dynamic contrast-enhanced MR and the apparent diffusion coefficient. Eur Radiol, 2017, 27(4):1344-1351.

