心臟磁共振組織追蹤技術評估冠心病心肌梗死的診斷價值
多國帥,劉婷,戴旭
心臟磁共振(cardiovascular magnetic resonance,CMR)可通過“一站式”無創檢查一次性完成心臟結構與功能(包括冠狀動脈顯影、血流灌注、室壁運動、檢測心肌活性等)的評價[1]。目前CMR的檢查模式日漸成熟,是用來評估心肌功能、測量心臟容積、檢測梗死瘢痕心肌的金標準;并且已經成為了評估先天性心臟病,心力衰竭,心包疾病和冠狀動脈疾病的不可或缺的診斷工具[2]。近年來,評估心臟力學參數的組織追蹤技術(tissue tracking technology,TT)被廣泛地用于各種心臟疾病的臨床研究和實踐中。通過超聲心動圖和心臟磁共振對心臟的無創性檢查,可以定量化評估心臟的運動以及形變的情況[3]。最近,基于磁共振穩態自由進動梯度回波(steady state free precession,SSFP)電影序列的心臟磁共振組織追蹤技術已經被證明在重度主動脈瓣狹窄[4]、心臟淀粉樣變[5]、心力衰竭[6]、致心律失常性右室發育不良、心肌病[7]等心臟疾病中具有一定的臨床應用價值。冠心病(coronary artery disease,CAD)在世界范圍內發病率和病死率較高,并且仍然在上升,其并發癥多,病死率高。CMR在冠心病中的應用之一就是心肌活性檢查,包括常規CMR掃描、對比延遲增強掃描技術、藥物負荷MRI檢查。本研究基于常規CMR檢查的SSFP電影序列組織追蹤技術,對冠心病患者左心室心肌應變參數進行測量分析,以左心室射血分數以及心肌活性檢查結果[延遲強化(late gadolinium enhancement,LGE)]作為診斷參考標準,討論該技術定量化評價冠心病心肌梗死的診斷價值,與心臟功能改變的相關性,并探討這種定量技術的可行性、可重復性,及診斷價值。
1 材料與方法
1.1 研究對象
本研究分為冠心病組與健康人組。冠心病組:搜集2016年1月1日至2017年10月19日在本院確診為冠心病并接受心臟磁共振檢查的患者。冠心病組入組標準:經冠脈造影或冠脈CT血管成像(computed tomography angiography,CTA)檢查并且經臨床確診為冠心病的患者。排除標準:具有瓣膜性心臟病、先天性心臟病、心肌病、嚴重心律失常、圖像質量不合格等患者。最終納入冠心病組23例,均接受心臟MR平掃+增強檢查,并且圖像符合后處理標準。其中有3支病變者6例,2支病變8例,單支病變9例。健康人組:選擇同期于本院進行心電圖、血生化檢查、常規超聲心動圖檢查、心臟磁共振檢查未見異常的健康志愿者共16名。
1.2 研究儀器
(1)Siemens magnetom verio 3.0 T TX多源發射磁共振儀[梯度場強為80 mT/m,梯度切換率為200 mT/(m?ms)]。(2) 12通道表面相控陣線圈。(3)MR兼容的無線藍牙心電及呼吸門控板。
1.3 研究試劑
(1)釓噴酸葡胺注射液Gd-DTPA,規格469.01 mg/ml×15 ml。(德國拜爾,進口藥品注冊證號:H20080146,藥品批準文號:國藥準字J20080064)。(2) 0.9%氯化鈉注射液(生理鹽水),規格 4.5 g/500ml。(中國大冢制藥有限公司,國藥準字:H12020010)。
1.4 檢查方法及掃面參數
(1)定位掃描:患者取仰臥位。行軸位、冠狀位及矢狀位定位掃描;在以上切面的基礎上,以心臟軸線為中心分別確定左心室兩腔心、四腔心長軸切面、左室流入流出道、左心室短軸切面。(2)于呼氣末采集圖像獲得各切面的SSFP電影序列;掃描參數:TR51.5 ms,TE 1.7 ms, FA 70°,FOV 340 mm×360 mm,采集矩陣256×192,左室短軸層厚8 mm采集8~10層。(3)釓對比延遲增強掃描:使用高壓注射器經外周靜脈注入對比劑釓噴酸葡胺注射液(規格469.01 mg/ml×15 ml),劑量0.2 mmol/kg,注射速率4.0 ml/s,并以同等速度注射等量0.9%氯化鈉注射液。注射后7 min開始采用心電門控屏氣相位敏感性反轉恢復序列(phase sensitive inversion recovery,PSIR)掃描;掃描參數:TR 750 ms,TE 2.6 ms,反轉時間TI (根據心肌最黑層面實時確定);FOV 340 mm×360 mm,采集矩陣256×192,左室短軸層厚8 mm采集8~10層;掃描切面同電影序列切面。
1.5 圖像處理
所有圖像傳入CVI42軟件(Circle Cardiovascular Imaging,加拿大,卡爾加里)由1名放射科醫師進行心功能以及心臟磁共振組織追蹤技術(cardiovascular magnetic resonance tissue tracking technology,CMR-TT)后處理,并且醫師不知道患者的基本病情。
心功能參數:根據美國心血管磁共振委員會2013年發布的后處理標準[8],在短軸位電影序列舒張末期及收縮末期手動地勾畫心內膜以及心外膜,獲得左心室舒張末期容積(left ventricular enddiastolic volume,LVEDV);左心室收縮末期容積(left ventricular end-systolic volume,LVESV);左心室射血分數(left ventricular ejection fraction,LVEF)等參數。
心肌應變參數:根據CVI42軟件后處理標準,在左心室各切面電影序列舒張末期勾畫心內膜及心外膜,通過軟件自動跟蹤心內膜及心外膜的位移來量化左心室心肌的運動情況。得到心肌整體以及節段的3D徑向應變(radial strain,RS),3D周向應變(circumferential strain,CS)、3D縱向應變(longitudinal strain,LS)等參數以及各個參數的應變曲線以及16節段牛眼圖(2002美國心臟病協會[9])(圖1,2)。
1.6 統計學分析
全部數據采用SPSS 24.0 (IBM,美國,芝加哥)統計軟件進行處理,連續變量用均數±標準差表示。根據參數分組情況選擇不同統計學方法,獨立樣本間比較采用Shapiro-Wilk檢驗并根據是否滿足正態分布選擇獨立樣本t檢驗或者Wilcoxon秩和檢驗;不同測量者兩次測量定量數據的一致性采用組內相關系數(ICC)分析;心功能與心肌應變參數采用Pearson相關性分析法,相關系數0.8~1.0為極強相關,0.6~0.8為強相關,0.4~0.6為中等程度相關,0.2~0.4為弱相關,0.0~0.2為極弱相關或無相關;采用Logistic回歸模型和受試者工作特性(receiver operating characteristic,ROC)曲線來評價心肌應變參數的診斷效能。P<0.05 為差異有統計學意義。
2 結果
2.1 圖像質量評估
冠心病組23例,健康人組16例SSFP電影序列均符合CVI42軟件后處理標準。左心室心肌節段經由2名經驗豐富的放射科醫師診斷,并根據2002年美國心臟病協會規定的16個心肌節段,得到72個延遲LGE陽性節段,296個延遲強化陰性節段。
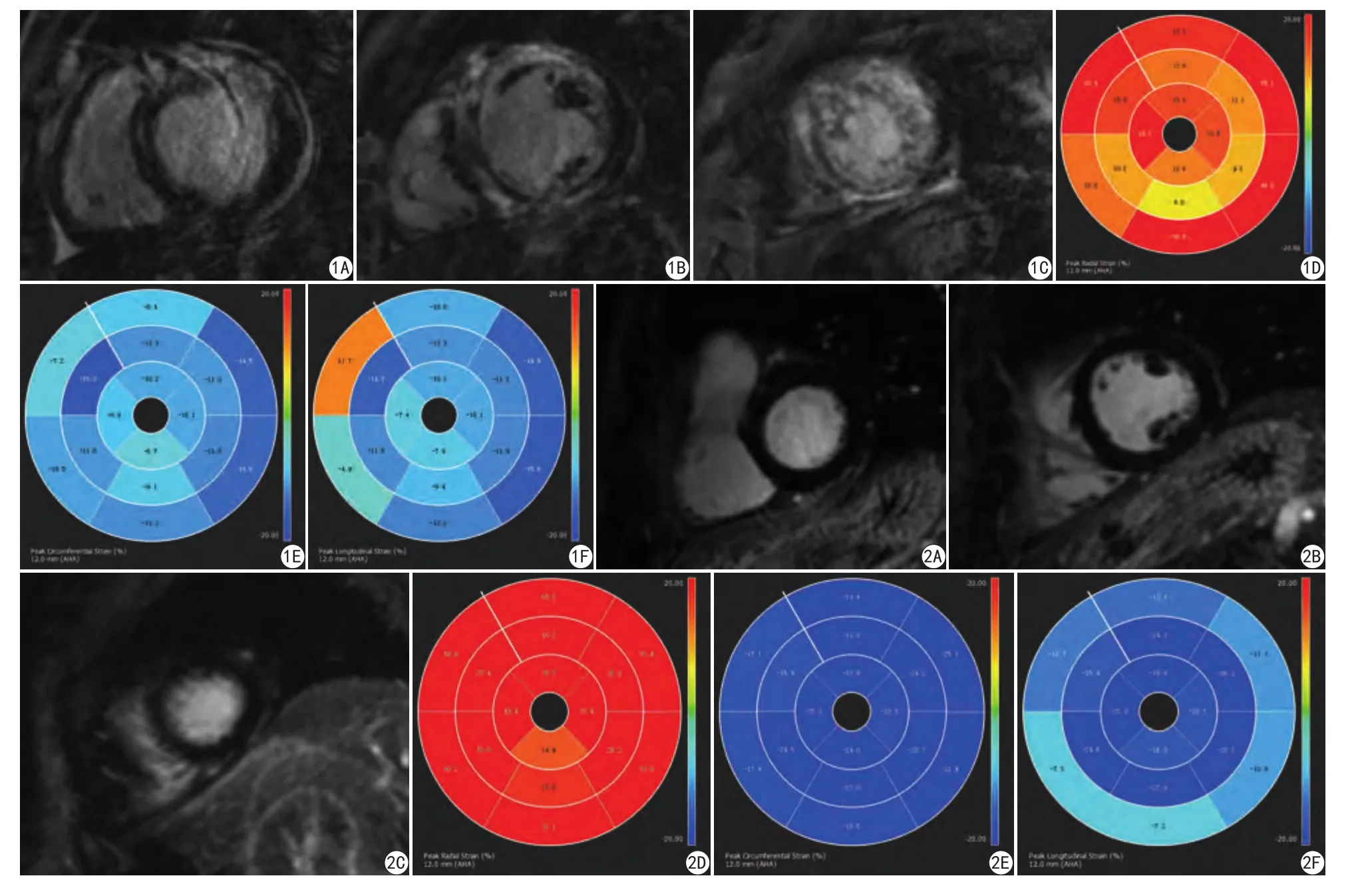
圖1 冠心病組,男60歲。冠脈CTA示LAD重度狹窄,RCA中度狹窄。A:基底部前壁透壁強化;基底部前間隔壁線樣強化;B:乳頭肌水平前壁、下壁透壁強化;乳頭肌水平下間隔壁斑片樣強化;C:心尖部前壁、間隔壁、下壁、側壁透壁強化。D~F為心肌應變參數牛眼圖 圖2 冠心病組,男,53歲。冠脈CTA示LAD輕度狹窄,RCA中度狹窄。A~C:未見明顯延遲強化。D~F:為心肌應變參數牛眼圖Fig. 1 A 60-year-old male patient with CAD. Coronary CTA showed severe stenosis of LAD and moderate stenosis of RCA. A: Basal: anterior shows transmural enhancement.Anteroseptal and inferoseptal show a linear enhancement. B: Mid:anterior and interior show transmural enhancement. Patch-like enhancement seen on the inferoseptal. C: Apical: anterior, septal, inferior and lateral show transmural enhancement. D—F: RS, CS and LS of the bull's-eye map.Fig. 2 A 53-year-old male patient with CAD. There is no noticeable delay enhancement in the A—C figure. E—F: RS, CS and LS of the bull's-eye map.
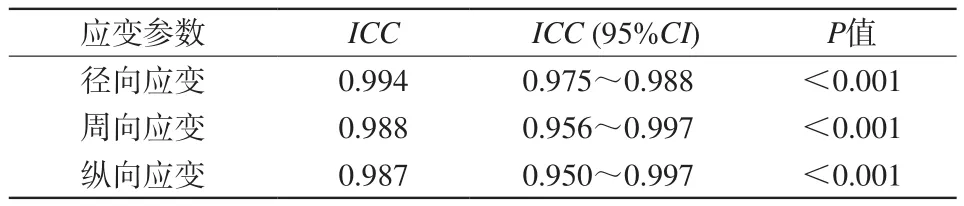
表1 冠心病組CMR-TT 3D應變參數測量組內相關系數Tab.1 Intra-class correlation coefficient of CMR-TT 3D strain parameters in CAD group
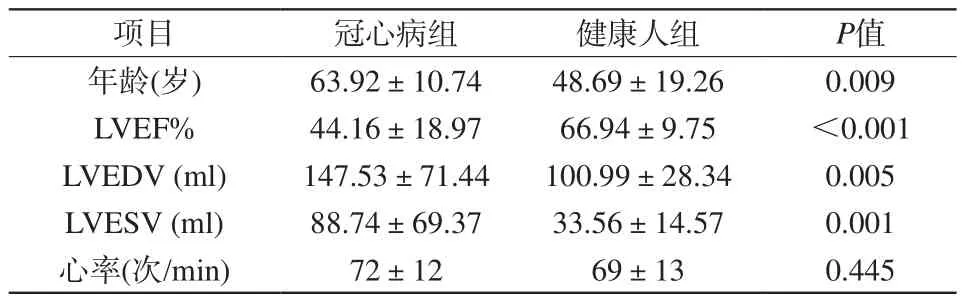
表2 冠心病組與健康人組臨床資料比較Tab. 2 Comparison of clinical data between CAD group and healthy volunteer group
2.2 可重復性檢驗
從23例冠心病組中隨機選取10名患者,由兩名醫師分別獨立進行CMR-TT后處理,并且2名醫師不知道對方的處理結果和患者的病情。對兩名醫師的測量值進行組內相關系數(ICC)分析。
2名醫師左心室整體3D徑向應變、周向應變、縱向應變測量結果組內相關系數(ICC)見表1,所有的測量結果均表現較好的可重復性(ICC值均≥0.75)。
2.3 左心室各參數值正態性檢驗
(1)通過對23例冠心病組及16例健康人射血分數,左心室整體3D徑向、周向、縱向應變峰值進行Shapiro-Wilk檢驗:冠心病組LVEF 44.16%±18.97% (P=0.290),徑向應變30.35%±17.26% (P=0.353),周向應變-13.92%±5.77% (P=0.263),縱向應變-11.30%±4.75% (P=0.829)與正態分布差異無統計學意義,服從正態分布。健康人組徑向應變45.46%±8.90% (P=0.210),周向應變-19.34%±2.30% (P=0.480),縱向應變-16.54%±2.40% (P=0.853)與正態分布差異無統計學意義,服從正態分布。(2)分別對72個LGE陽性心肌節段和296個LGE陰性心肌節段3D徑向、周向、縱向應變峰值進行Shapiro-Wilk檢驗:LGE陰性節段周向應變-17.20%±5.86% (P=0.227)與正態分布差異無統計學意義,符合正態分布。徑向應變41.42%±25.73% (P<0.001),縱向應變-13.83%±8.85% (P<0.001)與正態分布差異有統計學意義,不服從正態分布。
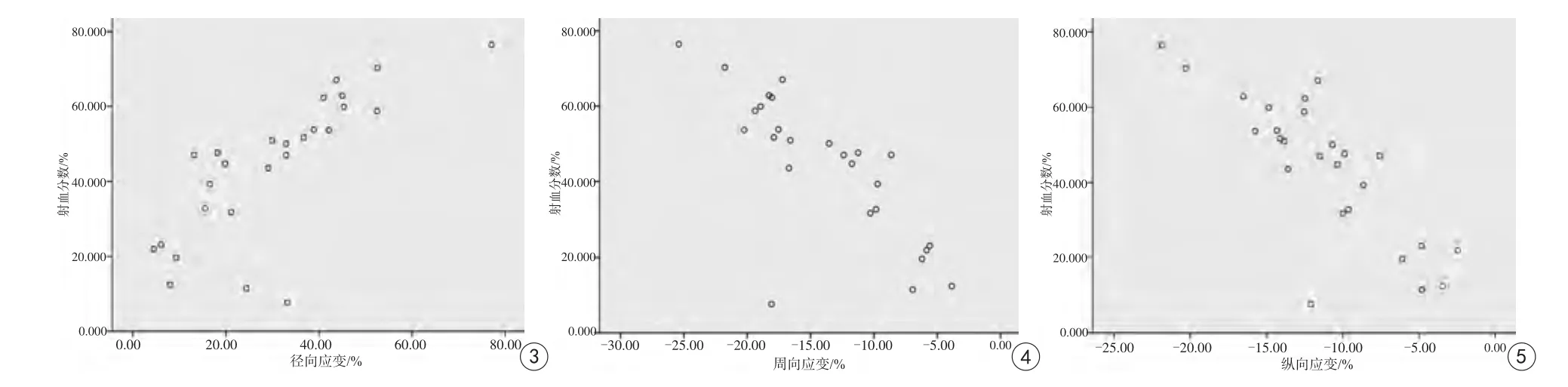
圖3~5 顯示徑向應變、周向應變、縱向應變與射血分數存在線性關系。隨著心肌徑向應變,周向應變以及縱向應變的減低,射血分數隨之下降(正值表示心肌變厚和增長,負值表示心肌變薄和縮短)Fig. 3—5 Show that there is a linear relationship between RS, CS, LS and LVEF. As myocardial RS, CS, LS decrease, the LVEF decreases. Positive values indicate thickening and growth of the myocardium, negative values indicate thinning and shortening of the myocardium.

表3 冠心病組與健康人組CMR-TT 3D應變參數差異分析Tab. 3 Analysis of CMR-TT 3D strain parameters in CAD group and healthy volunteer group
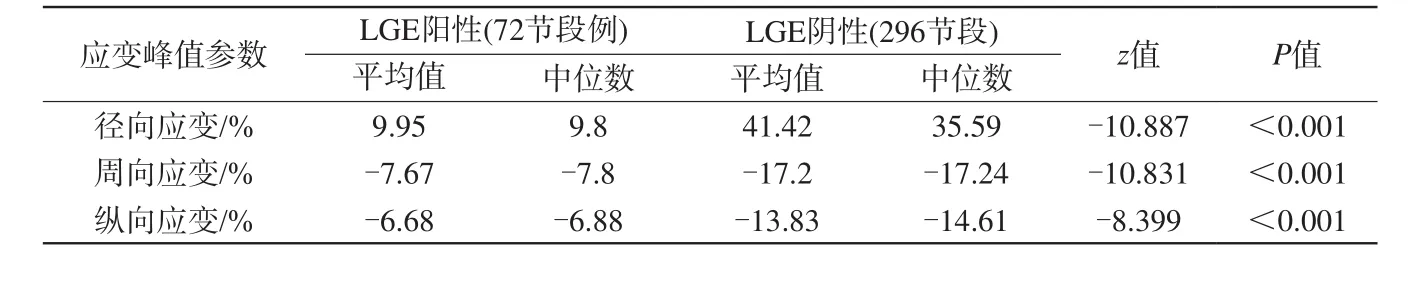
表4 LGE陽性節段與LGE陰性節段差異分析Tab. 4 Difference analysis between LGE-positive segment and LGE-negative segment
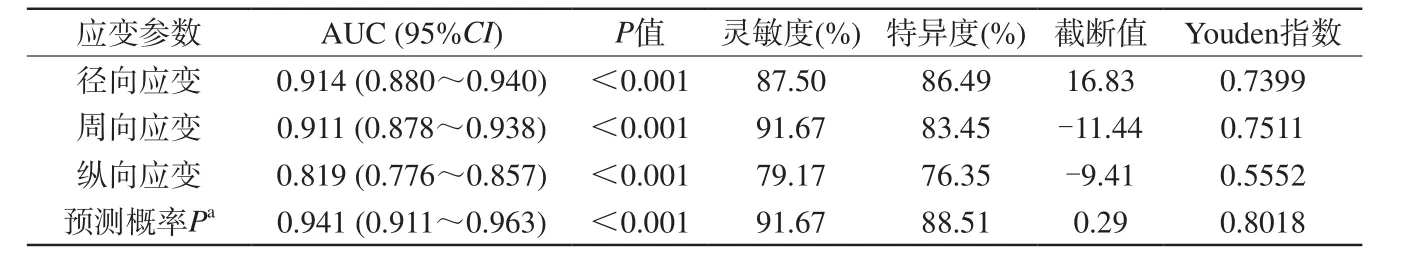
表5 CMR-TT 3D應變參數診斷冠心病心肌節段梗死單因素和聯合診斷ROC分析Tab. 5 CMR-TT 3D strain parameter diagnosis of myocardial segmental infarction in CAD by single factor and combined ROC analysis
LGE陽性節段徑向應變9.96%±9.61% (P=0.005)、周向應變-7.67%±4.07%(P=0.016),縱向應變-6.67%±4.66% (P=0.001)與正態分布差異有統計學意義,不服從正態分布。
2.4 一般臨床資料分析
冠心病組與健康人組的一般臨床資料結果如表2所示,冠心病組在年齡、LVEF%、LVEDV、LVESV上與健康人組差異具有統計學意義,在心率上差異無統計學意義。
2.5 冠心病左心室心肌整體各方向應變
根據正態檢驗結果,對冠心病組與健康人組左心室心肌整體3D各方向應變峰值進行獨立樣本t檢驗。結果如表3所示,結合實際數據,可認為冠心病組左心室整體的徑向應變、周向應變、縱向應變低于健康人組,差異具有統計學意義。
2.6 冠心病左心室心功能與左心室心肌應變
對23例冠心病組左心室射血分數(金標準)和左心室心肌應變參數進行散點圖繪制(圖3~5)和Pearson相關性分析:左心室射血分數與徑向應變呈強相關(r=0.774,P<0.001),與周向應變呈強相關(r=0.778,P<0.001),與縱向應變呈極強相關(r=0.802,P<0.001)。
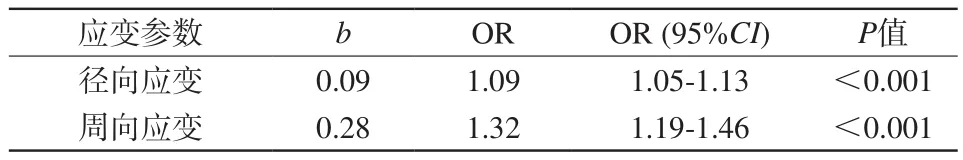
表6 聯合診斷Logistic回歸方程中的變量aTab. 6 Variable in Logistic regression equation of combined diagnosisa
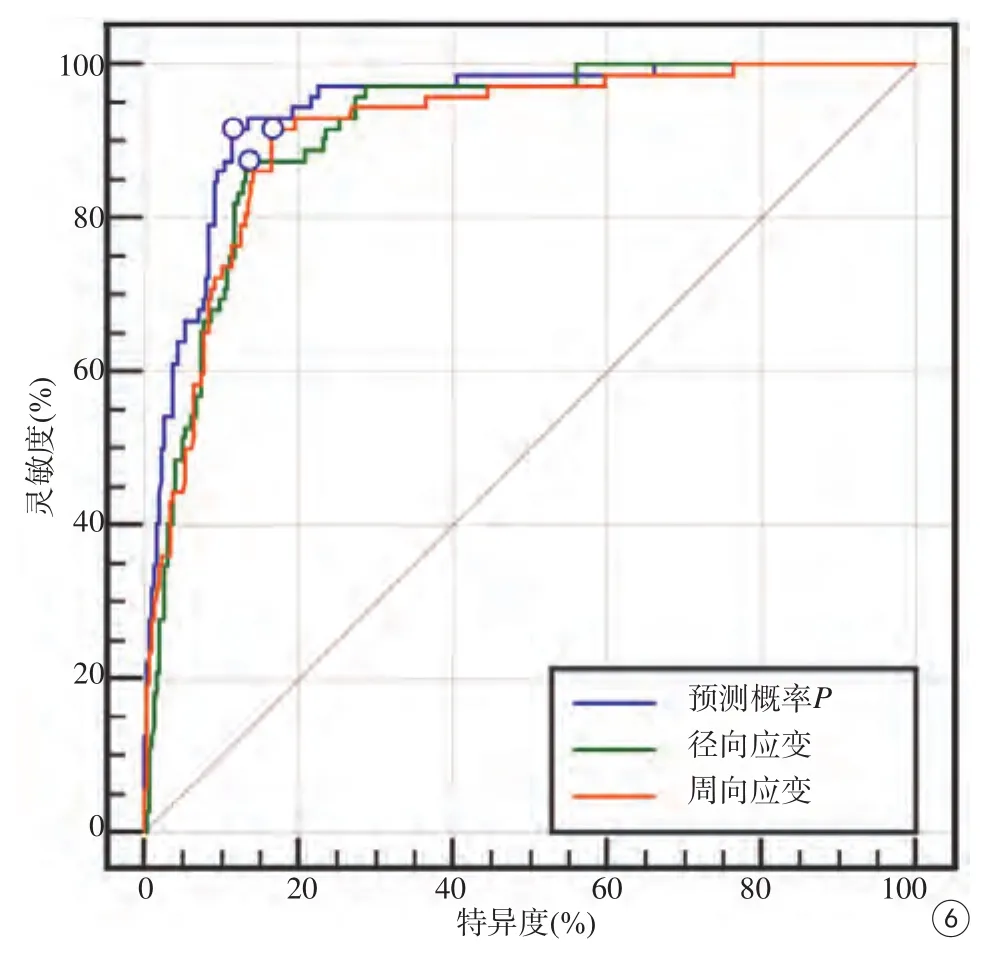
圖6 CMR-TT 3D應變參數獨立或聯合診斷冠心病心肌節段梗死ROC曲線圖。空心圓為與Youden指數對應的截斷值標記點Fig. 6 CMR-TT 3D strain parameter independent or combined diagnosis of CAD myocardial segmental ROC curves. Open circles are cut-off point points corresponding to the Youden index.
2.7 延遲強化節段差異分析
根據正態檢驗結果,對左心室72個LGE陽性心肌節段和296個LGE陰性心肌節段各個方向的3D應變峰值參數進行Wilcoxon秩和檢驗。結果如表4所示,結合實際數據,可認為冠心病組LGE陽性心肌節段徑向應變、周向應變、縱向應變峰值低于LGE陰性心肌節段。
2.8 CMR-TT 3D 應變參數對于冠心病心肌節段梗死的診斷價值評價
單因素ROC分析:根據LGE結果作為心肌梗死的診斷標準,LGE陽性節段72個(32個節段透壁程度>50%),LGE陰性節段296個。將LGE陽性作為因變量Y,先對徑向應變、周向應變、縱向應變三個診斷指標獨立用Logistic回歸模型進行單因素ROC分析。由表5可知,在本試驗中,心肌徑向應變(AUC=0.914)、周向應變(AUC=0.911)在診斷冠心病心肌節段梗死時具有較高的診斷價值;縱向應變(AUC=0.819)具有一定的診斷價值。在本試驗中,當心肌徑向應變截斷值為16.83%時,診斷準確度較高(Youden指數=0.7399);當周向應變截斷值為11.44%時,診斷準確度較高(Youden指數=0.7511);縱向應變在截斷值為9.41%時,診斷準確度較低(Youden指數=0.5552)。
多指標聯合診斷ROC分析:將LGE陽性作為因變量Y,將上述三個指標作為自變量X,根據Logistic回歸結果計算個體預測概率P并進行多指標聯合診斷ROC分析。由表6及回歸方程可知,最終Logistic回歸模型納入了徑向應變(P<0.001)和周向應變(P<0.001)兩個變量,該Logistic回歸模型認為縱向應變(P=0.261)在多指標聯合診斷中無預測意義。由表6及圖6可知,使用徑向應變和周向應變聯合診斷冠心病心肌節段梗死時,AUC和特異度較各指標獨立診斷時提高。
3 討論
3.1 CMR組織追蹤技術臨床應用的可行性及可重復性
心肌應變是一種針對心肌變形的定量測量方式,用來評估心肌段長度變化,應變是一個矢量,正值表示心肌延長增厚,負值表示心肌縮短變薄,通常以百分比表示[10]。目前,幾項研究表明,計算心肌應變的組織追蹤技術在超聲心動圖以及心臟磁共振中具有一定的臨床應用價值和較好的可重復性[11-12]。CMR組織追蹤技術是一種基于SSFP電影序列的后處理技術,可以半自動地追蹤心內膜和心外膜在心動周期的位置,通過軟件的自動分析得到心肌三個方向的應變、應變率、扭轉率、位移和位移速度等量化參數。
本研究測量冠心病組應變參數經可重復性檢驗,由2名不同的放射科醫師測量隨機選出的相同10例患者。徑向應變、周向應變、縱向應變參數在組內相關系數(ICC)檢驗中均表現較好的相關性,提示CMR組織追蹤技術具有良好的可行性及可重復性。
3.2 CMR組織追蹤技術參數值與冠心病左心室功能參數的相關性
左心室射血分數(left ventricular ejection fraction,LVEF)定義為左心室每搏量與左心室舒張末期的比值,它是心功能評價中最基本、最核心的評價指標,也是臨床醫師較為關注的指標。現在,CMR左室射血分數計算已經成為目前所有左心功能檢查技術的金標準[13]。
本研究將CMR左室射血分數作為金標準,與冠心病組應變參數進行相關性分析,得出左心室射血分數與應變參數有較強的相關性(徑向應變r=0.774,周向應變r=0.778,縱向應變r=0.802)。這與Reant等[14]超聲心動圖組織追蹤參數與左心室射血分數相關性分析得出的結論相似(徑向應變r=0.84,周向應變r=0.83,縱向應變r=0.70)。這說明心肌徑向、周向、縱向應變與射血分數有關。
3.3 CMR組織追蹤技術定量化診斷心肌梗死的診斷價值
心內膜和心外膜纖維方向是不同的,這兩者與心肌形變的程度和方向有關。心內膜纖維的收縮導致心肌縱向縮短,而心外膜纖維的收縮導致心肌周向縮短,這兩方面都有助于心肌徑向增厚[15]。冠心病屬于缺血性心肌病,由于冠狀動脈解剖的特殊性,心內膜成為了各支冠狀動脈最遠端的供血區域,冠心病的心肌缺血一般從心內膜心肌開始,逐漸累及到心外膜。所以冠心病早期心肌缺血時主要是縱向應變的減低,并且通過周向應變以及徑向應變的代償增加,使得射血分數保持在正常范圍以內[15]。Ng等[16]使用小劑量多巴酚丁胺超聲心動圖測量冠心病患者應變參數,得到結論為縱向應變在識別存活心肌具有較好的準確度。
磁共振釓對比延遲增強掃描技術是目前檢測梗死心肌的金標準[17],提示心肌細胞死亡,細胞間質容積增加,對比劑排出時間延長。本研究將冠心病72段延遲強化心肌與296段未延遲強化的心肌進行差異分析并進行ROC分析,得到結論為冠心病組LGE陽性心肌節段徑向應變、周向應變、縱向應變峰值低于LGE陰性心肌節段,這說明冠心病LGE陽性梗死心肌相對于冠心病LGE陰性缺血存活心肌和正常心肌,三個方向的應變參數均減低。在診斷價值方面,結論為心肌徑向應變、周向應變對梗死心肌節段診斷價值較高,并得出了相應的節段值,并且徑向應變、周向應變聯合診斷可以提高診斷效能,而縱向應變診斷價值有限。這與Oda等[18]在檢測心臟淀粉樣變疾病LGE陽性節段中心肌應變具有較高的診斷價值的結論相似。這可能是因為在冠心病梗死心肌相對于冠心病缺血存活心肌或正常心肌來說,病變已累及心外膜,故三個方向的應變參數均減低;由于缺血存活心肌和梗死心肌縱向應變均減低,故縱向應變在識別冠心病梗死心肌時,診斷價值有限,而徑向應變、周向應變差異較明顯,故診斷價值較高。
3.4 研究局限性
本研究為對冠心病心肌形變單中心、小樣本的研究;并未對應變參數評價心肌梗死的程度進行探討;只對心肌三個方向的形變參數進行探討,并未對扭轉率以及位移、位移速度等參數進行分析;只對梗死心肌應變進行分析,未對缺血可逆心肌進行應變分析;并未對冠心病右室功能及應變進行分析。
本研究應用基于常規CMR電影序列,通過對冠心病組以及健康人組心肌形變參數進行組織追蹤測量分析,初步探討這項技術定量評價冠心病心肌梗死的診斷價值,并探究此技術臨床應用的可行性和可重復性。由本研究可得到以下結論:(1)心臟磁共振組織追蹤技術在臨床應用中具有較好的可行性及可重復性;(2)徑向應變、周向應變、縱向應變與冠心病左心室功能參數具有較強的相關性;(3)徑向應變、周向應變在診斷冠心病心肌節段梗死的診斷價值較高,縱向應變診斷價值有限。當使用徑向應變和周向應變兩項指標聯合診斷時可提高診斷效能。這提示CMR-TT的應變分析在無需對比劑的情況下識別冠心病心肌梗死節段具有潛在的臨床診斷價值。
心臟磁共振組織追蹤技術目前國內研究較少,未來需要大樣本,大數據對各類心肌疾病進行分析,確定正常值以及診斷閾值,促進該技術對心肌病變的定性、定位、定量診斷。
參考文獻 [References]
[1]Karamitsos T, Dall'Armellina E, Choudhury R, ey al. Ischemic heart disease: comprehensive evaluation by cardiovascular magnetic resonance. Am Heart J, 2011, 162(1): 16-30.
[2]Salerno M, Sharif B, Arheden H, et al. Recent advances in cardiovascular magnetic resonance: techniques and applications. Circ Cardiovasc Imaging, 2017, 10(6): e003951.
[3]Claus P, Omar A, Pedrizzetti G, et al. Tissue tracking technology for assessing cardiac mechanics: principles, normal values, and clinical applications. JACC Cardiovasc Imaging, 2015, 8(12): 1444-1460.
[4]Hwang J, Kim S, Park S, et al. Assessment of reverse remodeling predicted by myocardial deformation on tissue tracking in patients with severe aortic stenosis: a cardiovascular magnetic resonance imaging study. J Cardiovasc Magn Reson, 2017, 19(1): 80.
[5]Williams L, Forero J, Popovic Z, et al. Patterns of CMR measured longitudinal strain and its association with late gadolinium enhancement in patients with cardiac amyloidosis and its mimics. J Cardiovasc Magn Reson, 2017, 19(1): 61.
[6]Abbasi S, Ertel A, Shah R, et al. Impact of cardiovascular magnetic resonance on management and clinical decision-making in heart failure patients. J Cardiovasc Magn Reson, 2013, 15: 89.
[7]Bourfiss M, Vigneault D, Aliyari Ghasebeh M, et al. Feature tracking CMR reveals abnormal strain in preclinical arrhythmogenic right ventricular dysplasia/ cardiomyopathy: a multisoftware feasibility and clinical implementation study. J Cardiovasc Magn Reson,2017,19(1): 66.
[8]Kramer C, Barkhausen J, Flamm S, et al. Standardized cardiovascular magnetic resonance (CMR) protocols 2013 update. J Cardiovasc Magn Reson, 2013, 15: 91.
[9]Cerqueira M, Weissman N, Dilsizian V, et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Int J Cardiovasc Imaging, 2002,18(1): 539-542.
[10]Mirea O, Duchenne J, Voigt J. Recent advances in echocardiography:strain and strain rate imaging. F1000 Research, 2016, 5(F1000 Faculty Rev): 787.
[11]Schmidt B, Dick A, Treutlein M, et al. Intra- and inter-observer reproducibility of global and regional magnetic resonance feature tracking derived strain parameters of the left and right ventricle. Eur J Radiol, 2017, 89: 97-105.
[12]Yingchoncharoen T, Agarwal S, Popovi? Z, et al. Normal ranges of left ventricular strain: a meta-analysis. J Am Soc Echocardiogr, 2013,26(2): 185-191.
[13]Rigolli M, Anandabaskaran S, Christiansen J, et al. Bias associated with left ventricular quantification by multimodality imaging: a systematic review and meta-analysis. Open Heart, 2016, 3(1):e000388.
[14]Reant P, Barbot L, Touche C, et al. Evaluation of global left ventricular systolic function using three-dimensional echocardiography speckle-tracking strain parameters. J Am Soc Echocardiogr, 2012, 25(1): 68-79.
[15]Sengupta P, Tajik A, Chandrasekaran K, et al. Twist mechanics of the left ventricle: principles and application. JACC Cardiovasc Imaging,2008, 1(3): 366-376.
[16]Ng A, Sitges M, Pham P, et al. Incremental value of 2-dimensional speckle tracking strain imaging to wall motion analysis for detection of coronary artery disease in patients undergoing dobutamine stress echocardiography. Am Heart J, 2009, 158(5): 836-844.
[17]Carlsson M, Arheden H, Higgins C, et al. Magnetic resonance imaging as a potential gold standard for infarct quantification. J Electrocardiol, 2008, 41(6): 614-620.
[18]Oda S, Utsunomiya D, Nakaura T, et al. Identification and assessment of cardiac amyloidosis by myocardial strain analysis of cardiac magnetic resonance imaging. Circ J, 2017, 81(7): 1014-1021.

