福莫特羅對急性馬兜鈴酸腎病的保護作用及機制*
★ 劉新輝 李順民(深圳市中醫院腎病科 廣東 深圳 518033)
馬兜鈴酸腎病(aristolochic acid nephropathy,AAN)是攝入含有馬兜鈴酸類成分中草藥而導致的腎小管間質疾病[1]。最近中國國家慢性腎臟病調查工作組橫斷面問卷調查結果顯示:1.5%的中國成人長期服用含馬兜鈴酸類中草藥。長期服用含馬兜鈴酸中草藥與慢性腎臟病發生獨立相關[2]。新近研究證實馬兜鈴酸亦是影響多瑙河流域巴爾干腎病的致病因素[3]。由于受影響的地域及人群廣泛,AAN已成為全球性的公共衛生問題[4]。然而,目前仍缺乏有效治療AAN的藥物。
近端腎小管上皮細胞是馬兜鈴酸腎損傷的首要靶點,其功能的維持極度依賴于線粒體[5]。新近的研究發現β2腎上腺素受體激動劑福莫特羅可以通過過氧化物酶體增殖物活化受體γ共激活因子 -1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)信號通路增加線粒體生物合成,從而有助于缺血再灌注引起的急性腎損傷的恢復[6]。然而,福莫特羅能否基于其對PGC-1α信號通路的調節作用而對AAN發揮治療作用,目前尚無相關報道。本研究擬通過小鼠急性AAN模型探討福莫特羅對急性AAN的保護作用及可能機制。
1 材料
1.1 動物 24只8周齡雄性C57BL/6小鼠,體重18~22g,購自廣東省醫學實驗動物中心(生產許可證:SCXK(粵)2013-0002)。每日12h照明,飼養溫度20℃~25℃,濕度50%~70%。自由攝水、飲食。
1.2 試劑 馬兜鈴酸I(AAI)及福莫特羅(formoterol)均購自Sigma-Aldrich公司;組織DNA提取試劑盒QIAamp DNA Mini Kit(QIAGEN公司);引物序列(life technologies公司);SYBR Green(Roche公司)。細胞色素C氧化酶亞基I(COX-I)(abcam公司);PGC-1α(Santa Cruze公司);β-actin(Sigma公司);二抗(CST公司)。
1.3 儀器 全自動生化分析儀(Roche);石蠟包埋機、切片機(Leica);普通光學顯微鏡(Nikon);熒光定量PCR儀(Life Tech);全自動凝膠成像和化學發光圖像分析系統:ChemiDocTM MP Imaging System(Bio-Rad Laboratories);垂直電泳儀、轉膜儀(Bio-Rad)。
2 方法
2.1 動物分組、造模及給藥方法 24只小鼠根據體重隨機分為4組:正常對照組、正常+福莫特羅組、模型組、模型+福莫特羅組,每組6只。造模方法為腹腔注射 AAI 5mg/kg/d,持續 5d[7]。急性AAN的造模依據為突發的腎功能急劇下降。在本研究中我們采用血肌酐及尿素氮水平的顯著升高作為造模成功的指標。根據前期研究基礎,我們采用該方法制備急性AAN模型的成功率在90%以上。福莫特羅給藥方法為造模前2天開始給藥,劑量為0.3mg/kg/d,共給藥7d。殺檢后留取血清及腎臟標本。
2.2 尿素氮(BUN)、血肌酐(Scr)測定 采用全自動生化分析儀測定。
2.3 腎臟病理檢測 石蠟切片行PAS染色。腎臟病理損傷根據腎小管上皮細胞壞死、刷狀緣脫落、管型及小管擴張的綜合比例進行評分。0分=無以上改變;1分=以上改變<10%;2分=以上改變11%-25%;3分=以上改變26%-45%;4分=以上改變46%-75%;5分=以上改變>76%[8]。
2.4 PCR 按照QIAamp DNA Mini Kit試劑盒說明書要求提取腎臟皮質總DNA。取2μL DNA樣品于NanoDrop 1000紫外分光光度計檢測260nm處吸光值,依據所測DNA濃度,設定一定體積V,換算后用DEPC水配成同一濃度備用。引物序 列 如 下:mtDNA forward 5'-TTTTATCTGCATCT GAGTTTAATCCTGT-3' and reverse 5'-CCACTTC ATCTTACCATTTATTATCGC-3';18S rRNA forward 5'-GGACCTGGAACTGGCAACAT-3' and reverse 5'-GCCCTGAACTCTTTTGTGAAG-3'。反應條件為:95℃ 10min→95℃ 15sec→60℃ 1min 循環40次。采用內參DNA片段表達ΔCt法計算目的DNA片段的表達,反映mtDNA拷貝數的相對定量。
2.5 蛋白印記 提取各組小鼠腎臟皮質蛋白并測濃度,將等量的蛋白加入上樣孔中依次進行電泳、轉膜、5%脫脂奶粉室溫封閉60min;孵育一抗、二抗,曝光顯影,圖像分析。
2.6 統計學方法 結果以均數±標準差表示。組間比較采用單因素方差分析(One-way ANOVA),并進行兩兩比較。所有檢驗應用SPSS16.0統計軟件進行分析,P<0.05為差異有統計學意義。
3 結果
3.1 各組小鼠BUN、Scr水平比較 模型組小鼠BUN及Scr顯著升高(P<0.01)。經福莫特羅治療后AAN小鼠BUN及Scr均有一定程度的下降(P<0.05,P<0.01)。結果見圖1。以上結果提示急性AAN造模成功;福莫特羅可顯著改善AAN小鼠腎功能。
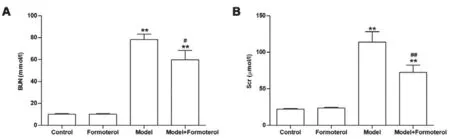
圖1 各組小鼠BUN(A)及Scr(B)水平
3.2 腎臟病理改變 由圖2(A)可見,模型組小鼠腎臟病理表現為腎小管上皮細胞壞死、脫落,刷狀緣丟失,管型及腎小管擴張。福莫特羅治療組以上損傷均有所恢復。腎臟病理評分與PAS染色相符(圖2B)。以上結果提示福莫特羅可顯著改善AAN小鼠腎臟病理損傷。

圖2 各組小鼠腎臟病理改變(A)及評分(B)
3.3 線粒體生物合成 由圖3(A)所示,模型組小鼠腎臟線粒體DNA拷貝數顯著下降(P<0.01),而福莫特羅治療組則有所恢復(P<0.05)。進一步的分析發現,模型組小鼠腎臟PGC-1α及COX-I表達顯著下調,而經福莫特羅治療后可顯著恢復其表達(P<0.01)(圖3B-D)。以上結果提示AAN小鼠腎臟線粒體數量下降,可能與PGC-1α信號通路有關。
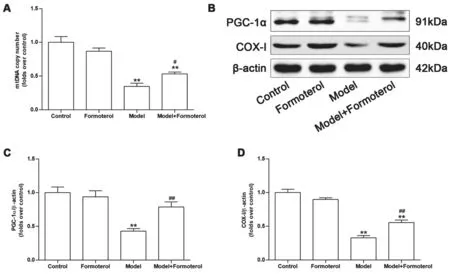
圖3 各組小鼠線粒體生物合成改變
4 討論
本研究采用AAI誘導C57BL/6小鼠發生急性AAN,并探討福莫特羅的干預作用及可能機制。結果表明,AAI 5 mg/kg/d持續腹腔注射5天可以引起急性AAN,表現為BUN及Scr的顯著升高及腎臟病理損傷。AAN小鼠腎臟線粒體數量下降,線粒體合成的關鍵蛋白表達下調。福莫特羅治療可顯著改善AAN小鼠的腎功能及病理損傷,并可上調線粒體生物合成。
福莫特羅是一種長效的特異性β2腎上腺素受體激動劑。最近的研究發現,福莫特羅可以增加小鼠骨骼肌細胞中PGC-1α mRNA的表達。而且,鍛煉誘導的PGC-1α mRNA增加可以被預處理β2腎上腺素受體拮抗劑所抑制,提示β2腎上腺素受體激活介導了鍛煉誘導的骨骼肌PGC-1α表達的增加[9]。由于PGC-1α是線粒體生物合成的關鍵蛋白,因此福莫特羅可以增加線粒體生物合成[10-11]。本研究中AAN小鼠腎臟線粒體PGC-1α及線粒體生物合成均顯著下調,而福莫特羅治療后可上調PGC-1α、增加線粒體呼吸復合體亞基的表達及線粒體DNA拷貝數。該實驗結果與Jesinkey等的研究相一致,其研究表明福莫特羅可以通過PGC-1α-線粒體生物合成改善缺血再灌注引起的小鼠急性腎損傷[6]。
綜上所述,本研究結果提示福莫特羅可以有效改善AAI誘導的急性AAN,其機制可能與促進線粒體生物合成有關。該研究提示針對PGC-1α信號通路調節線粒體生物合成可作為AAN的治療靶點。
[1]劉新輝,陽曉.馬兜鈴酸腎病:一個仍需重視的問題[J].中國中西醫結合雜志, 2013, 33(4):585-589.
[2]Zhang J, Zhang L, Wang W, et al. Association between aristolochic acid and CKD: a cross-sectional survey in China [J]. Am J Kidney Dis, 2013,61(6):918-922.
[3]G?kmen MR, Lord GM. Aristolochic acid nephropathy [J]. BMJ, 2012,344:e4000.
[4]Grollman AP. Aristolochic acid nephropathy: Harbinger of a global iatrogenic disease [J]. Environ Mol Mutagen, 2013, 54(1):1-7.
[5]Pozdzik AA, Salmon IJ, Debelle FD, et al. Aristolochic acid inducesproximal tubule apoptosis and epithelial to mesenchymal transformation [J]. Kidney Int, 2008, 73(5):595-607.
[6]Jesinkey SR, Funk JA, Stallons LJ, et al. Formoterol restores mitochondrial and renal function after ischemia-reperfusion injury [J]. J Am Soc Nephrol, 2014, 25(6):1 157-1 162.
[7]Wu J, Liu X, Fan J, et al. Bardoxolone methyl (BARD) ameliorates aristolochic acid (AA)-induced acute kidney injury through Nrf2 pathway [J]. Toxicology, 2014, 318(1):22-31.
[8]He Z, Lu L, Altmann C, et al. Interleukin-18 binding protein transgenic mice are protected against ischemic acute kidney injury [J]. Am J Physiol Renal Physiol, 2008, 295(5):F1 414–F1 421.
[9]Sutherland LN, Bomhof MR, Capozzi LC, et al. Exercise and adrenaline increase PGC-1{alpha} mRNA expression in rat adipose tissue [J]. J Physiol, 2009, 587(7):1 607-1 617.
[10]Wills LP, Trager RE, Beeson GC, et al. The β2-adrenoceptor agonist formoterol stimulates mitochondrial biogenesis [J]. J Pharmacol Exp Ther, 2012, 342(1):106-118.
[11]Peterson YK, Cameron RB, Wills LP, et al. β2-Adrenoceptor agonists in the regulation of mitochondrial biogenesis [J]. Bioorg Med Chem Lett,2013, 23(19):5 376-5 381.

