重組分泌型腫瘤壞死因子相關凋亡誘導配體腺病毒對PC-3細胞荷瘤鼠瘤體的生長抑制
高磊 潘鐵軍 謝鳴 蔣淵 喻希 李想
中國人民解放軍武漢總醫院泌尿外科(武漢 430070)
腫瘤壞死因子相關凋亡誘導配體(tumor necrosis factor related apoptosis inducing ligand,TRAIL)被發現后,經過不斷研究證實其在細胞凋亡中發揮重要作用。TRAIL能誘導多種腫瘤細胞的凋亡,被認為是一種很有前途的抗癌分子。我們前期成功構建了表達分泌型TRAIL基因的腺病毒載體Ad-sTRAIL,并且在體外實驗中證實了Ad-sTRAIL可以抑制前列腺癌細胞增殖,促進腫瘤細胞凋亡。本研究試圖探討Ad-sTRAIL的體內抗腫瘤作用。
1 材料與方法
1.1 材料與分組
1.1.1 人前列腺癌細胞株 PC-3購于中國科學院上海細胞庫。Ad-LacZ病毒,Ad-sTRAIL病毒均由本科構建保存。鼠抗人TRAIL單克隆抗體及兔抗鼠熒光素標記二抗均購自Santa公司。新生牛血清購于北京四季青生物技術公司;RPMI 1640細胞培養基(Gibco BRL公司)。DAPI染色液購于Beyotime公司。TUNEL檢測試劑盒購于Roche公司。本研究起止時間為2015年3月至2016年10月。
1.1.2 分組 Control組:常規培養的PC-3細胞;Ad-LacZ組:40 MOI的Ad-LacZ感染的PC-3細胞;Ad-sTRAIL組:40 MOI的Ad-sTRAIL感染的PC-3細胞。
1.2 方法
1.2.1 DAPI染色檢測細胞凋亡 高壓消毒后無菌蓋玻片置于24孔板中,取細胞濃度5×105/mL,每孔300 μL,接種后每24小時分別以40 MOI的Ad-LacZ和Ad-sTRAIL感染相應分組細胞,繼續常規培養48 h。以4%多聚甲醛固定爬片,經0.1%Triton PBS作用5 min,0.01 mol/L PBS溶液洗滌,滴加DAPI染液染色10 min,流水沖去染液,濾紙吸除多余水分,加一滴熒光封片液,熒光顯微鏡觀察并拍照。
1.2.2 Transwell實驗 采用孔徑為8 μm的24孔Borden小室(美國BD公司)進行實驗。先用無血清培養液沖洗小室上室2次,然后加入1∶8稀釋的Matrigel膠(美國BD公司)50 μL,37℃孵育30 min制作人工基底膜。以無血清培養基調整細胞密度為2 × 105個/mL,上室加入細胞懸液200 μL,下室加入600 μL含10%胎牛血清的培養液,37℃培養72 h后以Giemsa染色觀察穿入下室面的細胞數。
1.2.3 體內抗腫瘤實驗 PC-3細胞接種于雄性BALB/c裸鼠右側腋窩皮下(第四軍醫大學實驗動物中心提供)。待瘤塊長至足夠大時,取新鮮腫瘤組織在生理鹽水中剪成3 mm×3 mm×3 mm大小的小塊接種裸鼠右側背部,選取荷瘤成功的裸鼠18只;隨機分為3組,每組6只,分別為對照組、Ad-LacZ組和Ad-sTRAIL組。實驗開始后7、14 d給藥,共給藥2次。每3天測量1次瘤體的長徑(a)和短徑(b),按腫瘤體積V=a×b2/2。共觀察21 d,依據腫瘤體積計算腫瘤抑瘤率(%)=1-實驗組腫瘤體積/對照組腫瘤體積。
1.2.4 荷瘤組織免疫組化 4%多聚甲醛固定,制作蠟塊、切片、貼片;用二甲苯浸洗2次,每次5 min;用梯度乙醇(100%、95%、90%、80%、70%)各浸洗1次,每次3 min。PBS清洗;加入0.3%的過氧化氫甲醇溶液30 min,PBS清洗5 min×3;0.3%Triton×100處理30 min,PBS清洗5 min×3。加入1∶500稀釋的鼠抗人TRAIL單克隆抗體,4℃存放24 h;吸去抗體,PBS清洗5 min×3。加入PBS稀釋的以生物素標記的兔抗鼠二抗,室溫孵育2 h。PBS清洗5 min×3。加入ABC復合物,室溫孵育2 h,PBS清洗5 min×3;蒸餾水迅速沖3次。加入DAB顯色10 min,用蒸餾水迅速沖洗,蘇木素復染30 s;梯度酒精脫水之后,封片,拍照。
1.2.5 荷瘤組織TUNEL染色 4%多聚甲醛固定,制作蠟塊、切片、貼片;用二甲苯及梯度乙醇;PBS漂洗3次;用Proteinase K工作液處理組織15 min在37℃;PBS漂洗3次;加50 μL TUNEL反應混合液于標本上,加蓋玻片反應37℃×1 h。PBS漂洗3次;加50 μL converter-POD于標本上,加蓋玻片反應37℃×30 min。PBS漂洗3次;在組織處加100 μL DAB底物,反應25℃×10 min;PBS漂洗3次;拍照后再用蘇木素復染30 s。梯度酒精脫水之后,封片,拍照。
1.3 統計學方法 采用SPSS 18.0進行統計學分析,結果中定量數據用±s表示,均數間的兩兩比較采用SNK-q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 DAPI染色 Ad-sTRAIL組腫瘤細胞凋亡水平明顯高于Control組和Ad-LacZ組。Ad-sTRAIL組腫瘤細胞出現皺縮,胞漿致密,核染色質邊集,并且胞核裂解,形成含核碎片和細胞器成份的凋亡小體(圖1)。
2.2 TranswellAd-sTRAIL組穿入下室面的細胞數(24.8±3.70)明顯少于對照組(47.6±4.28,q=10.68,P<0.01)及Ad-LacZ組(49.6±4.39,q=11.61,P<0.01)。見圖2。
2.3 體內抗腫瘤實驗 與Control組和Ad-LacZ組的細胞相比,Ad-sTRAIL組的荷瘤鼠腫瘤生長能力顯著降低(圖3)。經計算后可見Ad-sTRAIL對荷瘤鼠腫瘤的抑制率3 d為8.15%(P<0.05),6 d為11.55%(P<0.01),9 d為17.23%(P<0.01),12 d為20.05%(P<0.01),15 d為27.18%(P<0.01),18 d為34.27%(P<0.01),21 d為33.08%(P<0.01),隨時間抑制作用逐漸增強。
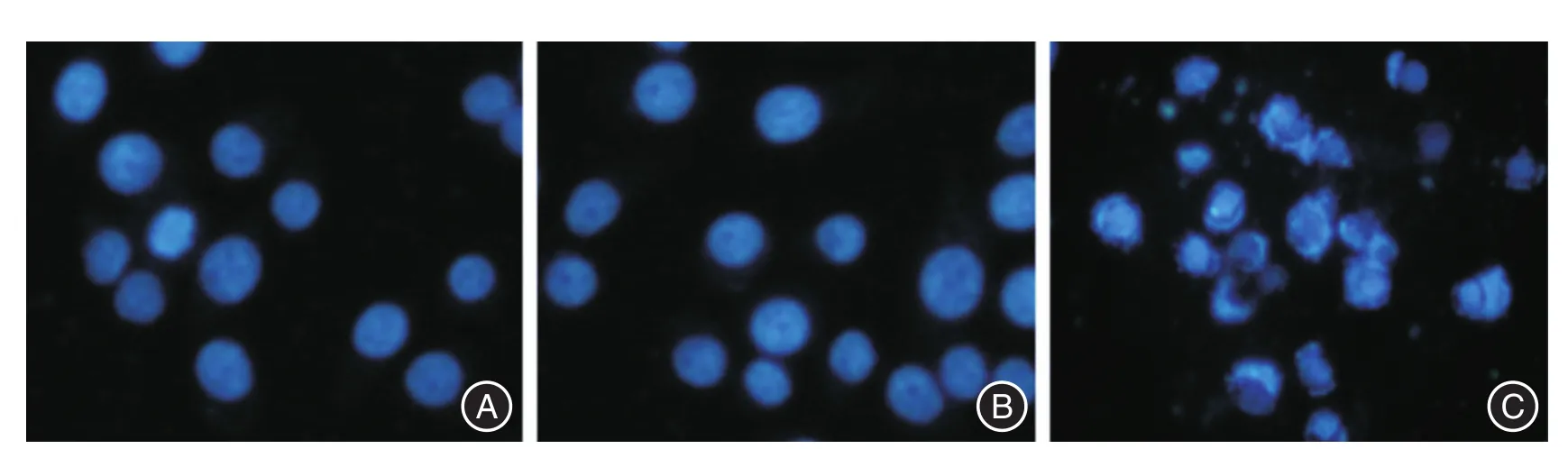
圖1 Ad-sTRAIL對PC-3細胞凋亡的影響(×200)Fig.1 The effects of Ad-sTRAIL on PC-3 cells apoptosis(× 200)
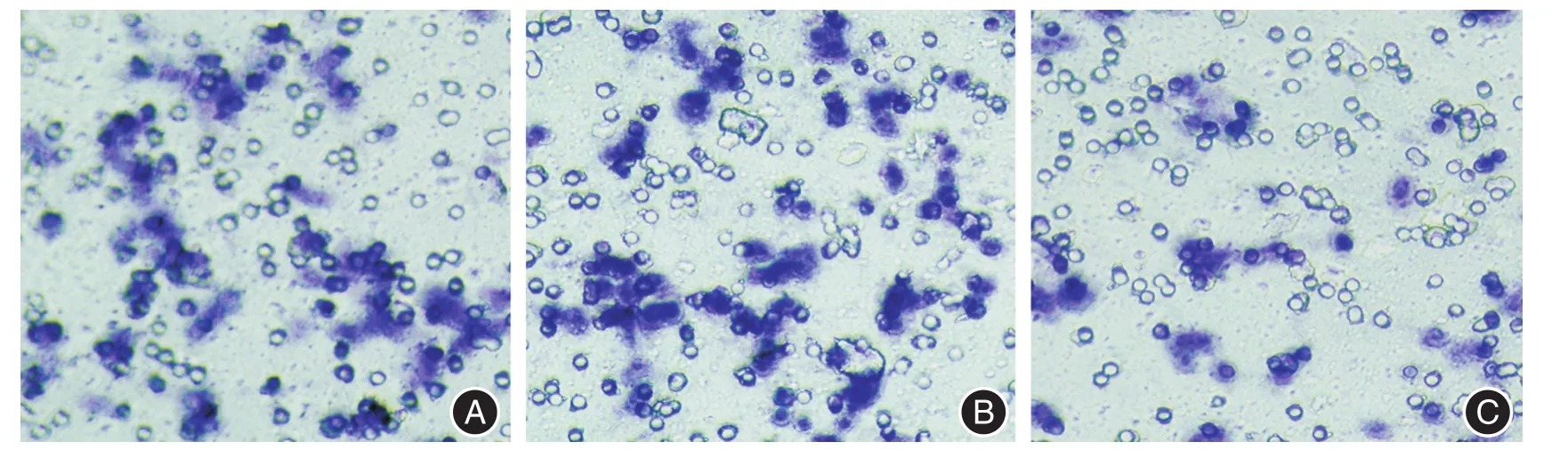
圖2 Ad-sTRAIL對PC-3細胞侵襲能力的影響(×200)Fig.2 The effects of Ad-sTRAIL on PC-3 cells invasion(× 200)
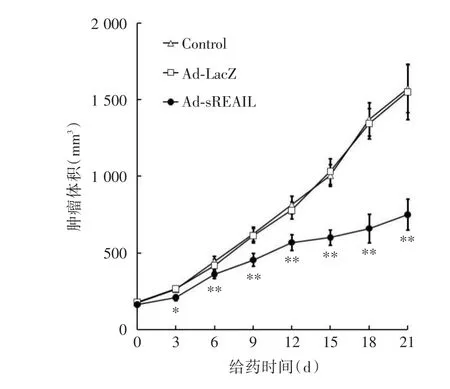
圖3 Ad-sTRAIL對荷瘤鼠腫瘤增殖能力的影響Fig.3 The effects of Ad-sTRAIL on the tumor proliferation of tumor-bearing mice
2.4 免疫組化實驗 Ad-sTRAIL組荷瘤鼠腫瘤組織中TRAIL表達水平明顯高于Control組和Ad-LacZ組(圖4)。TUNEL實驗顯示:Ad-sTRAIL組荷瘤鼠腫瘤細胞核染色明顯,表明該組細胞凋亡水平明顯高于Control組和Ad-LacZ組(圖5)。
3 討論
前列腺癌是男性生殖系統常見的惡性腫瘤。在北美和歐洲國家中,前列腺癌為男性的第二大惡性腫瘤,在我國的發病率也有明顯增加的趨勢[1]。目前,對于伴發轉移的難治性前列腺癌主要的治療方法是化療。但由于前列腺癌屬于對化療不敏感的腫瘤,并常產生耐藥性,所以常規化療很難達到令人滿意的治療效果。隨著對腫瘤發病機制的不斷研究,基因治療已成為前列腺癌治療的重要方法[2]。
TRAIL是腫瘤壞死因子家族的新成員,其可誘導腫瘤細胞發生凋亡等,但對正常的細胞卻無影響[3]。有研究表明:TRAIL可以抑制人肺癌細胞的增殖,促進腫瘤細胞凋亡;并且當TRAIL與格列吡嗪聯合應用時可以發揮更好的抗腫瘤效果[4]。同時,TRAIL在小細胞肺癌和肝癌中發揮重要作用,其主要是通過活化Caspase-8達到促進腫瘤細胞凋亡的效果。但TRAIL的促凋亡作用可被DNA損傷誘導凋亡抑制因子(DNA damage-induced apoptosis suppressor,DDIAS)減弱[5]。此外,TRAIL可與結腸癌細胞中的死亡受體結合,活化Fas相關的死亡結構域蛋白(Fas associated death domain protein,FADD),從而促進結腸癌細胞凋亡。并且,TRAIL與熱休克蛋白90(heat shock protein 90,Hsp90)聯合應用可以進一步增強其促凋亡作用[6]。大量研究表明TRAIL可以誘導多種腫瘤細胞凋亡[7]。作為腫瘤壞死因子家族TNF相關的凋亡誘導配體,TRAIL可與死亡受體(TRAIL-R1和TRAIL-R2)結合,激活Caspase信號通路,進而引起細胞凋亡。TRAIL-R2在前列腺癌中高表達,特別是晚期前列腺癌[8]。因此前列腺癌細胞對TRAIL反應敏感,所以構建表達TRAIL的腺病毒用于治療前列腺癌存在理論基礎[9]。本研究成功構建了表達分泌型TRAIL基因的腺病毒載體Ad-sTRAIL;并以該載體感染前列腺癌細胞株PC-3,結果表明經Ad-sTRAIL感染組腫瘤細胞凋亡水平明顯增加;同時Ad-sTRAIL還抑制了PC3細胞的侵襲能力。TRAIL蛋白表達水平增加導致其與死亡受體結合增加,誘導胞內死亡結構域變構,從而催化裂解Caspase-8前體,激活形成活化型Caspase-8,進一步放大凋亡信號以誘導細胞死亡。進一步的實驗也驗證了這一結論,DAPI染色顯示Ad-sTRAIL感染前列腺癌細胞后,腫瘤細胞凋亡水平顯著提升,出現皺縮,胞漿致密,核染色質邊集,并且胞核裂解,形成含核碎片和細胞器成份的凋亡小體。另外,Transwell試驗結果顯示Ad-sTRAIL感染后細胞侵襲轉移的能力明顯降低。進一步荷瘤鼠實驗表明,Ad-sTRAIL組的荷瘤鼠腫瘤生長能力顯著降低,證明Ad-sTRAIL在體內亦能發揮抑制腫瘤生長的作用。免疫組化實驗及TUNEL實驗證實,荷瘤鼠腫瘤組織中TRAIL表達水平的增加導致了腫瘤細胞凋亡水平的增加。
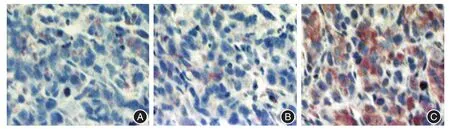
圖4 TRAIL蛋白在3組荷瘤鼠腫瘤組織中的表達(×200)Fig.4 The expression of TRAIL protein in tumors of three groups tumor-bearing mice(× 200)
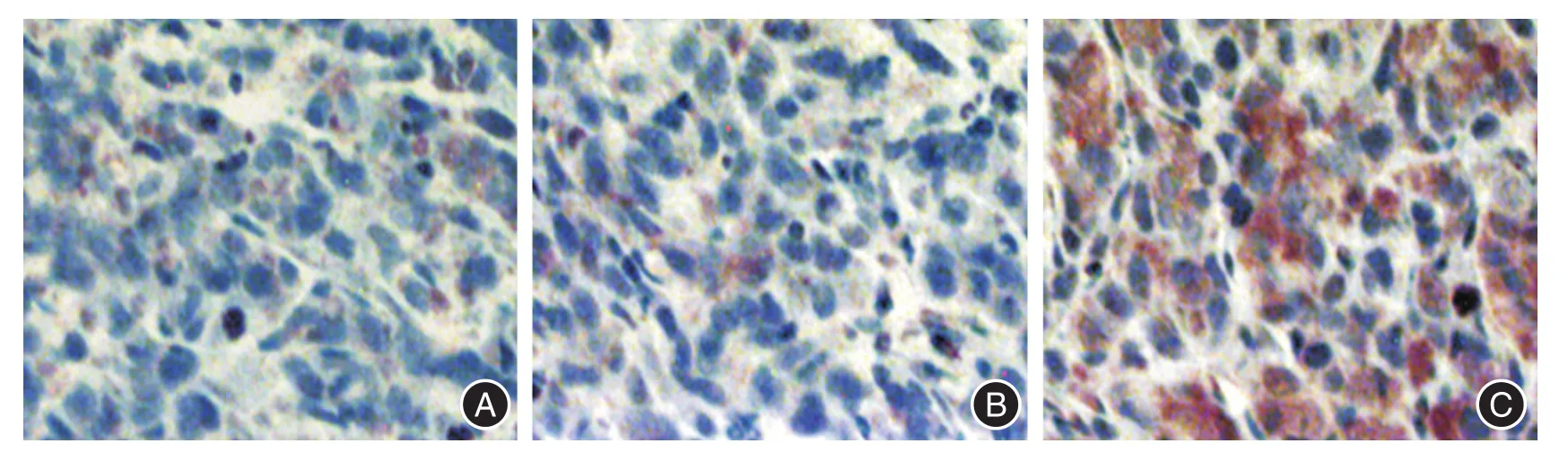
圖5 Ad-sTRAIL對3組荷瘤鼠腫瘤細胞凋亡的影響(×200)Fig.5 The effects of Ad-sTRAIL on tumor cells apoptosis of three groups tumor-bearing mice(× 200)
綜上所述,通過提高TRAIL的表達在體內外均可以抑制PC-3細胞增殖,促進細胞凋亡;其具體機制可能是通過增加前列腺癌細胞中TRAIL的表達來活化Caspase-3和Caspase-8達到促進前列腺癌細胞凋亡的作用。本研究成功在體內實驗中驗證了Ad-sTRAIL抗腫瘤效果,為下一步的臨床抗腫瘤研究奠定了基礎。
[1]韓蘇軍,張思維,陳萬青,等.中國前列腺癌發病現狀和流行趨勢分析[J].臨床腫瘤學雜志,2013,18(4):330-334.
[2]高磊,劉學武,劉新平,等.腺病毒介導的NDRG2基因對前列腺癌細胞株DU145的影響[J].實用醫學雜志,2010,26(7):1097-1099.
[3]CHEN J X,YANG B Y,ChENG X W,et al.Salmonella-mediated tumor-targeting TRAIL gene therapy significantly suppresses melanoma growth in mouse model[J].Cancer Sci,2012,103(2):325-333.
[4]NAZIM U M,MOON J H,LEE Y J,et al.Glipizide sensitizes lung cancer cells to TRAIL-induced apoptosis via Akt/mTOR/autophagy pathways[J].Oncotarget,2017,8(59):100021-100033.
[5]KIM B K,LEE J Y,PARK S H,et al.DDIAS suppresses TRAIL-mediated apoptosis by inhibiting DISC formation and destabilizing Caspase-8 in cancer cells[J].Oncogene,2017,10(15):1038-1046.
[6]YAO Z C,CHEN A,LI X,et al.Hsp90 inhibitor sensitizes TRAIL-mediated apoptosis via chop-dependent DR5 upregulation in colon cancer cells[J].Am J Transl Res,2017,9(11):4945-4953.
[7]LYSE A N,BRITNIE R J,THOMAS S G.Advances in viral vector-based TRAIL gene therapy for cancer[J].Cancers,2011,3(1):603-620.
[8]HESRY V,PIQUET-PELLORCE C,TRAVERT M,et al.Sensitivity of prostate cells to TRAIL-induced apoptosis increases with tumor progression:DR5 and Caspase 8 are key players[J].Prostate,2006,66(9):987-995.
[9]YU R,MANDLEKAR S,RUBEN S,et al.Tumor necrosis factor-related apoptosis-inducing ligand-mediated apoptosis in androgen-independent prostate cancer cells[J].Cancer Res,2000,60(9):2384-2389.

