不同稀酸制備革蘭氏陽性增強基質(GEM)顆粒的比較
李鵬成, 張曉燕, 2, 喬緒穩, 鄭其升, 侯繼波
(1.江蘇省農業科學院動物免疫工程研究所,國家獸用生物制品工程研究中心,江蘇 南京 210014; 2. 山西運城農業職業技術學院,山西 運城 044000)
有研究基于革蘭氏陽性細菌乳酸乳球菌(Lactococcuslactis)形成的非活性食品級外殼顆粒,研制了一種抗原展示系統[1],即乳酸乳球菌外殼-蛋白錨定系統[2-3]。這種外殼顆粒被稱之為革蘭氏陽性增強基質(GEM)顆粒,其實就是細菌去除蛋白、核酸等物質后的一種球形肽聚糖基質骨架。GEM抗原展示系統,由食品級遺傳元件組成,十分安全。此外,該系統不需要對抗原進行純化,極大降低了制造成本,并可用于多種非蛋白源和蛋白源的抗原展示,是一種優異的抗原載運系統。目前,通過該系統研制的抗原在多個動物疾病模型中能夠有效地激發機體的免疫保護,成功展示的有:肺炎鏈球菌保護性抗原SlrA[2]、瘧原蟲的保護性抗原MSA2[4]和鼠疫耶爾森菌保護性抗原LcrV[5]等。
GEM顆粒作為GEM抗原展示系統的重要組成部分,其質量直接影響抗原的展示效率。關于GEM的制備,國內外未見深入報道。本研究擬通過比較不同稀酸處理制備GEM顆粒的效果,優化GEM顆粒的制備條件,主要對不同濃度的同種稀酸以及不同稀酸處理制備GEM顆粒的得率(計數)、蛋白去除率(SDS-PAGE)、與錨鉤蛋白(PA)的親和活性(SDS-PAGE)進行比較。此外,本試驗還擬對GEM顆粒4 ℃下的保存期和冷凍干燥后的保存期進行研究,以期為完善乳酸乳球菌外殼-蛋白錨定系統,尤其是制備高質量的GEM顆粒提供依據。
1 材料與方法
1.1 材料
1.1.1 菌株 乳酸乳球菌MG1363由本實驗室保存。
1.1.2 主要試劑和儀器 GM17液體培養基(葡萄糖5.00 g/L、植物蛋白胨5.00 g/L、聚蛋白胨5.00 g/L、牛肉膏2.50 g/L、酵母粉2.50 g/L、β-磷酸甘油二鈉19.00 g/L、抗壞血酸0.50 g/L、MgSO4·7H2O 0.25 g/L,加雙蒸水至1 L,調節pH值為7.1,115 ℃高壓滅菌備用)、鹽酸(HCl)、硫酸(H2SO4)、三氯乙酸(TCA)均購自國藥集團,戊二醛、丙稀酰胺、甲叉雙丙稀酰胺、十二烷基硫酸鈉(SDS)、甘氨酸、過硫酸銨均購自南京生興生物技術有限公司,蛋白分子量Marker購自Thermo Scientific公司,BCA蛋白定量試劑盒購自碧云天生物技術研究所,YK-HELBER細菌計數板購自北京卓川電子科技有限公司,錨鉤蛋白(PA)由本實驗室克隆表達獲得。
1.2 乳酸乳球菌MG1363培養
乳酸乳球菌MG1363劃線接種GM17平板,30 ℃培養 16~20 h,挑取單菌落接種新鮮GM17培養基,30 ℃靜止培養 16~20 h,備用。
1.3 不同稀酸處理制備GEM顆粒
新鮮擴大培養的乳酸乳球菌MG1363,12 000 r/min離心10 min,室溫無菌離心,收集菌體,滅菌純水洗滌1遍,然后用1/5體積0.200 0 mol/L、0.100 0 mol/L、0.050 0 mol/L、0.025 0 mol/L的HCl(pH=1),1.200 0 mol/L、0.600 0 mol/L、0.300 0 mol/L、0.015 0 mol/L的TCA(pH=1),0.100 0 mol/L、0.050 0 mol/L、0.025 0 mol/L、0.012 5 mol/L的H2SO4重懸(pH=1),煮沸30 min,離心去酸液,磷酸鹽緩沖液(PBS)洗滌3次,最后一次用1/10體積的PBS重懸計數,2.5×109個顆粒為1 U。
1.4 GEM顆粒蛋白質去除效率
將不同稀酸處理的GEM顆粒調整至同一基數,經SDS-PAGE定性分析。同時定量分析比較不同稀酸處理得到的GEM顆粒蛋白質去除效率,分別收集不同稀酸煮沸的上清液,12 000 r/min離心3 min,熱酸處理后上清液的pH調至7左右,用BCA蛋白質檢測試劑盒進行蛋白質濃度測定分析。
1.5 不同稀酸制備的GEM與PA錨定活性
為了對結合蛋白進行較為準確的定量分析,首先,分別將1 U的GEM顆粒和過量的PA在室溫下孵育30 min,12 000 r/min離心5 min,收集沉淀,PBS洗滌2次,然后用10%的SDS高溫煮沸結合后的沉淀,使蛋白從顆粒上解離下來,離心收集上清液進行定量分析。具體方法如下:取結合后的懸浮液200 μl,加750 μl PBS,50 μl 10% SDS,100 ℃煮沸10 min,12 000 r/min離心10 min,分離沉淀和上清液,取上清液用BCA試劑盒測定蛋白質濃度,同時用1 ml PBS重懸沉淀,取重懸沉淀和解離上清液進行SDS-PAGE鑒定。
1.6 GEM透射電鏡觀察
對制備好的GEM顆粒進行離心并收集,3 000 r/min離心5 min,棄上清液后加入含2.5%戊二醛的PBS(0.1 mol/L,pH=7.2),4 ℃固定2 h,PBS漂洗3次,每次10 min,依次以30.0%、50.0%、75.0%、95.0%的乙醇脫水1次,1次10 min,然后以無水乙醇重復脫水2次,1次10 min,再用50.0%、70.0%、90.0%、100.0%的乙酸異戊酯逐級取代乙醇,每級置換2 min。二甲苯透明,將GEM顆粒完全浸沒于盛有二甲苯的帶蓋小瓶中,1∶1(體積比)浸透,環氧樹脂Epon812浸蠟,將浸好的透明GEM顆粒放入盛有環氧樹脂Epon812的容器中20 min,環氧樹脂Epon812包埋,將浸好蠟的GEM顆粒放于盛有環氧樹脂Epon812的包埋器中,注入包埋劑,將組織塊完全浸沒,再將包埋器置于37 ℃溫箱中24 h,超薄切片,醋酸雙氧鈾-檸檬酸鉛雙染,最后在Model S-3000N型透射顯微鏡下觀察,拍照。
1.7 GEM顆粒4 ℃保存期試驗
分別對4 ℃下保存0個月、2個月、6個月、12個月、15個月、18個月的GEM顆粒進行計數,比較不同保存時間下GEM的顆粒數,同時比較不同樣品的錨定活性。
1.8 真空冷凍干燥對GEM顆粒錨定活性的影響
真空冷凍干燥GEM顆粒,觀察其外觀形態,拍照。同時,將凍干樣品直接加入到PA溶液中,室溫孵育30 min,通過SDS-PAGE分析檢驗冷凍干燥對GEM顆粒錨定活性的影響。
此外,本試驗將冷凍干燥后的GEM顆粒置于37 ℃下進行耐老化試驗,通過其蛋白錨定活性來監測冷凍干燥后GEM顆粒的保存期。
1.9 數據分析
GEM顆粒得率=(GEM顆粒數/原細菌數)×100%。數據采用SPSS(16.0)軟件進行統計,差異顯著性檢驗采用獨立樣本t檢驗和單因素方差分析。所有數據均表示為平均值±標準差。
2 結果與分析
2.1 不同稀酸處理GEM顆粒沉降出現的時間
不同稀酸的作用方式不同,不同濃度的同一種稀酸其作用強度也不同,因此,GEM制備過程中不同稀酸及不同濃度的同種稀酸處理,在煮沸過程中GEM顆粒的沉降速度不同,制備后成品懸浮液的澄清度也不同。圖1顯示,清水對照在煮沸細菌的整個過程中均未出現沉降,一直處于混懸液狀態。當用稀酸煮沸時,則出現不同程度的沉降,其中,TCA處理沉降出現的最快,5 min左右出現,HCl處理次之,15 min左右出現沉降,H2SO4處理出現沉降最遲,20 min后才出現。

0:H2O;1:0.05 mol/L硫酸(H2SO4);2:0.10 mol/L鹽酸(HCl);3:0.60 mol/L三氯乙酸(TCA)。圖1 不同稀酸制備GEM顆粒的觀察結果Fig.1 Observation of gram-positive enhancer matrix (GEM) particles prepared with different dilute acids
2.2 不同稀酸處理制備GEM顆粒的SDS-PAGE分析
圖2和圖3顯示,MG1363主要的菌體蛋白質位于50 000左右,H2SO4和HCl處理制備的GEM顆粒隨酸濃度的增加,50 000左右的菌體蛋白質逐漸減少,蛋白質去除效果越來越好。不同濃度TCA處理的蛋白質去除效果無明顯差異,而且其蛋白質去除效果不及H2SO4處理和HCl處理。不同稀酸處理制備GEM顆粒去除蛋白質定量分析結果與SDS-PAGE分析結果一致。

M:蛋白質分子量標準;1:乳酸乳球菌MG1363;2:H2O處理(CK);3:0.012 5 mol/L H2SO4處理;4:0.025 0 mol/L H2SO4處理;5:0.050 0 mol/L H2SO4處理;6:0.100 0 mol/L H2SO4處理。圖2 不同濃度H2SO4制備GEM顆粒SDS-PAGE分析Fig.2 SDS-PAGE assay of GEM particles prepared with different concentrations of H2SO4
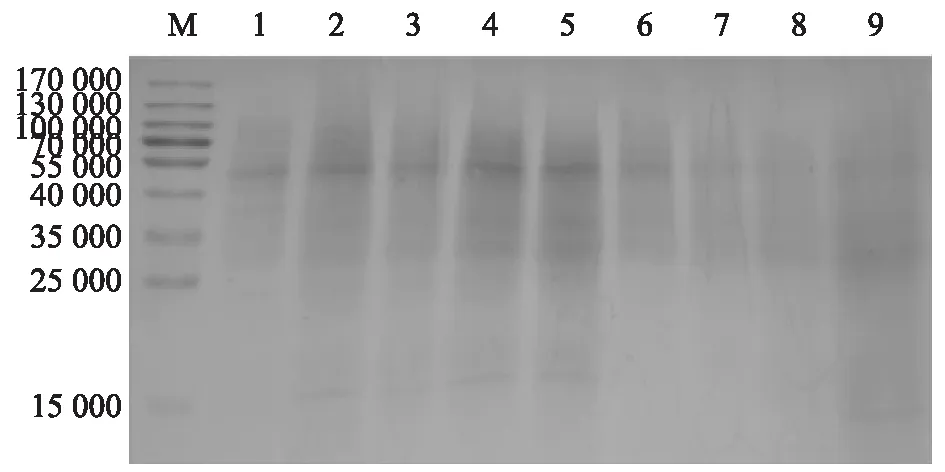
M:蛋白質分子量標準;1:乳酸乳球菌MG1363;2:0.150 mol/L TCA處理;3:0.300 mol/L TCA處理;4:0.600 mol/L TCA處理;5:1.200 mol/L TCA處理;6:0.025 mol/L HCl處理;7:0.050 mol/L HCl處理;8:0.100 mol/L HCl處理;9:0.200 mol/L HCl處理。圖3 不同濃度TCA和HCl制備GEM顆粒SDS-PAGE分析Fig.3 SDS-PAGE assay of GEM particles prepared with different concentrations of TCA and HCl
2.3 不同稀酸處理制備GEM顆粒得率
隨HCl濃度增加,GEM顆粒得率降低,而TCA濃度變化對GEM顆粒得率的影響不明顯。中濃度和低濃度HCl處理的GEM顆粒得率高于H2SO4處理和TCA處理,1 ml菌液最高可以制備約3 U GEM顆粒(表1)。
2.4 不同稀酸制備的GEM與PA錨定的活性
圖4顯示,低濃度H2SO4處理(3泳道)制備的GEM與PA錨定效果不如中濃度處理(4泳道)和高濃度處理(5泳道、6泳道)制備的,中濃度H2SO4處理的GEM與PA錨定效果與高濃度處理的無明顯差異。中濃度H2SO4處理(4泳道)和高濃度H2SO4處理(5泳道、6泳道)制備的GEM與PA錨定效果稍優于中濃度HCl處理(7泳道、8泳道)制備的。
低濃度TCA處理(2泳道)制備的GEM與PA錨定效果稍遜于中濃度處理(3泳道)和高濃度處理(4泳道、5泳道)制備的,中濃度處理的GEM與PA錨定效果與高濃度處理的無明顯差異。HCl處理(6~9泳道)制備的GEM與PA錨定效果隨HCl濃度增加逐漸增強。中濃度和高濃度TCA處理制備的GEM與中濃度和高濃度HCl處理制備的GEM與PA錨定活性無明顯差異(圖5)。
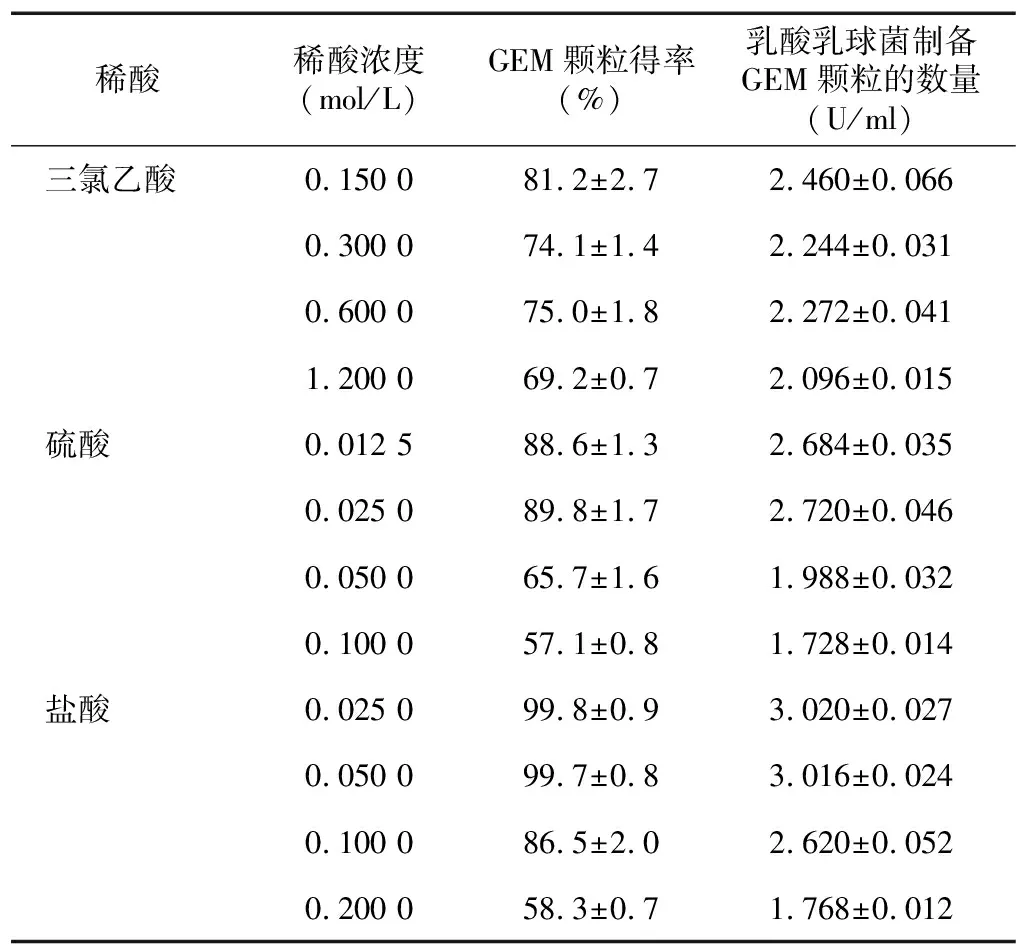
表1 不同稀酸制備的GEM顆粒得率
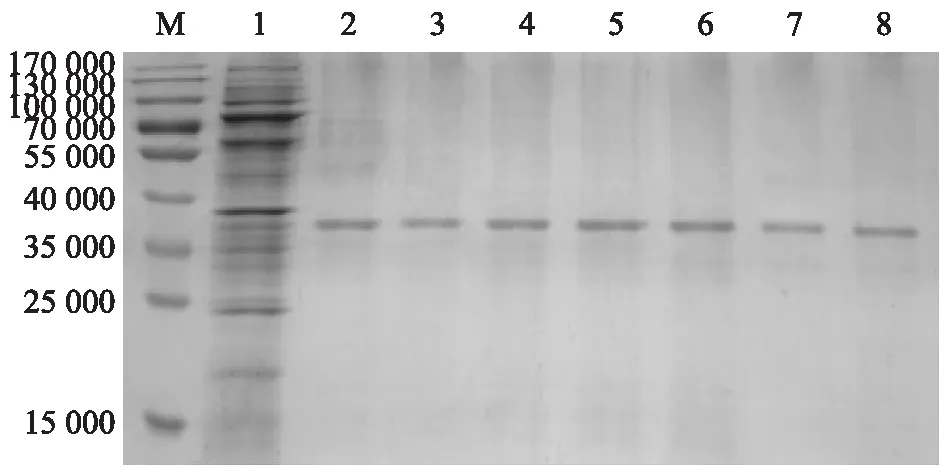
M:蛋白質分子量標準;1:錨鉤蛋白PA;2:H2O處理(CK);3:0.012 5mol/L H2SO4處理;4:0.025 0 mol/L H2SO4處理;5:0.050 0 mol/L H2SO4處理;6:0.100 0 mol/L H2SO4處理;7:0.050 0 mol/L HCl處理;8:0.100 0 mol/L HCl處理。圖4 不同濃度H2SO4和HCl制備的GEM與PA錨定活性的SDS-PAGE分析Fig.4 SDS-PAGE assay of the anchoring activity between PA and GEM prepared with different concentrations of H2SO4 and HCl
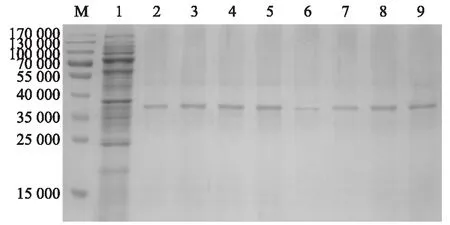
M:蛋白質分子量標準;1:錨鉤蛋白PA;2:0.150 mol/L TCA處理;3:0.300 mol/L TCA處理;4:0.600 mol/L TCA處理;5:1.200 mol/L TCA處理;6:0.025 mol/L HCl處理;7:0.050 mol/L HCl處理;8:0.100 mol/L HCl處理;9:0.200 mol/L HCl處理。圖5 不同濃度TCA和HCl制備的GEM與PA錨定活性的SDS-PAGE分析Fig.5 SDS-PAGE assay of the anchoring activity between PA and GEM prepared with different concentrations of TCA and HCl
不同稀酸處理制備的GEM顆粒結合PA,經SDS解離后再經BCA蛋白質定量檢測,其結果與SDS-PAGE分析結果一致。不同濃度H2SO4制備的1 U GEM顆粒結合PA的蛋白質質量分別為(128.1±5.7) μg(0.012 5 mol/L H2SO4)、(155.4±6.6) μg(0.025 0 mol/L H2SO4)、(158.3±3.2) μg(0.050 0 mol/L H2SO4)、(157.8±6.4) μg(0.100 0 mol/L H2SO4),低濃度H2SO4處理制備的GEM結合PA活性較差,其他濃度處理制備的GEM間無明顯差異。不同濃度TCA制備的1 U GEM顆粒結合PA的蛋白質質量分別為(116.4±4.5) μg(0.150 0 mol/L TCA)、(135.7±3.9) μg(0.300 0 mol/L TCA)、(138.3±3.6) μg(0.600 0 mol/L TCA)、(137.2±4.1) μg(1.200 0 mol/L TCA),低濃度TCA處理制備的GEM結合PA活性較差,其他濃度處理制備的GEM間無明顯差異。不同濃度HCl制備的1 U GEM顆粒結合PA的蛋白質質量隨HCl濃度增加而增加,分別為(97.3±4.9) μg(0.025 0 mol/L HCl)、(125.7±7.2) μg(0.050 0 mol/L HCl)、(134.6±3.8) μg(0.100 0 mol/L HCl)、(137.9±5.3) μg (0.200 0 mol/L HCl),中濃度和高濃度HCl處理制備的GEM與PA的結合活性顯著高于低濃度HCl處理制備的(P<0.05)。所有中濃度、高濃度H2SO4、HCl、TCA處理的效果相近,差異不顯著。
2.5 不同稀酸處理制備GEM顆粒電鏡觀察結果
GEM顆粒電鏡觀察結果(圖6)顯示,MG1363菌體本身,即細菌未經熱酸煮沸之前,菌體內部核區可見大量的核酸,而且菌體內部各種蛋白質均有不同程度的負染著色。MG1363經熱酸煮沸后,菌體內部著色均一,表明菌體內部的核酸及蛋白質均已被清除,HCl、H2SO4和TCA處理后的GEM顆粒電鏡形態無明顯差異。
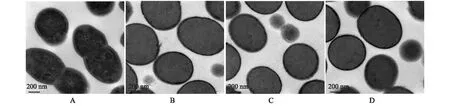
A:MG1363菌體;B:0.10 mol/L HCl制備的GEM顆粒;C:0.05 mol/L H2SO4制備的GEM顆粒;D:0.60 mol/L TCA制備的GEM顆粒。圖6 GEM顆粒透射電鏡觀察結果Fig.6 Transmission electron microscope images for GEM particles
2.6 4 ℃下GEM顆粒的保存期
對4 ℃下保存時間不同的GEM顆粒進行計數,均無明顯變化。4 ℃下保存不同時間的GEM顆粒蛋白錨定活性均保持良好,各時間段的錨定活性無明顯差異(圖7)。
SDS解離后定量分析結果顯示,保存不同時間的GEM顆粒結合PA,SDS解離后經BCA蛋白定量檢測,發現保存0個月的1 U GEM顆粒結合(134.6±3.8) μg的PA,保存2個月、6個月、12個月、15個月、18個月的1 U GEM顆粒結合PA蛋白質質量分別為(138.1±5.7) μg、(135.4±6.2) μg、(138.3±3.4) μg、(129.8±6.7) μg、(132.4±4.9) μg,各個時間段之間無顯著差異。說明GEM顆粒在4 ℃下至少可以保存18個月。
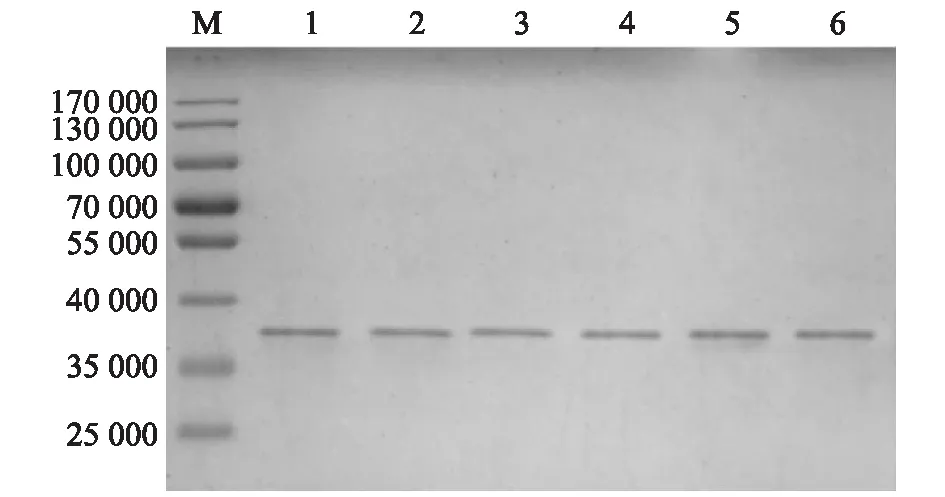
M:蛋白質分子量標準;1:保存0個月;2:保存2個月;3:保存6個月;4:保存12個月;5:保存15個月;6:保存18個月。圖7 SDS-PAGE分析4 ℃下保存不同時間GEM顆粒的錨定活性Fig.7 SDS-PAGE assay of the GEM anchoring activity under different stored time
2.7 冷凍干燥對GEM顆粒錨定活性的影響
SDS-PAGE分析結果(圖8)顯示,冷凍干燥對GEM顆粒的錨定活性沒有影響(冷凍干燥過程中未添加任何保護劑)。
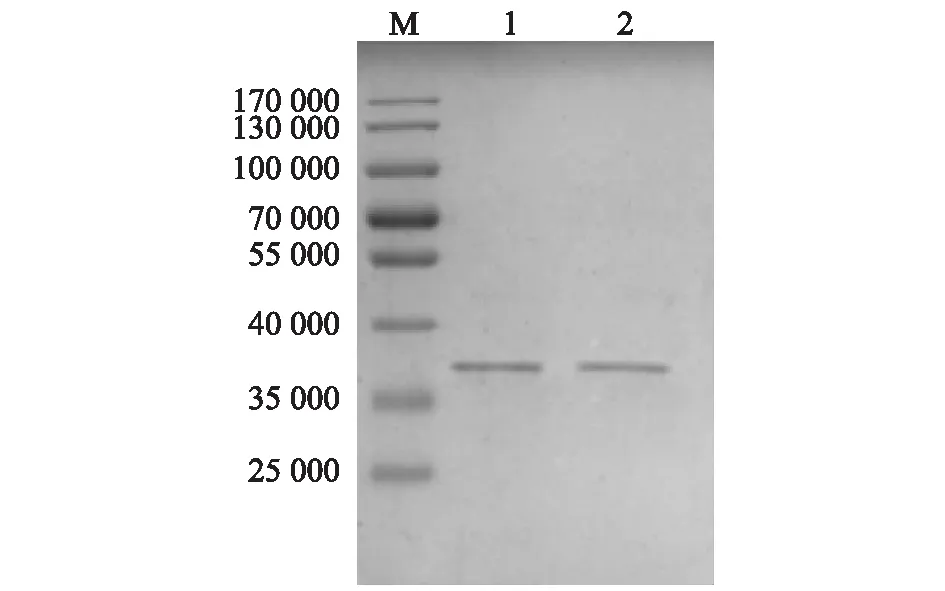
M:蛋白質分子量標準;1:未冷凍干燥的GEM顆粒;2:冷凍干燥后的GEM顆粒。圖8 冷凍干燥對GEM顆粒錨定活性影響的SDS-PAGE分析Fig.8 SDS-PAGE assay of the GEM anchoring activity after freeze-drying
2.8 冷凍干燥GEM顆粒的耐老化
圖9顯示,37 ℃保存15 d的GEM顆粒冷凍干燥樣品的錨定活性與-70 ℃保存樣品無明顯差異。參照冷凍干燥活疫苗37 ℃10 d,可置換為4 ℃ 24個月的標準,GEM冷凍干燥樣品至少可以保存24個月。
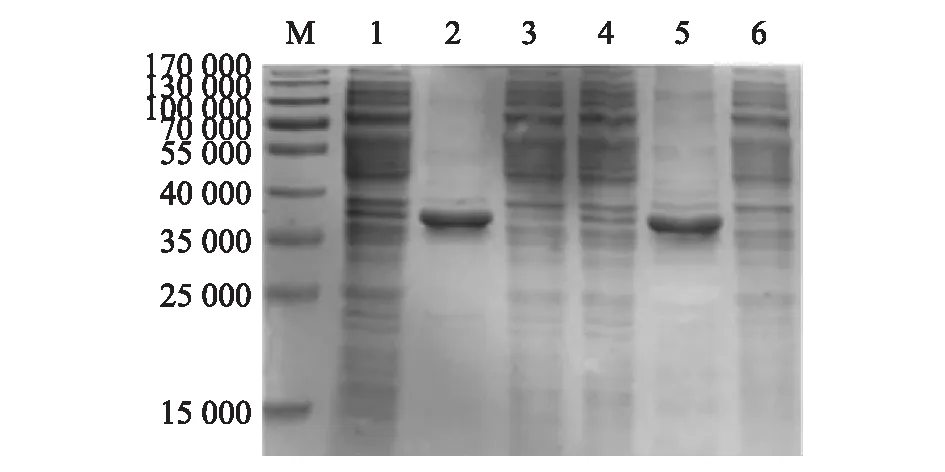
M:蛋白質分子量標準;1,4:PA表達產物;2:-70 ℃保存GEM+PA;3:-70 ℃保存GEM+PA的上清液;5:37 ℃保存15 d 的GEM+PA;6:37 ℃保存15 d 的GEM+PA上清液。圖9 冷凍干燥GEM顆粒耐老化后的活性鑒定Fig.9 Identification of aging resistance of GEM particles after freeze-drying
3 討 論
乳酸乳球菌GEM顆粒,其本質是一種細菌細胞壁肽聚糖骨架,是經過熱酸處理,去除菌體內核酸及絕大部分菌體蛋白質制備成的無活性的菌體外殼。熱酸處理的主要作用是去除細胞壁中的蛋白質、多糖、脂類和磷壁酸等成分[6]。磷壁酸按其在細胞表面固定的方式可以分為脂磷壁酸和壁磷壁酸2種。壁磷壁酸不深入質膜,其末端以磷酸二酯鍵與肽聚糖的N-乙酰胞壁酸殘基連接。脂磷壁酸可跨越肽聚糖層,其末端以磷酸共價鍵方式連接于質膜中糖脂的寡糖基部分[7-8]。低濃度的HCl和H2SO4水解細胞壁中的多糖[9-10],將其煮沸可以水解細胞中的脂磷壁酸[11]。脂磷壁酸可穿透厚的肽聚糖層,跨越質膜,去除磷壁酸相當于在細胞壁上開孔,在保證菌體形態的同時,可以使內容物流出,從而去除肽聚糖之外的其他雜質。
TCA可作為磷壁酸提取劑和蛋白質沉淀劑,常用于乳酸菌肽聚糖提純。TCA制備GEM顆粒的得率及錨定活性與其他2種稀酸差異不明顯,但其雜蛋白質去除效率差,可能是因為TCA作為蛋白質變性劑使蛋白質構象發生改變,暴露出更多的疏水基團,使蛋白質聚集沉淀[12]。此外,隨著蛋白質分子量的增大,TCA可能滲入分子內部而使之較難被完全除去。有報道稱,酸的類型對制備GEM顆粒的影響不大,滅活細菌溶液的pH維持在1.0才是GEM制備成功與否的關鍵因素[13]。本試驗結果顯示,在pH=1.0時,HCl與H2SO4制備的GEM顆粒質量優于TCA。
近年來,GEM抗原載運系統已成功用于多種抗原的表面展示,成為疫苗開發的新型候選系統[1-2, 14-15]。GEM顆粒結合錨鉤蛋白形成的復合物,-80 ℃、4 ℃和室溫保存12個月均不影響錨鉤蛋白活性。無需冷鏈保存是GEM顆粒疫苗的一大優勢[13]。本試驗對GEM顆粒保存期進行研究,GEM顆粒作為一種無活性的菌體外殼,其本質就是肽聚糖骨架,表現出良好的穩定性。
本研究結果表明,0.025 mol/L的H2SO4與0.100 mol/L的HCl可制備高質量的GEM,二者效果無明顯差異,該結果為制備高質量的GEM顆粒提供了試驗依據。
參考文獻:
[1] BOSMA T, KANNINGA R, NEEF J, et al. Novel surface display system for proteins on non-genetically modified gram-positive bacteria[J]. Applied and Environmental Microbiology, 2006, 72(1): 880-889.
[2] AUDOUY S A L, VAN SELM S, VAN ROOSMALEN M L, et al. Development of lactococcal GEM-based pneumococcal vaccines[J]. Vaccine, 2007, 25(13): 2497-2506.
[3] BAHEY-EL-DIN M, GAHAN C G M.Lactococcuslactis: from the dairy industry to antigen and therapeutic protein delivery[J]. Discovery Medicine, 2010, 9(48): 455-461.
[4] RAMASAMY R, YASAWARDENA S, ZOMER A, et al. Immunogenicity of a malaria parasite antigen displayed byLactococcuslactisin oral immunisations[J]. Vaccine, 2006, 24(18):3900-3908.
[5] RAMIREZ K, DITAMO Y, RODRIGUEZ L, et al. Neonatal mucosal immunization with a non-living, non-genetically modifiedLactococcuslactisvaccine carrier induces systemic and local Th1-type immunity and protects against lethal bacterial infection[J]. Mucosal Immunology, 2010, 3(2):159-171.
[6] JAFAREI P, EBRAHIMI M T.Lactobacillusacidophiluscell structure and application[J]. African Journal of Microbiology Research, 2011, 5(24): 4033-4042.
[7] VOLLMER W, BLANOT D, DE PEDRO M A. Peptidoglycan structure and architecture[J]. FEMS Microbiology Reviews, 2008, 32(2): 149-167.
[8] KOC C, GERLACH D, BECK S, et al. Structural and enzymatic analysis of TarM glycosyltransferase fromStaphylococcusaureusreveals an oligomeric protein specific for the glycosylation of wall teichoic acid[J]. Journal of Biological Chemistry, 2015, 290(15): 9874-9885.
[9] CUMMINS C S, HARRIS H. The chemical composition of the cell wall in some gram-positive bacteria and its possible value as a taxonomic character[J]. Microbiology, 1956, 14(3): 583-600.
[10] TAKé A, NAKASHIMA T, INAHASHI Y, et al. Analyses of the cell-wall peptidoglycan structures in three generaMicromonospora,Catenuloplanes, andCouchioplanesbelonging to the family Micromonosporaceae by derivatization with FDLA and PMP using LC/MS[J]. The Journal of General and Applied Microbiology, 2016, 62(4): 199-205.
[11] CAMPBELL L K, KNOX K W, WICKEN A J. Extractability of cell wall polysaccharide fromlactobacilliandstreptococciby autoclaving and by dilute acid[J]. Infection and Immunity, 1978, 22(3): 842-851.
[12] 郭立安,閻 哲,張曉楠,等. 三氯乙酸對蛋白質結構穩定性的影響[J]. 第四軍醫大學學報,2001,22(22):102.
[13] VAN ROOSMALEN M L, KANNINGA R, EL KHATTABI M, et al. Mucosal vaccine delivery of antigens tightly bound to an adjuvant particle made from food-grade bacteria[J]. Methods, 2006, 38(2): 144-149.
[14] ZADRAVEC P, STRUKELJ B, BERLEC A. Improvement of LysM-mediated surface display of designed ankyrin repeat proteins (DARPins) in recombinant and nonrecombinant strains ofLactococcuslactisandLactobacillusspecies[J]. Applied and Environmental Microbiology, 2015, 81(6): 2098-2106.
[15] SANDERS R W, MOORE J P. Native-like Env trimers as a platform for HIV-1 vaccine design[J]. Immunological Reviews, 2017, 275(1): 161-182.

