子宮內膜癌中錯配修復蛋白、P27及Ki67的表達及臨床意義*
王晨亮,彭麗姿,張靚
(江西省九江市第一人民醫院病理科,九江 332000)
子宮內膜癌作為女性生殖道常見的惡性腫瘤,近年來隨著生活環境及飲食結構的變化,發病率越來越高,普通人群中發病率為6.32/10萬[1]。而在子宮內膜癌中,又以子宮內膜樣腺癌為主要發病類型。其發病的主要原因是由無抵抗的高水平的雌激素不斷刺激,導致細胞持續增殖,直至惡變
[2]。女性子宮內膜本身受機體激素周期性調控,呈現規律的增生及脫落;當女性內分泌系統不穩定的時候,尤其是在圍絕經期期間,由于卵泡的衰竭,不能產生足夠的孕激素,與雌激素協同作用于子宮內膜,使得子宮內膜的持續性增生。當細胞分裂增生的過程中,如果出現DNA修復功能受損,就容易導致腫瘤的發生。因此,在臨床上,患者常伴有肥胖、多囊卵巢、月經紊亂等癥狀;而在微觀層面則常常伴隨DNA修復功能的異常。
1 材料和方法
1.1材料 收集我院及九江市婦幼保健院2013年-2017年病理標本66例,其中正常內膜20例,非典型增生內膜16例,高分化子宮內膜樣癌13例,中分化子宮內膜樣癌9例,低分化子宮內膜樣癌8例。年齡34-69歲。
1.2方法 所有標本均經過10%的中性緩沖甲醛固定,標準取材,常規制片,HE染色;組織采用免疫組化SP三步法,檢測錯配修復蛋白、P27及Ki67的表達情況。SP試劑盒購自北京中杉金橋試劑公司, 即用型,MLH1、PMS2、MSH2、MSH6、P27、Ki67。試劑經過校驗,實驗過程按照說明書進行,同時以組織內非腫瘤細胞作為內對照。
1.3結果判定 所有標記均為細胞核著色,呈棕黃色改變,任何強度的著色均視為陽性,瀏覽切片的全部范圍,通過觀察腫瘤及內對照,在試驗結果可信的基礎上,對腫瘤細胞進行評價。錯配修復蛋白(MLH1、PMS2、MSH2、MSH6) 的判定, 以 MLH1 或MSH2的表達缺失、合并或者不合并PMS2及MSH6的缺失,視為MMR缺陷[3];而P27和Ki67估算陽性細胞所占所有腫瘤細胞的百分比,按10%遞進。
1.4統計學分析 采用SPSS 19.0作為統計分析軟件,運用方差分析和Fisher檢驗,P<0.05被認為具有統計學差異。
2 結果
2.1P27表達結果 運用方差分析,F值=3.387,P=0.014,P27的表達在不同分組之間存在差異;組內兩兩比較,中分化腺癌和高分化腺癌分別與正常組和非典型增生都存在差異,P<0.05。
2.2Ki-67表達結果 運用卡方檢驗,P=0.030,Ki67的表達在各組之間存在差異;組內兩兩比較,中分化腺癌、高分化腺癌和低分化腺癌分別與正常組和非典型增生都存在差異,P<0.05。
2.3錯配修復蛋白表達結果 運用Fisher精確檢驗,P=0.168,錯配修復蛋白(MMR)在各組間分布無差異。本次試驗中大部分標本染色均呈現陽性染色無論分化程度;因錯配修復蛋白在正常組織中呈現陽性著色,MMR缺失組織則呈陰性染色,染色模式呈現“全”或“無”的形態,而本次實驗的病例主要以MLH1和PMS2缺失為主,而且在低分化腺癌中比例略高。
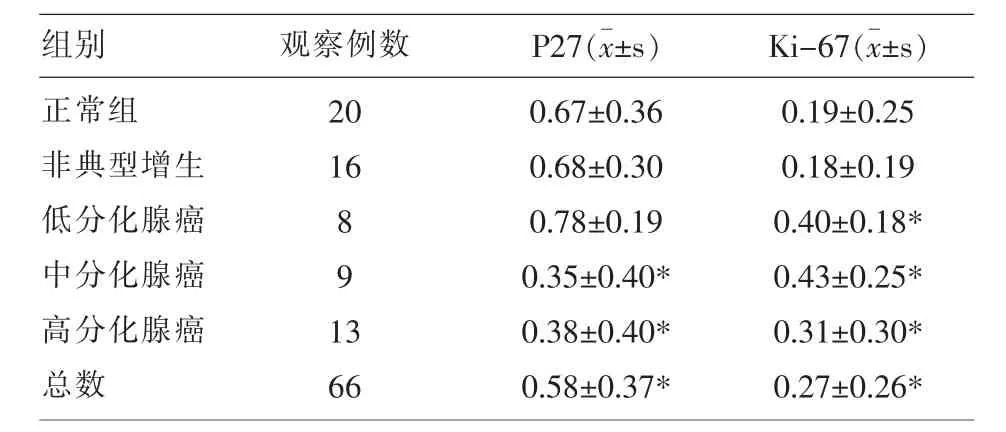
表1 P27和Ki67的表達
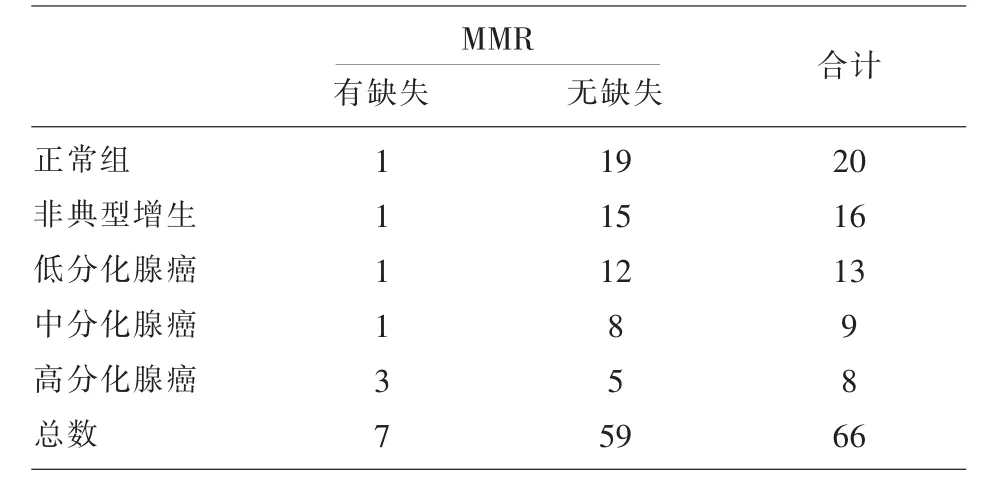
表2 錯配修復蛋白的表達
3 討論
隨著分子病理的發展,近些年來,錯配修復蛋白作為腫瘤發生和發展中的一個重要環節,越發受到重視;甚至在腫瘤化療的敏感性方面也具有指導意義[4]。錯配修復蛋白是一組由錯配修復基因編碼的蛋白質,在人類機體中主要由MLH1、MLH3、PMS1、PMS2、MSH2、MSH3、MSH4、MSH5、MSH6這九種蛋白質來執行功能。其中以MLH1、PMS2。MSH2、MSH6最為重要,他們可兩兩結合形成二聚體對DNA序列中的復制錯誤,進行糾正。而錯配修復基因的胚系突變則是引起Lych綜合征的根本原因[5]。同時,MLH1的甲基化則是引起散發性結直腸癌的重要原因。因此,錯配修復基因的檢測對腫瘤患者的治療及預后具有重要意義。大量的國內外文獻顯示,用免疫組化(IHC)的方法進行錯配修復蛋白的檢測,簡單易行,成本較低,而且與基因檢測對比具有較高的符合率[6]。
P27全稱為周期素依賴的蛋白酶抑制蛋白,由P27基因編碼,定位于12p13,包括2個外顯子和2個內含子,編碼198個氨基酸構成的蛋白質,屬于細胞周期蛋白依賴性蛋白激酶抑制劑CIP/KIP蛋白家族成員之一[7]。P27具有多種生物學功能,能廣泛抑制各種細胞周期蛋白和細胞周期依賴性激酶CDK的活性,從而抑制細胞增殖。作用途徑為通過與CDK或細胞周期素復合物cyclinD-CDK結合,抑制CyclinE-CDK2和CyclinD-CDK4等G1期激酶復合物,阻止細胞從G1期進入S期,控制細胞周期的轉變,對細胞周期進行負調控,具有抑制細胞增生的作用。從而使細胞有機會修復損傷的DNA或DNA復制產生的錯誤。P27蛋白的過度表達使細胞停滯于G1期,P27蛋白低表達或缺失可使細胞增殖失控,增殖與凋亡失衡,促進腫瘤的發生和發展[8]。
Ki-67是一種表達于增殖細胞的核抗原,位于人第10號染色體,其具體功能尚不清楚,但Ki-67抗原主要表達于細胞增殖周期的G1、S(DNA合成期)、G2期和M期,而在G0期不表達。由于其半衰期短,可以準確地反映細胞的增殖活性[9]。Ki-67作為標記細胞增殖狀態的抗原,在G1期和S期表達較低,在M期表達較高,近年已廣泛用于研究腫瘤的生物學行為,判斷腫瘤的危害性,是最具前途的細胞增殖標記。有研究表明,它與很多惡性腫瘤的發展、轉移及預后具有相關性。
通過本次研究發現,P27與Ki67之間存在負相關,但是,又不是完全的對應關系,以此印證了除P27以外,細胞周期還受到其他諸多因素的影響[10]。本研究主要旨在探究子宮內膜癌中P27對細胞周期的影響。在結果判定中,顯示出幾個有趣的現象:⑴在同一患者的標本中,正常組織及不同腫瘤區域中,P27與Ki67均表現出不一樣的著色強度和陽性比例,說明在腫瘤的發生與發展過程中,P27和Ki67均呈現出不一樣的表達狀態,又因為Ki67的表達只是腫瘤的所處周期的一個表現,因而P27的表達才顯得意義特別,值得探究;⑵在同一組織的相同區域,P27與Ki67的變化也是存在對應關系,說明Ki67的變化至少一部分是由于P27的改變所導致,因此P27的狀態也同樣可以用來判斷腫瘤的預后情況分析;⑶因為腫瘤異質性的問題,對于全片的P27及Ki67的表達,似乎并不合適用一個總的數據來概括。因此既往工作中,對腫瘤標記的定性結論,存在一定的局限性,因為,傳統的計數方法是尋找到一個陽性比例最高的區域,進行計數,盡管有時這樣的區域在全片中所占比例相當低;這就導致對腫瘤的平均增殖狀態呈現一個過高的估計。因此,對不同的病例,不同區域,用一個描述性結論進行分析,似乎更有利于對腫瘤預后的估計。另外,在本次樣本中,因錯配修復蛋白缺陷的患者數量并不如想象中的那么多,這也與其他研究者的數據相似[11],這也導致了,盡管在不同分組間的分布呈現明顯的區別,但是并不具備統計學意義。同時,我們發現在一些病例中,在正常組織中和腫瘤組織中,錯配修復蛋白表達的水平呈現出不一致的狀況。這可能是由于錯配修復基因甲基化的狀態不一造成[12];也可能是RNA表達水平不足導致。因此,MMR的表達變化,可能也屬于腫瘤改變的中間環節,因為錯配修復蛋白的功能影響是廣譜的,在涉及腫瘤增生的各個環節中的相關基因可能都會在在影響之列,也就導致了更多的染色體不穩定和突變的積累。

