活血解毒方對糖尿病大鼠視網膜組織中Notch信號通路的影響
邢 瑋,王政霖,王宏亮,呂甜甜,吳 晏,王 偉,韓 靜
(北京中醫藥大學,北京 100029)
糖尿病視網膜病變(diabetic retinopathy,DR)是當今全球成人眼盲的主要發病因素之一,為糖尿病晚期眼部最常見的并發癥,主要為血管病變[1]。因此,在治療糖尿病過程中,DR 不容忽視。 糖尿病視網膜病變的發生發展與多種信號通路失常有關。近年來,Notch 信號通路在糖尿病腎病的研究中得到了重視,但其在 DR 中的作用機制尚未明確。Notch信號通路是一條進化上十分保守的信號轉導通路,介導細胞之間的直接接觸,能夠在細胞增殖、分化、凋亡等過程中發揮調控作用。Notch1 為 Notch信號通路中的受體,Delta 樣配體 4(Dll4)是 Notch1 的配體,Hes1 是 Notch信號通路中極其重要的靶基因。Notch 信號通路中的配體和其受體相互結合,是誘導 Notch 受體構象發生改變的原因,由 γ -分泌酶介導,釋放出來 Notch 胞內域(Notch intracellular domain,NICD),其作為 Notch受體活化的形式,在其進入到細胞核后,激活下游的基因 Hes,幫助細胞轉歸,誘導其分化[2]。因此檢測Notch1、Dll4 和 Hes1 的表達水平可以反應 Notch 信號通路的變化。DR在中醫范疇屬“消渴目病”,發病過程復雜[3]。活血解毒方為臨床經驗方,主要由三七、鬼箭羽和黃連等組成。經前期實驗得出,活血解毒方可降低糖化血紅蛋白[4],改善視網膜中央動脈血流狀況,降低視網膜血管密度,減少內皮細胞與周細胞的比例[5],但是其藥理機制尚未闡明。本實驗通過建立糖尿病大鼠模型,觀察糖尿病及活血解毒方對視網膜組織中Notch信號通路產生的作用,探尋糖尿病視網膜病變發展中 Notch 產生的意義,同時揭示活血解毒方對于防治DR的藥理機制。
1 實驗材料
1.1動物 SPF級的雄性SD大鼠共18只,周齡為7周,體質量165~200 g,購買于北京維通利華實驗動物技術有限公司,許可證號編號為SCXK(京)2012-0001。飼養在北京中醫藥大學和平街校區實驗動物中心,實驗室相對濕度保持在 50%~70%,室內溫度保持在20~25 ℃,換氣次數10~15次/h,維持12 h/12 h光照黑夜,適應性喂養為期1周。
1.2藥物 鏈脲佐菌素(streptozotocin, STZ,S0130,Sigma公司產品,美國),溶解在檸檬酸鈉溶液中(0.1 mmol/L,pH 4.2~4.5),在冰盒中現用現配;活血解毒方由北京中醫藥大學中藥學院提供。
1.3實驗儀器 BCA蛋白定量試劑盒(Prod#23228,Thermo公司產品,美國),蛋白垂直電泳和轉膜系統、凝膠圖像分析系統(BIO RAD公司產品,美國),增強型化學發光檢測試劑盒(RPN2232,GE Healthcare公司產品,美國),熒光倒置顯微鏡(奧林巴斯株式會社產品,日本),Hes1多克隆抗體(ab71559)、Notch1多克隆抗體(ab52301)及Dll4多克隆抗體(ab183532)購自英國Abcam公司。
2 實驗方法
2.1大鼠分組和造模 構建糖尿病模型組,在實驗動物中心飼養SD 大鼠1周后,對大鼠禁食12 h,隨機選擇 12 只大鼠,腹腔一次性注射 STZ(65 mg/kg,溶劑為0.1 mmol/L檸檬酸鈉溶液,冰浴)。設立正常對照組,取6只大鼠腹腔注射等量的0.1 mmol/L濃度的檸檬酸鈉溶液。給藥7 d后進行糖尿病模型結果檢測,對大鼠禁食 6 h 后,尾靜脈采血,血糖≥16. 7 mmol/L認定為造模成功。飼養20周后,根據體質量、血糖采用數字表法將造模成功的大鼠分為模型組、給藥組。灌胃給藥12周,給藥組每日7. 7 g/kg(為臨床用量7倍);正常組和模型組給予等體積蒸餾水。
2.2檢測方法與檢測指標
2.2.1免疫組化處死大鼠后,取眼球在4% 的多聚甲醛溶液中固定,需要采用LSAB法,多克隆抗體濃度為Notch1(1:50)及Dll4(1:100)。常規石蠟切片脫蠟,從高到低濃度梯度酒精水化;自來水沖洗10 min,PBS 5 min洗3次,3% H2O2氧化15 min后,自來水沖洗10 min,PBS 5 min洗3次;4℃ 濕盒孵育一抗(多克隆抗體Notch1及Dll4)12 h,PBS 5 min洗3次;室溫濕盒孵育二抗2 h;PBS 5 min洗3次;DAB顯色,自來水反復沖洗;隨即蘇木素復染30 s,自來水沖洗10 min ;從低到高濃度梯度酒精脫水,二甲苯溶液透明 15 min 2次后,滴加中性樹脂封片,用熒光倒置顯微鏡并使用Image-Pro-Plus 6.0軟件觀察、拍照及數據分析,需得出Notch1以及Dll4 的積分光密度值(integral optical density,IOD)。
2.2.2Hes1 蛋白表達水平的檢測 使用 Western blot 的方法,在大鼠的視網膜組織加入預冷的 RIPA 裂解液,勻漿,在高速離心機15 000 r/min、4 ℃離心20 min,棄下層物質取上清,采用 BCA 法檢測蛋白濃度。然后SDS-PAGE 電泳分離蛋白,電轉移至 PVDF 膜,在含5%脫脂奶粉的 TBST 中室溫封閉2 h后,需要 TBST 漂洗3次,每次10 min,然后加入一抗,在 4 ℃ 條件下孵育過夜;然后 TBST 漂洗3次,每次10 min,再次加入二抗,室溫放置 2 h;滴加ECL發光液于PVDF膜上,通過化學發光檢測目的條帶,利用凝膠圖像分析儀及Image Lab軟件分析PVDF膜上條帶,以目的蛋白/β-actin比值為目的蛋白表達相對水平。
2.3數據統計 使用統計學方法,SPSS 20.0軟件數據分析,以均數±標準差(± s )的形式表示數據,采樣one-way ANOVA法,比較多樣本均數,P<0.05視為具有統計學意義。
3 結果
3.1活血解毒方對 Notch1、Dll4 表達的影響 由免疫組化的結果可以看出,正常組中 Notch1 主要分布于視網膜神經節層與內網層 ;模型組中 Notch1 在視網膜神經節層、內網層、內核層、外核層、色素上皮細胞層均有所表達,Notch1 的含量高于正常組(P<0.05);活血解毒方組與正常組分布近似,Notch1 表達水平少于模型組(P<0.05)。正常組視網膜中 Dll4 在神經節層、內網層、內核層及色素上皮細胞層中表達,模型組與活血解毒方組均表達在視網膜神經節層、內網層、內核層、外核層、色素上皮細胞層中,模型組 Dll4 表達水平高于正常組(P<0.05),活血解毒方組 Dll4 表達水平少于模型組(P<0.05)。見表1,圖1~2(插頁一)。
表 1 各組大鼠視網膜中Notch1、Dll4表達比較(± s ,n = 6)

表 1 各組大鼠視網膜中Notch1、Dll4表達比較(± s ,n = 6)
注:放大倍數400倍;與正常組比較,# P<0.05;與模型組比較,△P<0.05
組 別 Notch1 Dll4正常組 0.1606±0.02295 0.2139±0.02281模型組 0.4175±0.1616# 0.2499±0.02259#活血解毒方組 0.1207±0.4869△ 0.2175±0.02438△
3.2活血解毒方對 Hes1表達的影響 用 Western blot法檢測正常組、模型組、活血解毒方組視網膜組織中Hes1 表達水平,與正常組相比,模型組的Hes1 表達上調(P<0.05);與模型組相比,活血解毒方組 Hes1表達下調。見圖3。
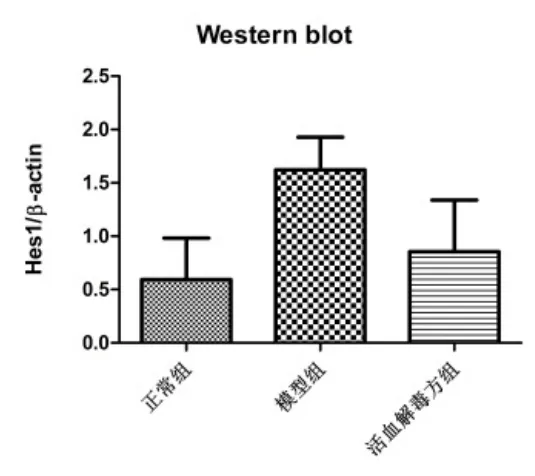
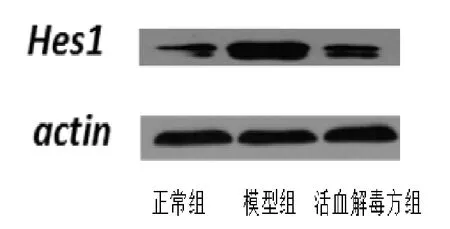
圖3 活血解毒方對Hes1蛋白表達水平的影響
4 討論
Notch 信號通路是一條在進化上高度保守、廣泛存在的,調節后生動物體內相鄰細胞間的直接信號傳導的信號通路。在1917年,Morgan 等人在果蠅體內首次發現了 Notch 基因;在1983年,成功的克隆出了該基因,并發現其可以編碼跨膜受體,命名為 Notch 受體[6]。隨后多年的研究發現,在多種物種中存在Notch信號,例如無脊椎動物、哺乳動物等。
Notch 信號通路主要由3部分構成,分別為受體、配體及細胞內效應器分子CSL-DNA結合蛋白。在哺乳動物體內,目前已經可以檢測出4種 Notch 受體的同源基因( Notch1-4 )和5種配體 (Jagged1和2,和Delta-like1、3和4)。Notch 信號產生是通過細胞受體與配體間相互作用,經剪切后,胞內段(NICD)釋放至細胞質,由胞質進入核內,結合轉錄因子CSL,形成轉錄激活復合體,激活下游轉錄抑制因子家族的靶基因,如Hes、Hey、Herp 等,促進該通路的生物學作用[7]。最終影響了細胞的分化和增殖以及凋亡。
Notch信號通路對血管形成、發育及生理功能等方面產生重要作用。研究表明,基因敲除 Notch 1和/或Notch 4 的純合子小鼠均在胚胎期10.5 d因為嚴重的血管發育缺陷死亡,例如卵黃囊發育不良、大量的胚胎期出血、擴大的心包囊結構、胎盤發育受損等[8~12]。另外有研究證明,Notch 信號缺失小鼠可觀察到大量血管生成,但是卻伴隨著嚴重的血管滲漏和出血,提示缺失 Notch 信號會導致血管功能嚴重受損[13]。
視網膜內有大量血管,因此 Notch 信號通路對視網膜內血管的形成發揮重要作用。Dll4 僅在血管內皮細胞中表達,Notch / Dll4 能抑制新生血管的內皮細胞向尖端細胞( tip cell )分化。在抑制 Notch 的活性或者敲除 Dll4 的小鼠中,視網膜血管內皮細胞分化后,導致尖端細胞過多生長,進而顯著促進毛細血管網的出芽、分枝以及融合[14-15]。雖然 Notch 信號通路影響視網膜血管形成,但其作用于糖尿病視網膜病變機制并無科學闡釋。本實驗通過免疫組化發現,正常組視網膜組織中 Notch 信號通路成員僅見少量表達,而在糖尿病視網膜病變組織中 Notch 信號通路配體 Dll4 和受體 Notch1 表達增加。Western blot 結果表明,下游基因 Hes1 的蛋白含量在糖尿病視網膜病變組織中較正常組明顯增強。糖尿病視網膜病變發展過程復雜,其中由于高血糖與低氧環境的雙重持續刺激作用,可能會導致 Notch 信號通路被激活,促進其成員 Notch1 和Dll4 以及 Hes1 的合成與釋放得到增多,從而對病變的發生發展起促進作用。
本實驗進一步分析了活血解毒方對 Notch 信號通路的影響,結果發現與模型組比較,活血解毒方組降低 Notch1、Dll4、Hes1 的含量,提示活血解毒方改善糖尿病大鼠視網膜病變可能與干預 Notch 信號通路有關。前期課題組曾證實,活血解毒方促進色素上皮衍生因子的水平[16],抑制了血管內皮生長因子(vascular endothelial growth factor,VEGF)、 血 管 緊 張 素 Ⅱ(angiotensin Ⅱ,AngⅡ)及內皮素-1(Endothelin-1,ET-1)的表達[17]。有文獻報道,腎細胞癌內皮細胞中 VEGF 可增加 Dll4 基因及蛋白水平的表達[18-19]。另外 AngⅡ 刺激小鼠足細胞或血管平滑肌細胞后,可使Notch 通路被激活,Notch1 的活化形式 NICD1 及其下游基因 Hes1 表達增加[20];而阻斷 AngⅡ 后,Notch 通路則被抑制[21]。至今已經知道的內源性縮血管物質中ET 是最強的,能夠促進血管收縮,加速平滑肌細胞增殖[22];在星形膠質細胞中,ET-1 可促進 Jagged1 表達,調節 Notch 激活[23]。綜合文獻及本課題組的實驗結果,筆者推測在 DR 的發病發展過程,VEGF、AngⅡ、ET-1 可能通過調控了 Notch 信號通路來影響內皮細胞的增殖或分化,因此導致了新生血管的形成;而活血解毒方可能由于抑制了 VEGF、AngⅡ、ET-1 而阻斷Notch 信號通路,減少了新生血管的生成,從而延緩DR 的進程。但是這種設想仍需進一步實驗驗證。
本實驗闡述了活血解毒方對 Notch 信號通路的作用,有助于揭示活血解毒方的藥理機制,為活血解毒方臨床治療 DR 提供可靠的實驗依據。但是 Notch信號通路的作用機制十分復雜,Notch 信號通路中的Jagged1、 NICD1 與 DR 的關系亟需深入研究,這對闡明 DR 的發病機制,探尋新的治療靶點具有重要意義。

