乳腺復雜硬化性腺病個案報道1例
(山西醫學科學院 山西大醫院,山西 太原 030025)
1 臨床資料
患者,女,39歲,主因“鉬靶發現左乳結構扭曲半年”入院。患者于半年前行鉬靶篩查發現左乳外上結構扭曲改變,良性可能,BI-RIDS4a,建議手術治療,患者拒絕。半年后復出鉬靶提示:左乳外上結構扭曲改變,BI-RIDS4b,收住入院。母親58歲診斷乳腺癌。臨床查體無陽性體征。超聲:左乳2點腺體層內可見一不規則低回聲區,范圍0.8×0.5 cm,邊界不清,周邊可見血流信號,診斷:左乳2點不規則低回聲區,BI-RADS4a(見圖1)。鉬靶:左乳外上中帶可見范圍約1.6×0.9 cm結構扭曲改變,診斷BI-RADS4b(見圖2)。完善術前檢查后,在鉬靶室導絲定位,局麻下行左乳區段切除術(見圖3、4),術后病理診斷:左乳復雜硬化性腺病、放射狀瘢痕,部分導管上皮呈乳頭狀、篩狀、實性增生伴柱狀細胞變及大汗腺化生,個別導管腔內可見鈣化(見圖5、6)。免疫組化:ER(中等強度,約30%),PR(中等強度約30%),CerbB-2(0),CK5/6(+),calponin、P63(示肌上皮存在)Ki67(5%)。
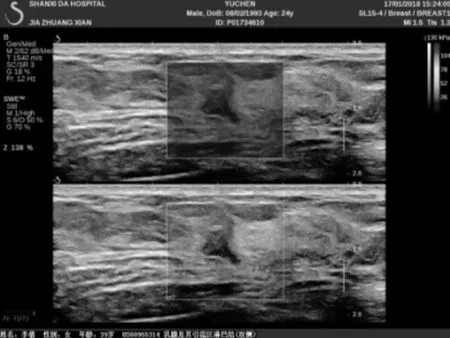
圖1 超聲SA影像
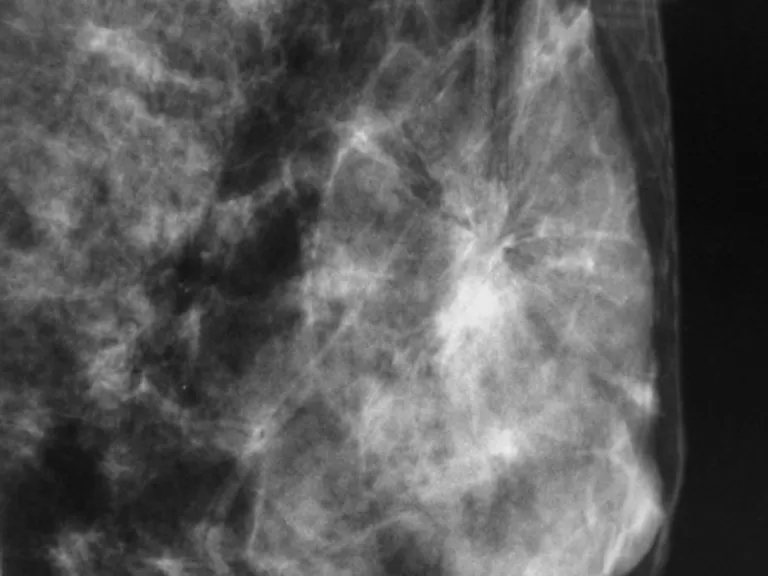
圖2 鉬靶加壓放大結構扭曲影
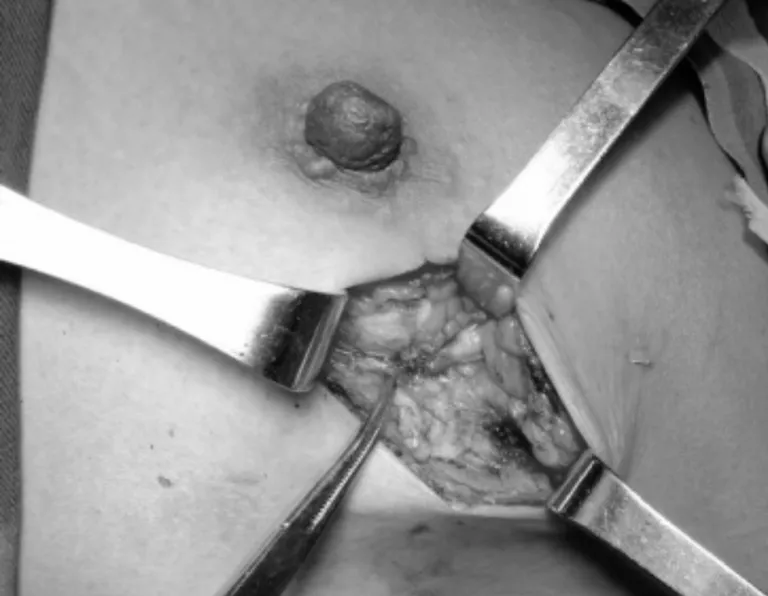
圖3 術中可見結構扭曲像
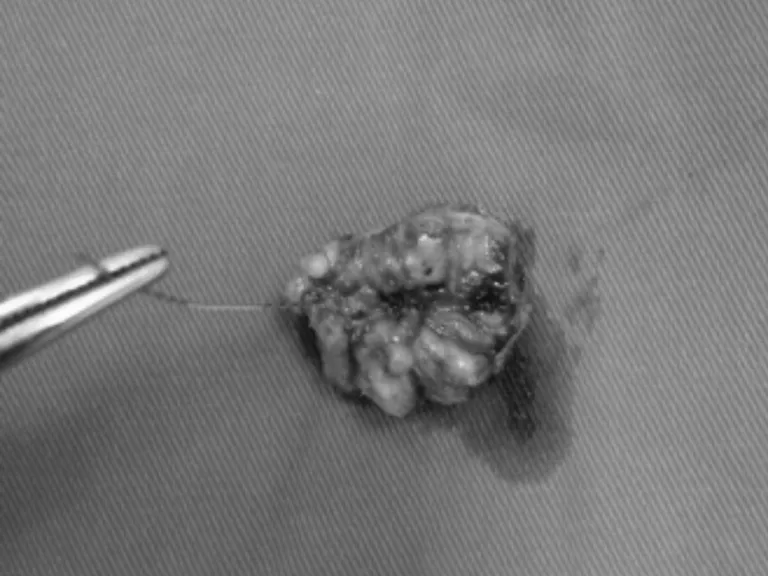
圖4 完整切除結構扭曲標本
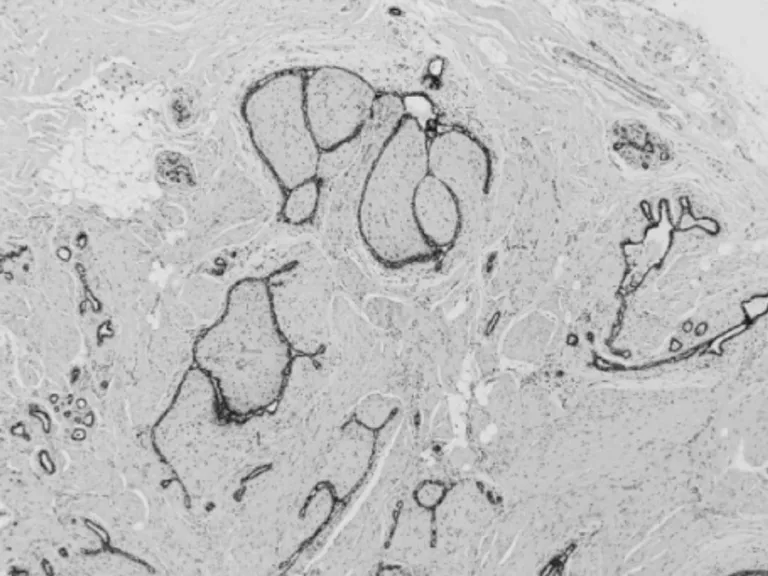
圖5 SA病理表現
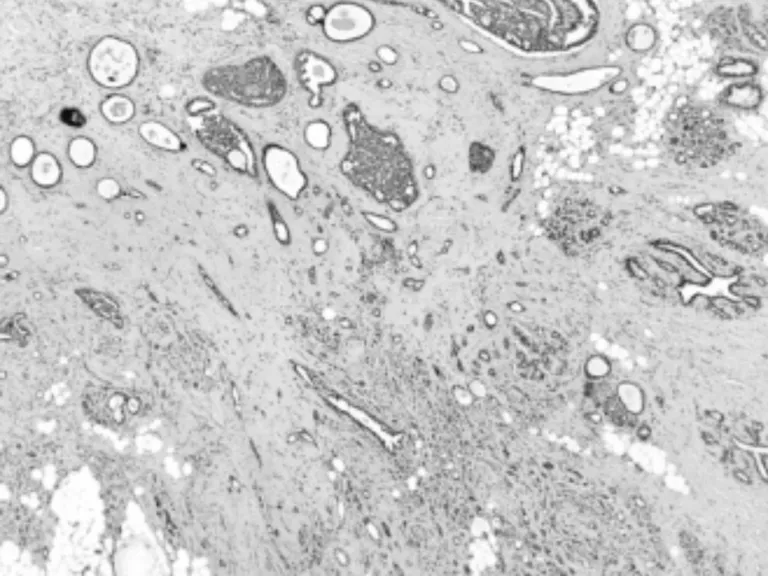
圖6 SA病理表現
2 討論
乳腺硬化性腺病(sclerosing adenosis of the breast,SA)是以小葉纖維化和增生小管的腺上皮萎縮而肌上皮卻保存或增生為特征的結節狀病變[1]。臨床上以35~40歲多見。可觸及小結節,少數可伴疼痛或觸痛。大多數是因影像學異常或其他原因行活檢時被發現,是一中少見的、可與惡性腫瘤共存的乳腺增生性病變,隨訪性研究表明SA患者后來發生浸潤性癌的相對風險有輕度增高,是對照組的1.5~2.0倍,被視為癌前病變[2]。如果是粗針穿刺活檢發現SA,建議最好再做切除活檢。SA其病理特征為小葉纖維化,增生小管的腺上皮萎縮而肌上皮保存或增生,發病可能與雌激素刺激上皮細胞的增生有關。SA需要與浸潤性癌、微腺性腺病、小管癌、小葉型與導管型不典型增生及小葉型或導管型原位癌鑒別。SA增生變形的腺體出現在纖維化間質或脂肪組織內時,易誤認為浸潤性癌。區分兩者的要點是,SA有肌上皮層,浸潤性癌無肌上皮層,采用免疫組化染色同時進行腺上皮及肌上皮標記即可鑒別[3]。由于SA的影像學表現易與浸潤性導管癌混淆,確診主要依靠病理及免疫組化檢查。鉬靶對結構扭曲有獨特優勢。結構扭曲是指正常結構被扭曲但無明確的腫塊可見,包括從一點發出的放射狀影和局灶性收縮,或者在實質的邊緣扭曲。結構扭曲也可以是一種伴隨征象,可為腫塊、不對稱致密或鈣化的伴隨征象。如果沒有局部的手術和外傷史,結構扭曲可能是惡性或放射狀瘢痕的征象,應提請臨床考慮活檢[2]。本例患者39歲,無明顯臨床癥狀,有乳腺癌家族史,定期鉬靶監測結構扭曲范圍較前增大,評級升高,在鉬靶引導下準確切除結構扭曲的組織,手術適應癥正確,避免了誤診和漏診,建議患者后續定期體檢。提醒醫師在臨床工作中重視對適合人群進行鉬靶檢查,結合超聲檢查,盡量做到早診早治,最大限度的降低漏診和誤診率。

