新高考背景下化學選考微專題復習策略研究
浙江
何小偉
浙江省自2014年實行新高考改革以來,化學選考已進行了六次,六次試題難度參差不齊,但知識點大同小異。不管是剛進入高三的11月份選考,還是下學期4月份選考,相信很多教師都有疑問:化學選考到底該怎么復習?筆者也有同樣的疑惑。從2014年9月到2018年4月浙江省完成了六次新高考背景下的化學選考,結合四年新高考背景的從教經歷,對照《考試說明》及六次選考試卷,探究新高考背景下化學選考微專題復習策略。
一、微專題復習研究背景
“微專題”是指以某一知識、方法或者某個問題情景為中心,整合相關基本概念、基本原理、基本模型和基本規律,所形成的一種聯系緊密、邏輯清晰的微型專題復習結構。其目的在于針對化學選考復習時間緊、內容多、題型相對穩定的特點,設置高效合理的微型專題,使得化學選考復習更具實效性和針對性。
1.傳統高考專題復習的實踐與思考
傳統高考化學復習分三輪:第一輪知識梳理,第二輪專題復習,第三輪綜合訓練。專題復習教學是化學復習中重要環節,是連接知識梳理與綜合訓練的橋梁。傳統高考題型靈活,每個題目知識點分散,導致傳統高考專題復習切口寬、內容多、跨度大,缺乏針對性、靈活性和選擇性等問題,教學效果通常不能令人滿意。
2.教學秩序和教學進度的改變
傳統高考化學在高三下學期6月份進行,高考復習按部就班,時間相對寬裕。而新高考背景下化學選考分兩次進行,高三上學期第一次參加選考,時間很緊張,按照傳統復習方式,知識梳理都是不能完成的,要想在第一次考試中取得理想成績,必須轉變復習方式,專題復習須穿插到知識梳理中,小而精的微專題應運而生。
3.新高考背景下化學選考試題的分析
新高考背景下化學選考已進行六次,六次試題難度參差不齊,但知識點大同小異。很多教師也對六次選考試題中各小題的知識點進行了羅列與比對,通過比對不難看出,選考試題對于專題復習指明了方向,各小題考點明確,如選擇題第22題阿伏加德羅常數,第23題酸堿中和滴定曲線分析。各小題切口小、內容窄、強調知識的深度而非知識跨度,轉變傳統專題復習方式,探究微專題復習勢在必行。
二、微專題復習策略研究
1.微型專題的設置依據
微專題復習模式首先要求設置微型專題,怎么設置?設置哪些微型專題?這些都是值得深思的問題,每個微型專題的設置對于化學選考的復習都有著舉足輕重的作用,不可大意。研究“考綱”是基礎,分析試題是關鍵,總結考點是精華。
(1)《考試說明》的研究
新高考方案實施后,浙江省教育廳頒布的《浙江省普通高中學業水平考試暨高考選考科目考試標準(2014版)》對于化學學科教學就是最好的綱領性文件。認真研讀《考試說明》,把握《考試說明》對不同知識點所提出的能力要求,把握命題趨勢,設置出針對性更強、更實用的微專題。
(2)六次選考試題的研究
分析選考試題,有利于把握選考的方向,相對穩定的題型也有利于教學和復習中的有的放矢,化學選考試卷一共32道題,學考29道題,3道加試題,命題風格和題型基本保持穩定。不少教師也做過六次試題考點的對比,如第22題阿伏加德羅常數,第23題酸堿中和滴定曲線分析,第24題化工生產流程題等。針對這些題型設置相應的微專題進行針對性訓練并加以強化。
(3)選考考點的研究
考點是命題的導向,在研究試題的基礎上,認真分析尤其是非選擇題部分涉及的考點對選考復習具有很強的指導意義。如第32題有機綜合推斷,常涉及:①官能團的名稱和反應類型的判斷;②某有機化合物X的分子式或結構式的推斷;③限定條件下同分異構體的書寫;④目標產物的合成路線流程圖等。這些拆分的考點一一設置成微型專題來進行各個突破,然后再把拆分的考點整合起來進行綜合訓練,復習效果可能會更好。
2.微型專題的實施流程
設置好微型專題,如何去合理高效地安排教學?首先要明確“考綱”要求,研究選考真題。傳統高考形式下也有很多對于微專題復習模式的研究,實施微專題復習教學一般按照問題情境、思維模型、問題解決的邏輯順序等進行,筆者結合教學實踐,初步探究微專題復習模式的實施流程。
(1)堅持目標導向,把握選考試題脈絡
微專題復習教學中首先將該專題所對應的選考背景揭示出來,使學生一開始就能明確該專題的學習目標,這種目標導向策略既符合選考考查的實際需求,同時能充分發揮學生學習的主體性作用。如選考第31題以物質的制備實驗為載體,考查相關實驗原理,可按照如下知識脈絡展開問題探究,進行微專題復習。
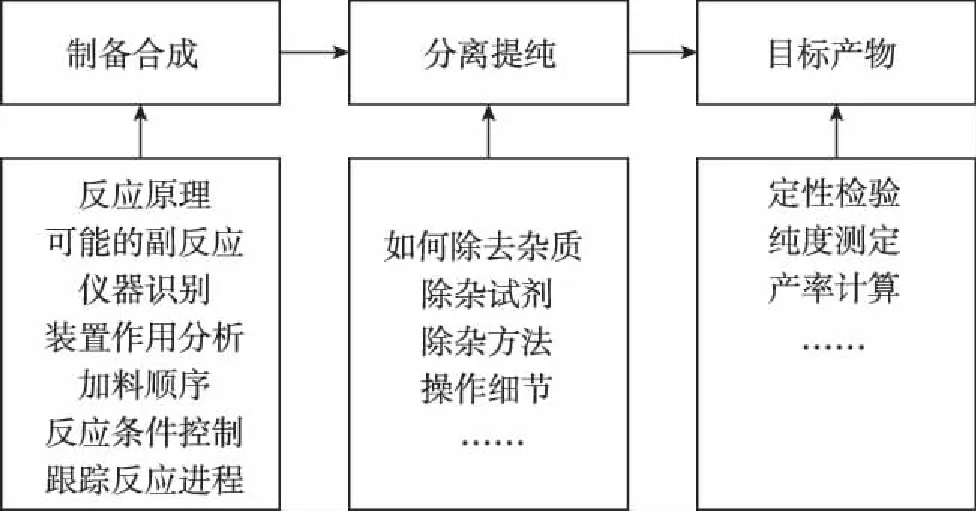
物質制備類實驗題脈絡
(2)構建知識體系,萃取知識精華
微專題復習教學中最重要的環節就是構建該知識體系下的思維模型,也是微專題能以小見大的原因之一。課堂教學中通常指導學生回顧教材中基本知識和基本情景,按照邏輯關系進行整理歸納,盡可能以思維導圖形式展現出來并加以解讀。如元素周期律微專題可以按照如下教學片段展開思維模型教學。
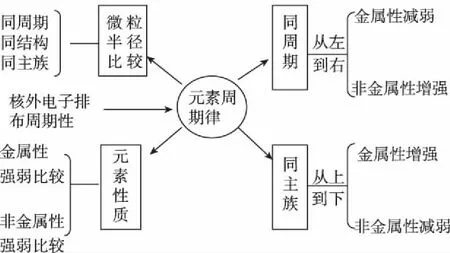
元素周期律知識體系
(3)精心設計訓練,強化落實與矯正
不管是傳統的專題復習模式還是微型專題復習模式,都是為了強化學生的應考能力,設計相關的反饋鞏固訓練是必不可少的。微型專題的反饋訓練要求內容精煉,針對性強,這就要求教師精心設計的訓練,既要緊密契合思維模型,又要有效提升訓練效率和應考技能。
綜上所述,微型專題的實施流程可概括為明確“考綱”要求,確定微型專題主題、教學設計(真題檢測、互動釋疑、歸納總結)、針對訓練、反饋矯正。其中確定微型專題主題是關鍵,各微專題設計要精準,直擊考點。做好這項工作是十分繁重的,各學校可以發揮教師的合力,編寫出不同微專題的教學設計,形成適合學生學習的校本教材,切實提高微專題復習的針對性和實效性。
3.微型專題實施課例展示——守恒計算教學設計

守恒思想在計算中的應用【設計意圖】選考試卷難度加大,很重要的一方面表現在計算難度加大,如2016年4月選考中第29題氧化還原計算,第31題氧化還原滴定計算,2016年10月選考中第27題無機化合物的定性分析與定量判斷。守恒計算是計算題重要題型,以計算題為切口,梳理高中化學重要思想———守恒思想,突破計算難題,并能夠綜合利用守恒思想解決化學問題。【教學目標】1.知識目標:(1)掌握質量守恒、元素守恒、電荷守恒、得失電子守恒的原理。(2)學會熟練運用守恒規律,建立守恒模型,解決化學問題。2.能力目標:通過守恒原理的分析利用,培養學生的化學學科思維與素養。【教學重點】常見的守恒類型題的分析。【教學難點】守恒思想的綜合應用。【教學過程】一、導入(課前小練,通過兩個習題,讓學生回答做題過程中所用到的思想)1. 1 L混合溶液中含0.025 mol SO2-4,0.05 mol Cl-,0.025 mol NO-3,0.025 mol Na+,其余為H+,則H+物質的量濃度為( )A.0.25 mol·L-1B.0.01 mol·L-1C.0.1 mol·L-1D. 0.5 mol·L-1【答案】C【解析】應用電荷守恒,設H+物質的量濃度為c,則所有陽離子所帶電荷數=陰離子所帶電荷數,即0.025 mol·L-1+c=0.025 mol·L-1×2+0.05 mol·L-1+0.025 mol·L-1,解得c=0.1 mol·L-1,故選C。2.某氧化劑中,起氧化作用的是X2O2-7離子,在溶液中0.2 mol 該離子恰好能使0.6 mol SO2-3離子完全氧化,則X2O2-7離子還原后的化合價為( )A.+1 B.+2C.+3 D.+4【答案】C【解析】反應前X2O2-7中X的化合價為+6價,設反應后的化合價為+n,則得電子數為0.2×2×(6-n),反應前SO2-3中S元素的化合價為+4價,完全氧化后S元素化合價為+6價,則失電子數為0.6×2,應用得失電子守恒有0.2×2×(6-n)=0.6×2,解得n=3,故選C。(設計意圖:通過簡單的守恒練習,創設情境,引出本堂課的主題———守恒)

二、回顧講解常見守恒類型(1)質量守恒依據:反應物的總質量=生成物的總質量。(2)元素(物料)守恒依據:化學反應前后原子的種類和數目不發生變化。(3)電荷守恒依據:陽離子所帶正電荷總數=陰離子所帶負電荷總數。(4)得失電子守恒依據:氧化劑得電子總數=還原劑失電子總數。三、通過典型例題分析守恒思想的運用【例1】向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL、1 mol/L的鹽酸,恰好使混合物完全溶解,放出224 mL(標準狀況)的氣體,向所得溶液中加入KSCN溶液無血紅色出現,若用足量的CO在高溫下還原相同質量的此混合物,能得到鐵的質量為( )A. 11.2 g B. 5.6 gC. 2.8 gD.無法計算【答案】C【解析】混合物與鹽酸恰好反應完之后加入KSCN溶液無血紅色出現,說明溶液中只剩下FeCl2,根據元素守恒n(Cl-)=0.1 mol,所以n(Fe2+)=0.05 mol,再根據鐵元素守恒計算得m(Fe)=0.05 mol×56 g/mol=2.8 g,故選C。(設計意圖:再次感悟守恒法解題,突破傳統的方法,先寫化學方程式再計算)(2016年4月選考第29題,有改編)Cl2與NaOH溶液反應可生成NaCl、NaClO和NaClO3,c(Cl-)和c(ClO-)的比值與反應的溫度有關。用24 g NaOH配成的250 mL溶液,與Cl2恰好完全反應(忽略Cl2與水的反應、鹽類的水解及溶液體積變化)。(1)消耗掉的Cl2標況下的體積為 L;(2)某溫度下,反應后溶液中c(Cl-)=6c(ClO-),則溶液中c(ClO-)= mol·L-1。【答案】(1)6.72 (2)0.3【解析】(1)不管是生成NaCl、NaClO還是NaClO3,n(Na)∶n(Cl)=1∶1,又根據鈉元素守恒得n(Cl)=n(Na)=2440=0.6 mol,所以n(Cl2)=0.3 mol,V(Cl2)=n·Vm=0.3 mol×22.4 L·mol-1=6.72 L。(2)已知氯元素總物質的量濃度=nV=0.6250 mL×10-3=2.4 mol·L-1。設c(ClO-)=x,則有c(Cl-)=6x mol·L-1,c(ClO-4)=2.4-7x(氯元素守恒),6x=x+5×(2.4-7x)(得失電子守恒),解得x=0.3,故c(ClO-)=0.3 mol·L-1。(設計意圖:真題感悟,訓練利用守恒思想建立等量關系式)

【例2】38.4 g銅與適量的濃硝酸反應,銅全部作用后,共收集到氣體22.4 L(標準狀況)(不考慮生成N2O4)。則①反應消耗的HNO3的物質的量是多少?②生成的NO和NO2物質的量各為多少?【答案】①2.2 mol ②n(NO2)=0.9 mol n(NO)=0.1 mol【解析】①硝酸反應之后有兩種去向,一是作氧化劑被還原為氮氧化物NO和NO2共1 mol,二是作酸反應產物為Cu(NO3)2,n[Cu(NO3)2]=0.6 mol,故反應消耗的硝酸為2.2 mol;②設n(NO2)=x mol,n(NO)=y mol,應用得失電子守恒,x+3y=1.2,x+y=1,解得x=0.9 mol,y=0.1 mol,故n(NO2)=0.9 mol,n(NO)=0.1 mol。(設計意圖:感悟守恒思想在計算中的綜合運用)思考討論:不同守恒規律適用于什么樣的體系?1.溶液中常用離子的電荷守恒和物料守恒。2.氧化還原反應得失電子守恒。 3.多步反應中考慮某一元素的始態和終態,聯系元素守恒。 4.化學反應中涉及質量有關的問題可考慮質量守恒。 5.具體問題具體分析,綜合考慮,往往是幾種守恒關系聯合運用,如選考第23題酸堿中和滴定聯系電荷守恒、物料守恒、質子守恒。四、課堂小結,作業布置本堂課我們系統地學習了應用守恒思想解決化學中的計算問題,以守恒思想作為微專題復習的開端,也希望大家在后續的微專題復習過程中多一些思考,對所學知識形成體系,把握好每一個微專題的學習,以更好的精神狀態迎接選考。
三、小結
如何上好高三復習課一直是老師們在不斷探究和思考的問題,新高考背景下切實提高復習效率必須轉變傳統的專題復習模式。選考分兩次進行,第一次考試前怎么復習,考完之后怎么復習,都是擺在高三老師面前的難題。
微專題復習教學以全新的組織形式展開專題復習,有效解決了傳統專題復習內容跨度大、教學時間長、教學效率低等問題。在高三第一學期參加化學選考,必須打破傳統的一輪、二輪、三輪這種按部就班的復習模式,把微專題復習和一輪復習進行有效整合,不斷探索、優化適合學生的有效的復習模式。


