化學實驗的跨接思維——定量實驗
李宏華
北京
定量實驗在近幾年的高考命題中異軍突起,2017年的全國卷Ⅰ、全國卷Ⅱ、全國卷Ⅲ、北京卷、天津卷等都考查了定量實驗。定量實驗是將化學實驗與化學計量有機地結合在一起測定物質化學組成與含量的探究性實驗,是近幾年高考的常考題型。命題設計中先通過實驗測出相關的有效數據,然后經計算得出物質的組成與含量。定量實驗目的性、實用性強,能給予出題人較大的創造空間。復習過程中教師要注重定性實驗拓展到定量實驗的探討。隨著理科綜合能力測試對定量思維能力以及實驗設計能力要求的提高,預計今后的高考試題中對實驗的考查會在定性實驗的基礎上滲透定量要求甚至直接要求進行定量實驗設計。
一、定量實驗所涉及的范圍
定量實驗是中學化學的重要實驗,主要有一定物質的量濃度溶液的配制、中和滴定(包括滴定曲線)、中和熱測定等。從中學化學實驗和高考實驗考查的要求來看,定量實驗主要有以下幾種類型:①確定物質組成與含量的定量實驗,如確定物質化學組成(確定化學式)、測量物質中某組分的質量分數等實驗;②測量某溶液的濃度(溶質質量分數、物質的量濃度等)的定量實驗,如中和滴定實驗;③測量某些化學計量的定量實驗,如測定某分子(或原子)的相對分子(原子)質量、阿伏加德羅常數等實驗;④研究反應熱效應的定量實驗,如教材中關于中和熱測定實驗;⑤研究物質(分子)結構的定量實驗,如有機物分子結構確定的實驗。
二、定量實驗應試策略
1.定量實驗的方案設計
定量實驗是在定性實驗基礎上為研究某些量及相關量間關系而展開的,因此能力要求和試題難度等將有所提升。如何有效地進行定量實驗方案的設計呢?為明確定量實驗設計的解題關鍵,先回顧一下中和滴定實驗:

定量實驗待測量實驗原理可測量中和滴定實驗酸或堿等溶液的物質的量濃度利用酸堿中和時反應物間物質的量的關系,用已知物質的量濃度的酸(堿)來測定未知堿(酸)的物質的量濃度待測液的體積和反應中消耗的標準液的體積
根據上述分析可知,待測量必須通過某種化學原理,尋求在限定實驗條件下可測的關系量(即“可測量”),利用兩者間量的關系計算而得。因此,確定可測量并準確予以測定便成為定量實驗的關鍵。
2.測量數據的注意事項
明確可測量范圍及測定方法,同時掌握減小實驗誤差的方法,定量實驗設計問題就會迎刃而解,并獲得較高的精確度。
常見的定量測定實驗包括混合物成分的測定、物質純度的測定以及化學式的確定等。該類試題常涉及物質的稱量、物質的分離與提純、滴定、一定物質的量濃度溶液的配制等實驗操作。
三、實驗數據篩選與處理策略
對實驗數據篩選的一般方法和思路為“五看”:
一看數據是否符合測量儀器的精確度,如用托盤天平測得質量的精確度為0.1 g,若精確度值超過了這個范圍,說明所得數據無效;
二看數據是否在誤差允許范圍內,若所得的數據明顯超出誤差允許范圍,要舍去;
三看反應是否完全,是否是足量反應物作用下所得的數據,只有完全反應時所得的數據才能應用;
四看所得數據的測量環境是否一致,特別是氣體體積,只有在溫度、壓強一致的情況下才能進行比較、運算;
五看數據測量過程是否規范、合理,錯誤和違反測量規則的數據要舍去。
四、高考命題中定量實驗的高頻考點
高頻考點一:考查計量儀器的特點和使用
高考中對定量實驗涉及的計量儀器的考查主要包括托盤天平、量筒、容量瓶、滴定管、溫度計和pH試紙等,從考查的要求看,主要是識記層次,考查學生對常見計量儀器的結構、用途、讀數和使用方法的認識。
【例1】淀粉水解的產物(C6H12O6)用硝酸氧化可以制備草酸,裝置如圖所示(加熱、攪拌和儀器固定裝置均已略去):
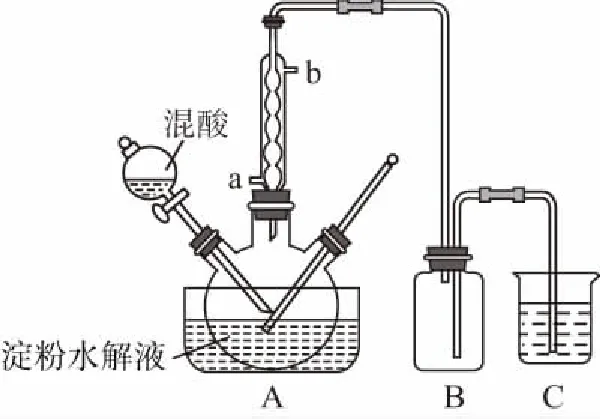
實驗過程如下:
①將1∶1的淀粉水解液與少許質量分數為98%硫酸加入燒杯中,水浴加熱至85~90℃,保持恒溫30 min,然后逐漸將溫度降至60℃左右;
②將一定量的淀粉水解液加入三頸燒瓶中;
③控制反應液溫度在55~60℃條件下,邊攪拌邊緩慢滴加一定量含有適量催化劑的混酸(65%HNO3與98%H2SO4的質量比為4∶3)溶液;
④反應3h左右,冷卻,減壓過濾后再重結晶得草酸晶體。
硝酸氧化淀粉水解液過程中可發生下列反應:



請回答下列問題:
(1)冷凝水的進口是________(填“a”或“b”)。
(2)裝置B的作用為__________________。
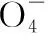
【答案】(1)a(2)作安全瓶 (3)無色 淺紫色 84.0%
高頻考點二:定量實驗的基本操作
現行高中教材中通過配制一定物質的量濃度的溶液、酸堿中和滴定等基本定量實驗的完成,都是基本操作技能的訓練。
【例2】三草酸合鐵酸鉀是一種重要的光敏材料和有機反應的催化劑,化學式為K3[Fe(C2O4)3]·3H2O,為翠綠色晶體,溶于水,難溶于乙醇。110℃下失去三分子結晶水,230℃時分解。該配合物對光敏感,光照下即發生分解。
Ⅰ.三草酸合鐵酸鉀的制備
①溶解:在托盤天平上稱取4.0 g FeSO4·7H2O晶體,放入250 mL燒杯中,加入1 mL 1 mol·L-1H2SO4溶液,再加入H2O 15 mL,加熱使其溶解;
②沉淀:在上述溶液中加入1 mol·L-1H2C2O4溶液20 mL,攪拌并加熱煮沸,使形成FeC2O4·2H2O黃色沉淀,用傾斜法倒出清液,洗滌該沉淀3次以除去可溶性雜質;
③氧化:在上述沉淀中加入10 mL飽和K2C2O4溶液,水浴加熱至40℃,滴加3%H2O2溶液20 mL,不斷攪拌溶液并維持溫度在40℃左右,使Fe2+充分氧化為Fe3+。滴加完后,加熱溶液至沸騰以除去過量的H2O2;
④生成配合物:保持上述沉淀近沸狀態,趁熱滴加1 mol·L-1H2C2O4使沉淀溶解至呈現翠綠色為止。冷卻后,加入15 mL 95%的乙醇水溶液,在暗處放置,結晶。減壓過濾,抽干后用少量乙醇洗滌產品,繼續抽干,稱量,計算產率,并將晶體放在干燥器內避光保存。
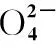

請回答下列問題:
(1)步驟①溶解時應加入少量的稀硫酸,目的是__________________
__________________。
(2)步驟②要維持微沸幾分鐘,但FeC2O4·2H2O晶體易暴沸,則適宜采取的加熱方式是________。
(3)生成的FeC2O4·2H2O晶體上易沾有硫酸鹽,如何證明晶體已洗滌干凈?________。
(4)步驟③需保持恒溫40℃,原因是__________________。
(5)用乙醇洗滌的作用是__________________。


【答案】(1)防止Fe2+的水解 (2)沸水浴加熱 (3)取最后一次洗滌液少許于試管中,加入BaCl2溶液,若沒有白色沉淀產生,則證明晶體已洗滌干凈 (4)溫度太低,Fe2+氧化速度太慢;溫度太高,易導致H2O2分解,影響Fe2+氧化結果 (5)加入乙醇降低溶解度,有利于產品結晶析出 (6)溶液變為淺紅色,且半分鐘不褪色 55%。
高頻考點三:重量分析法
重量分析法就是根據可測量物的重量來確定被測物質組分含量的方法,一般是先使被測組分從試樣中分離出來,轉化為一定的稱量形式,然后用稱量的方法測定該成分的含量。根據被測成分與試樣中其他成分分離的不同途徑,通常應用的重量分析法又分為沉淀法、氣化法等。

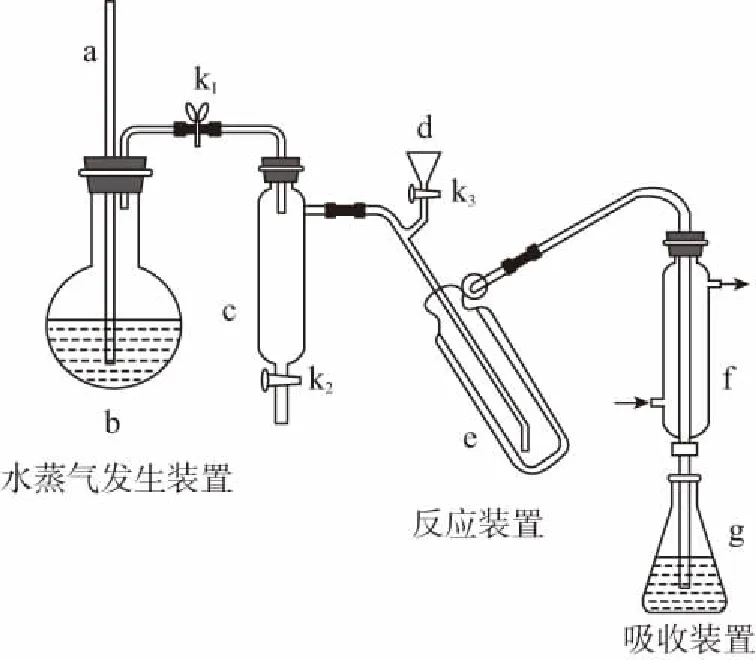
回答下列問題:
(1)a的作用是__________________。
(2)b中放入少量碎瓷片的目的是________。f的名稱是________。
(3)清洗儀器:g中加蒸餾水;打開k1,關閉k2、k3,加熱b,蒸氣充滿管路;停止加熱,關閉k1,g中蒸餾水倒吸進入c,原因是_____________________;打開k2放掉水,重復操作2~3次。
(4)儀器清洗后,g中加入硼酸(H3BO3)和指示劑。銨鹽試樣由d注入e,隨后注入氫氧化鈉溶液,用蒸餾水沖洗d,關閉k3,d中保留少量水。打開k1,加熱b,使水蒸氣進入e。
①d中保留少量水的目的是__________________。
②e中主要反應的離子方程式為 ___________________,e采用中空雙層玻璃瓶的作用是__________________。
(5)取某甘氨酸(C2H5NO2)樣品m克進行測定,滴定g中吸收液時消耗濃度為cmol·L-1的鹽酸VmL,則樣品中氮的質量分數為________%,樣品的純度≤________%。
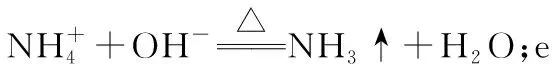
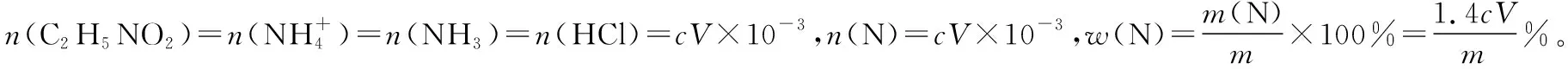
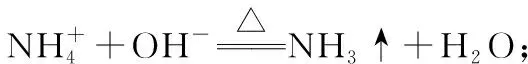
高頻考點四:滴定分析法
滴定分析法是傳統化學分析法中重要的分析方法之一,是將一種已知其準確濃度的試液滴加到未知物質的溶液中,通過指示劑的變化判斷反應完全時,根據所用試劑的濃度和體積求得被測組分的含量。滴定分析法要求發生的反應要完全、反應速率要快、要選擇恰當的指示劑。
【例4】(2017天津卷)用沉淀滴定法快速測定NaI等碘化物溶液中c(I-),實驗過程包括準備標準溶液和滴定待測溶液。
Ⅰ.準備標準溶液
a.準確稱取AgNO3基準物4.246 8 g(0.025 0 mol)后,配制成250 mL標準溶液,放在棕色試劑瓶中避光保存,備用。
b.配制并標定100 mL 0.100 0 mol·L-1NH4SCN標準溶液,放在棕色試劑瓶中避光保存,備用。
Ⅱ.滴定的主要步驟
a.取待測NaI溶液25.00 mL于錐形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(過量),使I-完全轉化為AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示劑。
d.用0.100 0 mol·L-1NH4SCN溶液滴定過量的Ag+,使其恰好完全轉化為AgSCN沉淀后,體系出現淡紅色,停止滴定。
e.重復上述操作兩次。三次測定數據如下表:

實驗序號123消耗NH4SCN標準溶液體積/mL10.2410.029.98
f.數據處理。
回答下列問題:
(1)將稱得的AgNO3配制成標準溶液,所使用的儀器除燒杯和玻璃棒外還有________。
(2)AgNO3標準溶液放在棕色試劑瓶中避光保存的原因是__________________。
(3)滴定應在pH<0.5的條件下進行,其原因是__________________________________。
(4)b和c兩步操作是否可以顛倒?________,說明理由:__________________。
(5)所消耗的NH4SCN標準溶液平均體積為______mL,測得c(I-)=______mol·L-1。
(6)在滴定管中裝入NH4SCN標準溶液的前一步,應進行的操作為__________________。
(7)判斷下列操作對c(I-)測定結果的影響(填“偏高”“偏低”或“無影響”):
①若在配制AgNO3標準溶液時,燒杯中的溶液有少量濺出,則測定結果________。
②若在滴定終點讀取滴定管刻度時,俯視標準液液面,則測定結果________。
【解析】(5)根據所提供的三組數據,第一組數據誤差較大,舍去,二、三兩組數據取平均值即可,所以所消耗的NH4SCN標準溶液平均體積為10.00 mL,測得c(I-)=0.060 0 mol·L-1。(6)在滴定管中裝入NH4SCN標準溶液前應用NH4SCN標準溶液進行潤洗。(7)①若在配制AgNO3標準溶液時,燒杯中的溶液有少量濺出,造成溶質減少,所配制AgNO3標準溶液濃度偏低,則測定結果偏高。②若在滴定終點讀取滴定管刻度時,俯視標準液液面,造成讀數偏小,則測定結果偏高。


