APE1在非小細胞肺癌腦轉移中表達特點及其與預后的關系*
夏 蕾,肖 何,李夢俠,楊鎮洲,王 東△(.陸軍軍醫大學大坪醫院野戰外科研究所腫瘤中心,重慶400042;2.重慶醫科大學附屬第二醫院腫瘤科,重慶40000)
肺癌腦轉移的發生率為23%~65%,約占惡性腫瘤腦轉移的50%,是最常見的腦轉移瘤[1]。隨著非小細胞肺癌(NSCLC)診治水平的提高,NSCLC腦轉移的發生率也得到進一步提高,而一旦發生腦轉移,其預后極差,生存期大多為2~4個月[2]。化療藥物由于難以透過血腦屏障而對腦轉移灶療效有限,即使積極采取全腦放療(WBRT)、立體定向放療(SRS),或者手術切除腦單發轉移灶等都不能達到令人滿意的局控率和生存率。當前,隨著NSCLC綜合治療的日趨完善,如何有效提高NSCLC腦轉移患者的生存期及改善其生活質量已成為臨床腫瘤學領域的研究熱點。
脫嘌呤脫嘧啶核酸內切酶1/氧化還原因子(APE1/Ref-1)是一種重要的低氧誘導細胞凋亡、壞死和氧化應激的保護基因,具有氧化還原和DNA損傷修復雙重功能,能通過改善生物體對缺氧和氧化應激的適應性,可以最大限度地減輕細胞損傷[3]。APE1是DNA堿基切除修復(BER)通路中的關鍵限速酶[4],是細胞基因毒性藥物損傷、放射性及其他氧化損傷的重要修復因子。APE1可以通過氧化還原機制調節 AP-1、p53、myb、HIF-1α,NF-κB等轉錄因子的DNA結合活性,從而參與細胞的增殖與凋亡、細胞的氧化與應激、細胞周期調控等多種關鍵的細胞反應[5]。作者前期的研究已證實,APE1在NSCLC中呈顯著高表達[6-9],但目前關于APE1蛋白在NSCLC腦轉移的表達水平、亞細胞定位等特征尚不清楚,也尚未明確與放、化療敏感性及預后相關性。
本研究選擇接受肺原發灶及腦轉移灶手術的NSCLC腦轉移患者,采用免疫組織化學方法檢測肺原發灶及腦轉移灶的APE1的表達狀況及亞細胞定位改變情況,進一步闡明APE1在NSCLC肺原發病灶及腦轉移中的差異性表達與療效、預后的相關性,為改善NSCLC腦轉移患者的生存質量和生存期提供新的依據。
1 資料與方法
1.1 一般資料 收集2010年1月至2015年1月陸軍軍醫大學大坪醫院術后病理檢查確診為NSCLC伴腦轉移患者共11例。肺原發灶及腦轉移灶患者均經過手術治療。其中男8例,女3例;年齡26~72歲,中位年齡58歲;鱗癌 2例(18.2%),腺癌 9例(81.8%)。
通過病歷記錄和問卷調查獲得研究對象的相關資料,包括以下方面內容:(1)個人基本信息。年齡、性別、身高、體重、吸煙、家族史等。(2)疾病信息。病理類型、臨床分期[10-11]、美國東部腫瘤協作組(ECOG)體例狀況(PS)評分、手術情況等。(3)首次治療信息。化療方案、周期,放療方案、周期,療效評價,不良反應等。(4)隨訪信息:隨訪時間、末次隨訪時間、肺部及顱內無病生存期(DFS)、總生存期(OS)等。(5)吸煙史:吸煙小于或等于100支及從不吸煙為從不吸煙;吸煙大于100支且戒煙大于或等于1年為過去吸煙;吸煙100支且戒煙小于或等于1年或目前仍吸煙為現在吸煙。
1.2 方法
1.2.1 肺原發灶與腦轉移灶APE1免疫組織化學檢測 11例肺原發灶及腦轉移灶手術標本均經10%甲醛溶液固定,石蠟包埋,4μm連續切片。鼠抗人APE1單克隆抗體購自NovusBiologicals公司,工作濃度為1∶100;以磷酸鹽緩沖液(PBS)替代一抗作為陰性對照。采用二步法4μm連續石蠟切片,二甲苯脫蠟,乙醇梯度水化,3%過氧化氫-甲醇溶液室溫10 min,微波抗原修復,滴加一抗,4℃過夜,PowerVi-sionTM復合物 50μL,37℃孵育30 min,DAB-H2O2顯色,蘇木素復染。以PBS代替一抗作為陰性對照。
1.2.2 APE1免疫組織化學結果判定 APE1免疫組織化學陽性信號為棕黃色細小顆粒,每張切片隨機選取5個具有代表性的視野(400×),所有病理切片由2名經驗豐富的病理科醫師在沒有臨床病理資料的情況下進行評分。若結果存在差異則被再次評估,直到達成共識。以細胞質或細胞核著色的細胞大于10%為癌細胞胞質或胞核陽性表達。胞質表達或核質共表達統稱為胞質異位表達。
1.2.3 化療及放療方案 患者接受的含鉑兩藥聯合方案如下:(1)TP 方案。紫杉醇(135 mg/m2,第 1天)+順鉑(75 mg/m2,第 1 天);(2)DP 方案。多西他賽(75 mg/m2,第1天)+順鉑(75 mg/m2,第1天)。患者接受的靶向治療方案如下:鹽酸厄洛替尼片150 mg/d,每天1次。替莫唑胺膠囊75 mg/m2放療同步口服。患者接受的放療方案如下:全腦兩視野對穿照射DT 40 Gy/20f/4w,SRS。
1.2.4 預后及療效判定 主要觀察指標:無病生存期(DFS)和總生存期(OS)。
1.2.4.1 次要觀察指標 客觀有效率(ORR)、疾病控制率(DCR)。
1.2.4.2 療效評定標準 術后局部出現病情進展,經常規治療以CT、磁共振成像(MRI)等影像學手段對靶病灶或轉移灶進行檢查,按照2009年《1.1版實體瘤評價標準(RECIST)》進行療效評價[12],包括完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)和疾病進展(PD)。ORR=CR+PR;DCR=CR+PR+SD。
1.2.5 隨訪 前半年每個月隨訪1次,半年后每2個月隨訪1次,直至患者死亡。隨訪的同時評估患者的生存質量、體重減輕程度等。隨訪截止時間為2016年6月1日,失訪或存活作為截尾數據。
1.3 統計學處理 統計分析前對所有資料和數據作統一的標準化處理。將病例資料錄入Excel表中進行整理,并經過反復檢查核對,再按統計分析格式生成代碼性數據。采用SPSS19.0統計軟件進行數據處理。ORR、DCR和不良反應的比較采用Pearsonχ2檢驗和Fisher's精確概率檢驗進行分析。生存分析采用Kaplan-Meier法,各因素水平間比較用Log-rank檢驗。Cox等比例風險模型分析預后相關因素,計算每個因素的死亡相對危險比(HR)及其95%置信區間(95%CI)。檢驗水準α=0.05,雙側概率檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 患者的臨床資料及臨床結果 本研究11例晚期NSCLC腦轉移患者的肺部病灶及腦轉移病灶均先后行手術治療,其中男 8例(72.7%),女 3例(27.3%);年齡26~72歲,中位年齡58歲。病理類型腺癌9例(81.8%),鱗癌 2例(18.2%)。其中首診分期ⅢA期患者 1例(9.1%),ⅢB期 4例(36.4%),Ⅳ期 6例(54.5%),ECOG評分均小于或等于2分。從不吸煙5例(45.4%),曾經吸煙 3例(27.3%),正在吸煙 3例(27.3%)。4例(36.4%)患者首診即出現腦轉移,其余7例(63.7%)在治療過程中才出現腦轉移。
采用TP方案的患者8例(72.7%),口服厄洛替尼2例(18.2%),口服替莫唑胺 1例(9.1%)。化療周期 2~8周期,中位化療周期4周期。采用WBRT2例(18.2%),SRS4例(36.3%),SRS+WBRT1例(9.1%),腦病灶未行任何放射治療4例(36.3%)。
肺原發病灶化療療效評價:CR 3例(27.3%),PR 6例(54.5%),SD 1例(9.1%),PD 1例(9.1%);化療 ORR 為81.8%。腦轉移病灶WBRT及SRS療效評價:CR 3例(27.3%),PR 4例(36.3%),SD 1例(9.1%),PD 3例(27.3%);局部治療的ORR為63.6%。
隨訪終止時間為2016年6月1日,隨訪時間6~38個月,中位隨訪時間為17個月,10例(90.91%)患者在此期間死亡。中位 DFSlung為 12個月(95%CI0.000~24.947),中位 DFSbrain為 7 個月(95%CI0.526~13.474),中位 OS為 20個月(95%CI 13.934~26.066)。見表1。
2.2 APE1在肺原發灶與腦轉移灶免疫組織化學結果APE1陽性產物呈棕黃色顆粒狀,呈細胞核表達,細胞核/漿共表達,或細胞質表達。其中,肺原發病灶中單純細胞核表達為7例(63.6%)(圖lA),細胞核/細胞質聯合表達2例(18.2%)(圖1B),單純性細胞質表達為1例(9.1%)(圖1C),APE1表達陰性者為1例(9.1%)。而腦轉移灶單純細胞核表達為9例(81.8%)(圖2A),細胞核/細胞質聯合表達1例(9.1%)(圖2B),單純性細胞質表達為1例(9.1%)(圖2C)。
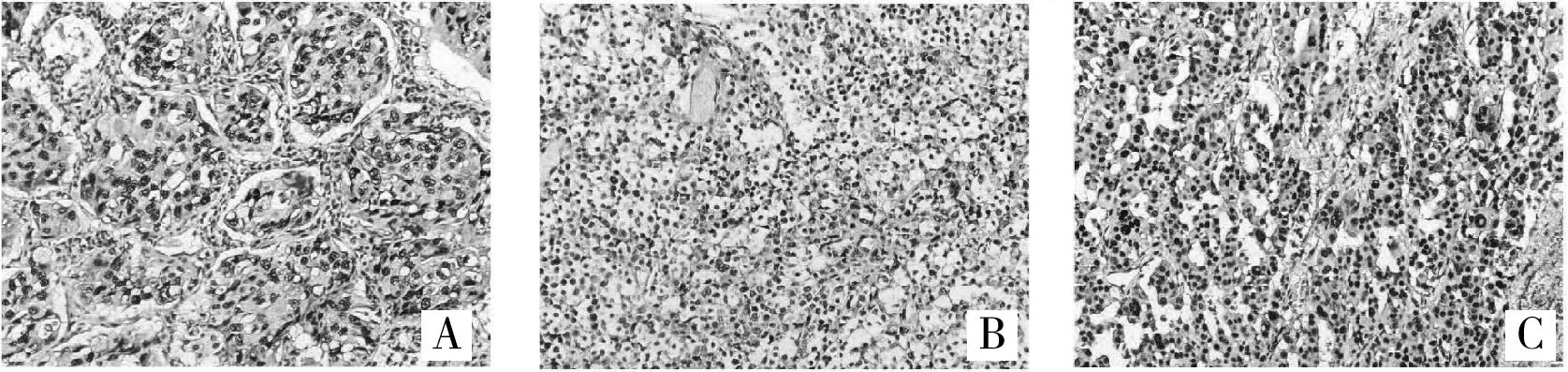
圖1 肺原發灶APE1蛋白表達(SP,400×)
肺原發病灶及腦轉移病灶APE1的表達強度也存在一定差異。肺原發灶中6例(54.5%)患者表達強度為+++,1例(9.1%)患者表達強度為++,3例(27.3%)患者表達強度為+;腦轉移病灶中APE1表達強度為+++有 8例(72.7%),表達強度為++有 1例(9.1%),表達強度為+2例(18.2%),腦轉移灶多呈APE1高表達狀態。進一步配對分析發現,11例患者中肺原發病灶及腦轉移病灶APE1的表達水平一致6例(54.5%),均為高表達;APE1的亞細胞定位一致5例(45.5%),且均為核表達。有2例患者肺原發病灶及腦轉移病灶APE1的表達強度及其亞細胞定位均一致。但統計分析結果提示,肺原發灶APE1的表達強度及亞細胞定位與腦轉移病灶APE1并無明顯相關性(P>0.05)。
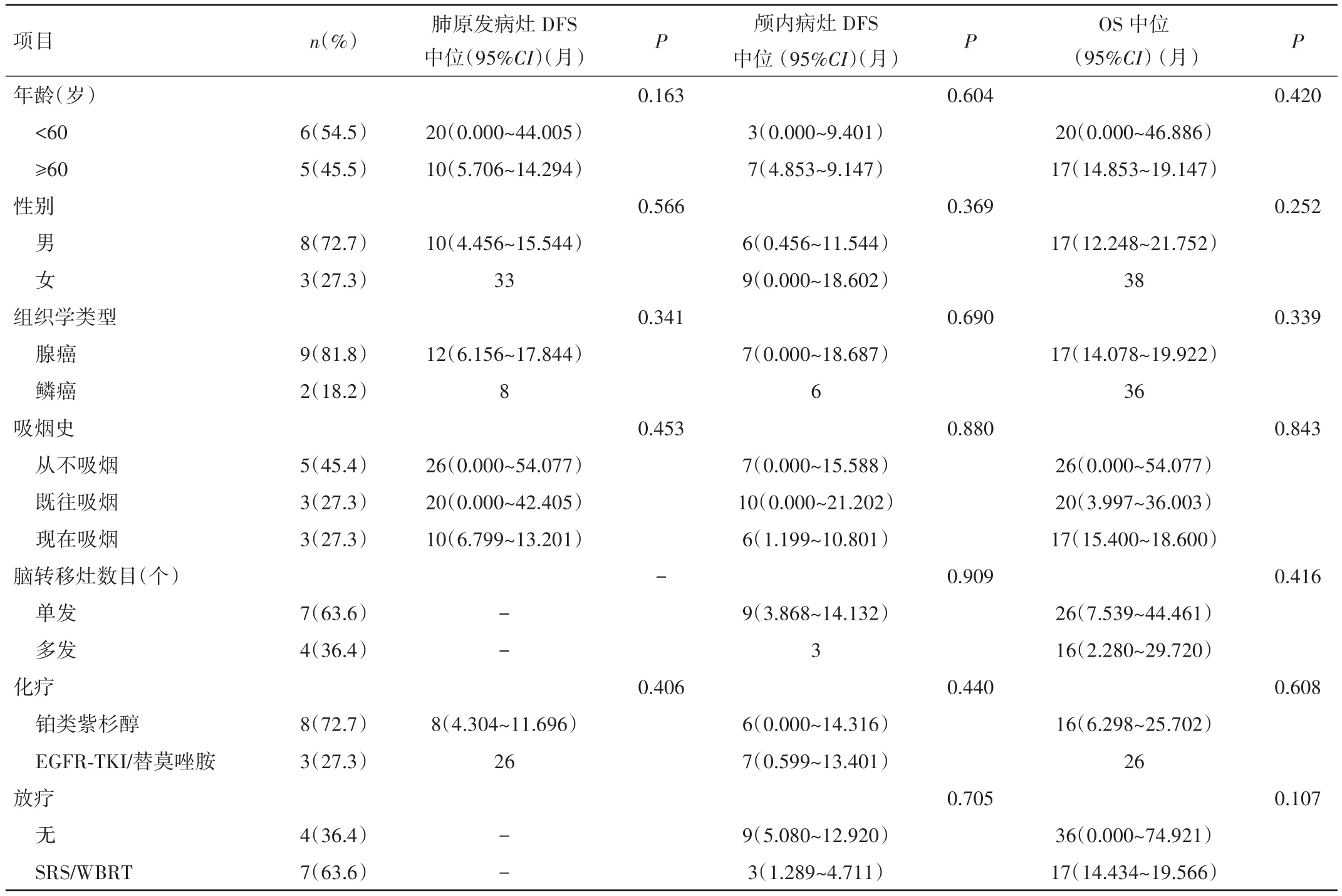
表1 影響DFS和OS的單因素分析
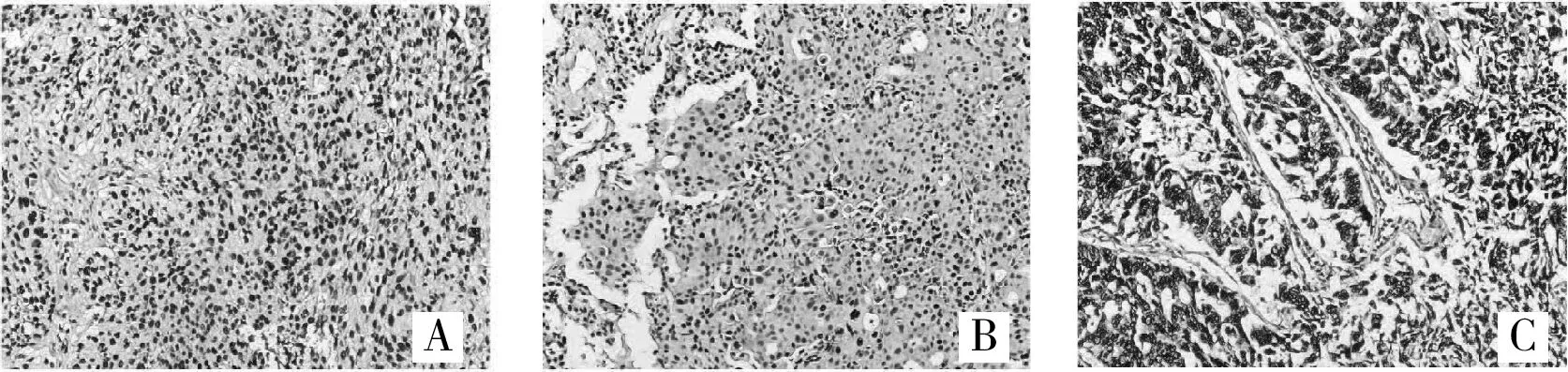
圖2 腦轉移灶APE1蛋白表達(SP,400×)
2.3 生存分析 11例患者存活1例,死亡10例;生存期為6~38個月,1、2年生存率分別為72.7%、36.4%。<60歲的患者肺部病灶中位DFS為20個月,長于大于60歲患者(20個月vs.10個月,P=0.163),OS也延長3個月(20個月vs.17個月,P=0.420);3例女性患者DFS及OS均較8例男性患者明顯延長(肺原發病灶DFS:33個月vs.10個月,P=0.566;腦轉移病灶DFS:9個月vs.6個月,P=0.369;OS:38個月vs.17個月,P=0.252)。鱗癌、從未吸煙、單發腦轉移的患者局部無病生存率及總生存率均更好。與8例僅接受TP方案化療的患者相比,3例接受過靶向治療的患者肺原發病灶DFS明顯延長(8個月vs.28個月,P=0.406),OS也有10個月的獲益(16個月vs.26個月,P=0.608)。肺原發病灶APE1的表達水平越高,越容易出現腦轉移(9個月vs.7個月,P=0.862),細胞質異位表達者較核表達者更早出現腦轉移(9個月vs.7個月,P=0.383)。見表1。
2.4 APE1的表達特點與ORR、DCR、DFS和 OS的關系 4例肺原發病灶APE1低表達者DCR達100.0%,而7例高表達者僅為85.7%。肺原發病灶APE1低表達組術后DFS為20個月,而高表達組為10個月(Log-Rank Test,P=0.166)。其中 1例肺原發病灶 APE1陰性患者,在隨訪期間內,肺部未出現局部的復發或進展,肺部無疾病進展期達到36個月。僅2例患者腦轉移灶APE1為低表達,其ORR、DCR均為100.0%,腦轉移病灶DFS達10個月,反之,高表達的9例患者中ORR僅為55.5%(5/9),腦轉移病灶DFS僅為6個月。
肺原發病灶APE1核表達者的DFS較細胞質異位表達者延長了12個月(20個月vs.8個月,P=0.828),同時,OS也明顯優于細胞質異位表達者(20個月vs.16個月,P=0.875)。腦轉移病灶APE1的亞細胞定位也呈現出與肺原發灶亞細胞定位一致的趨勢:核表達者DFS長于胞質異位表達者(7個月vs.3個月,P=0.666),且OS延長了10個月(20個月vs.10個月,P=0.935)。有5例患者肺原發病灶及腦轉移病灶APE1的亞細胞定位一致,均為細胞核表達,其中位OS甚至達到了26個月,而且該組人群T、N分期均較早,僅2例患者為N2、N3。另6例患者肺原發病灶或腦轉移病灶APE1均出現了細胞質異位表達,其中位OS僅為16個月(P=0.415),且 N 分期較晚,均為 N2、N3。見表2。
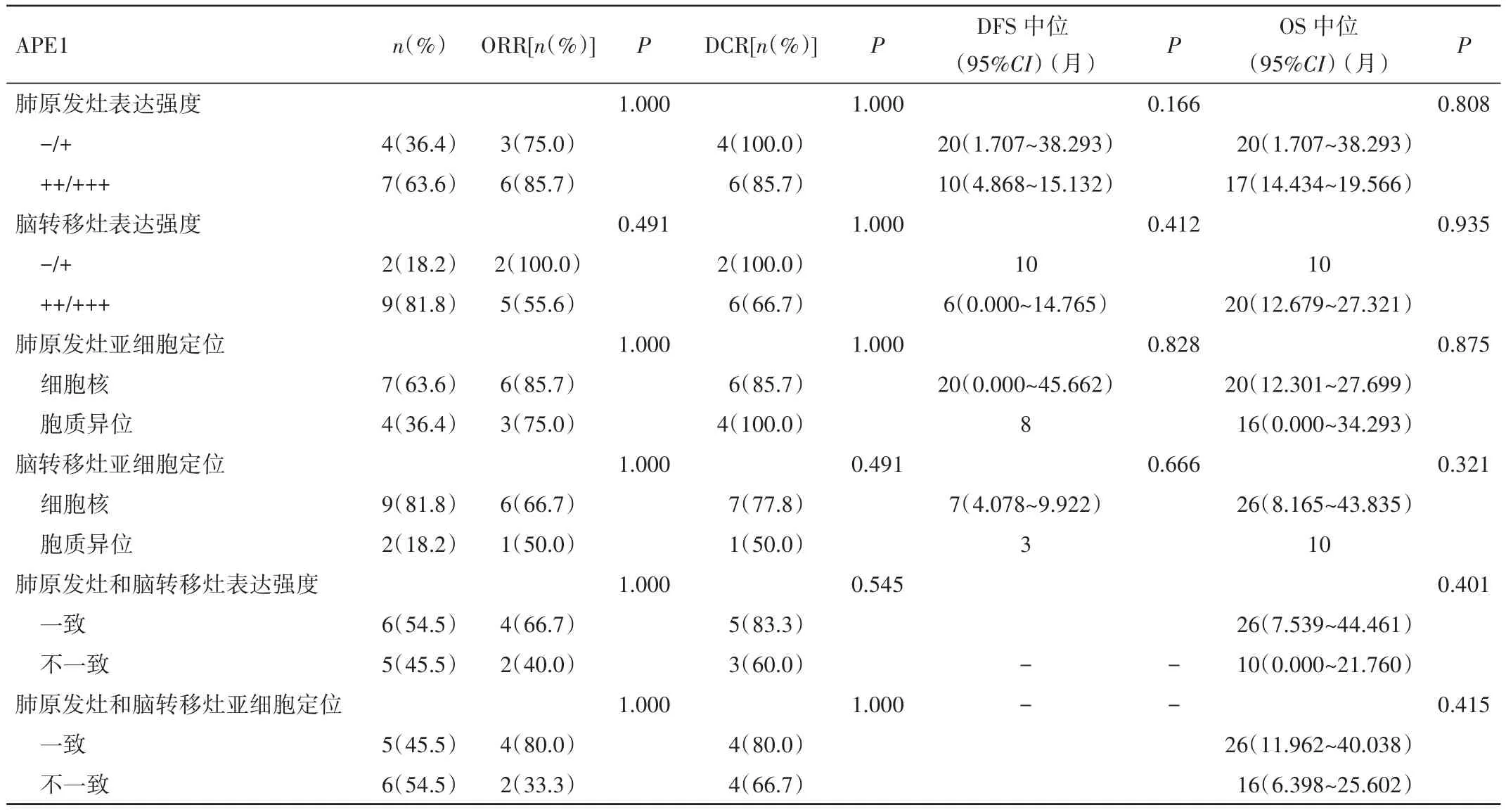
表2 APE1的表達特點與ORR、DCR、DFS和OS的關系
3 討 論
NSCLC一旦發生腦轉移,其預后極差,生存期僅2~4個月[2]。鑒于目前即使積極采取常用的腫瘤治療手段如化療、WBRT、SRS甚至手術切除單發腦轉移病灶等都不能達到令人滿意的DCR和生存率,患者的生存質量和預后仍較差。因此,很多學者致力于探討有關NSCLC腦轉移的新治療靶點和通路,嘗試新的研究策略,以提高治療效果。
APE1/Ref-1作為DNA堿基切除修復(BER)通路中的關鍵限速酶[3?4],不但能修復輻射、烷化劑和氧化引起的DNA損傷,而且能通過氧化還原機制調節多種轉錄因子(如 AP-1、p53、myb、HIF-1α、NF-κB 等)的 DNA結合活性及下游靶基因的表達,從而參與細胞的增殖與凋亡、細胞的氧化與應激、細胞周期調控等多種關鍵的細胞反應[5]。KAKOLYRIS等[13]在多種腫瘤組織中均發現與相應正常組織不同的APE1細胞分布形式,其中大腸癌較為典型。在正常的大腸黏膜、隱窩底部分化較低的細胞中主要APE1位于核內,但高分化和腸上皮表面細胞則主要在胞質;在腺瘤和癌中核內限制型分布喪失,取而代之的是以胞質分布為主的核-質共分布[13]。PUGLISI等[14]在另一項關于乳腺癌的研究中也發現、APE1細胞核、胞質定位與預后差顯著相關,APE胞核、胞質定位不依賴其他預后因素,如組織學分級、淋巴結有無轉移和腫瘤大小的獨立預后因子。在卵巢癌中細胞質表達通常是惡性的指征,與預后不良關系密切[15]。目前,已有研究證實,APE1亞細胞分布模式與腫瘤的侵襲性和預后有密切關系;核內型總是與較好的預后特征相關,例如較好的分化狀態、低度血管生成及淋巴結陰性等[16]。反之,胞質型和核-質型染色狀態則與不良的預后因素相關,比如,腫瘤血管生成的同時合并淋巴結和p53陽性[17]。除亞細胞定位發生變化外,在定量研究中發現腫瘤組織中APE1表達水平明顯改變。在宮頸癌、NSCLC、橫紋肌肉瘤和頭頸部鱗癌組織中,都能觀察到核內APE1水平明顯上升[18-22]。本課題組前期研究分析了60例人骨肉瘤組織,發現其中72%的APE1表達水平較高,推測其高水平APE1可能與骨肉瘤放、化療抵抗和預后不良相關[23]。并且采用免疫組織化學的方法檢測103例手術切除的NSCLC組織中APE1的表達,APE1低表達組無疾病進展期顯著長于APE1高表達組。該結果進一步表明,APE1基因表達增強可能是導致NSCLC患者放、化療效果差,預后不良的重要因素[23]。有研究還發現,在肺癌、乳腺癌、前列腺癌、宮頸癌等多種腫瘤中發現APE1擴增和(或)過表達,并與腫瘤細胞的惡性轉化、浸潤和轉移密切相關[16,18-22]。因此,目前普遍認為,APE1水平和其細胞分布的失調可作為預測腫瘤的侵襲性、腫瘤放射治療和化學治療的敏感性及預后的生物學指標[4,24-25]。
本研究為回顧性小樣本研究,對11例曾接受肺原發灶及腦轉移灶手術的NSCLC腦轉移患者進行了較為全面的分析,探討了肺原發病灶及腦轉移病灶APE1的表達強度及其亞細胞定位與治療的ORR、DCR、DFS及OS的相關性。從DFS和OS的單因素分析可以看出,女性、鱗癌、從未吸煙、單發腦轉移的患者對治療更為敏感,療效更好,局部控制時間更長,預后較好。與僅接受化療的患者相比,接受過靶向治療的患者有效率更高,本研究的這一結果與其他研究報道的:對于EGFR突變的患者,TKI類藥物的有效率優于含鉑雙藥方案的大約20%的客觀有效率是一致的[26-28];除了該方法具有更好的ORR外,接受過靶向治療的肺部DFS達到了26個月,比單純化療高出18個月,與顱內DFS兩者差別不明顯,說明化療藥物及TKIs藥物均不能有效地透過血腦屏障,對腦轉移病灶的作用有限,DFS的獲益部分轉化為最終的OS的獲益(16個月vs.26個月,P=0.608),這與 NEJGSG002、OPTIMAL 等第一代 EGFRTKIs藥物重要的隨機臨床研究結果一致[26-33]。對DFS和OS的多因素分析結果提示,性別、年齡、吸煙狀況、組織學類型、T分期、PS評分、肺部病灶APE1的表達強度及亞細胞定位、發生腦部轉移的時間等均與DFS、OS無明顯相關性,只有N分期和腦部病灶APE1的表達強度可能是腦轉病灶DFS的獨立預后因素,N分期越晚及腦轉移病灶APE1高表達者越容易出現腦轉移病灶的進展。但是,因總例數較少,無法得出明確結論,僅能顯示一定的趨勢。
APE1在11例患者肺原發病灶及腦轉移病灶的細胞核和(或)細胞質中均可見表達,腦轉移灶基因突變情況與原發灶不一致,腦轉移灶中存在更高的APE1表達。ASCO 會議 BARTOLOTTI等[34]、ZHANG 等[35]報道了一項旨在評價NSCLC腦轉移患者肺原發病灶EGFR突變率及EGFR-TKI治療有效率的回顧性研究,提示腦轉移NSCLC患者肺原發病灶存在更高的EGFR突變。KLOOSTERMAN等[36]對21例結直腸癌患者的47份腫瘤原發灶及其轉移病灶標本的1 264種癌癥相關基因進行了測序發現,在轉移灶中70種表達于原發病灶的單核苷酸變異(SNV)丟失,而出現了83種在數條關鍵通路中起作用的新變異,并且在對篩選合適的患者進行靶向治療時,轉移病灶變異較原發病灶更能代表腫瘤基因組的完整狀。本研究結果顯示,僅有2例患者肺原發病灶及腦轉移病灶APE1的表達強度及其亞細胞定位均一致,NSCLC患者腦轉移病灶存在更高的APE1表達。綜上所述,腫瘤的原發病灶和轉移病灶之間的基因變異具有不一致性。因此,不能簡單地通過肺原發病灶某個基因的表達特點來預測腦轉移病灶中該基因的表達,且作為治療預測預后的指標。在NSCLC腦轉移的演進過程中,是否有關鍵基因的丟失或產生新的基因變異,目前尚無人可以給出明確的回答,還值得進一步深入研究。
在APE1的表達特點與ORR、DCR的相關性分析中發現,APE1的高表達與放、化療抵抗,預后差相關。同樣,對于治療過程中才出現腦轉移的患者,腦轉移發生的時間與肺原發病灶APE1的表達強度及亞細胞定位存在明顯的相關性。表達強度越高及胞質異位表達者,越容易出現腦轉移,這說明APE1的擴增或過表達與腫瘤細胞的侵襲和轉移相關。
最后,APE1的表達特點與DFS和OS的相關性是本研究的主要目標,無論是肺原發病灶還是腦轉移病灶,APE1表達強度越高,越容易出現局部復發,肺原發病灶與腦轉移病灶APE1核表達者的DFS優于胞質異位表達者。而肺原發病灶APE1核表達者OS更長。但值得注意的是,有1例患者肺原發病灶APE1表達陰性,腦轉移病灶表達為+,肺部病灶持續穩定,遠處轉移導致其治療失敗,而OS達到了36個月;而首診時即出現腦轉移的4例患者其腦轉移病灶APE1的表達均為高表達,以上結果均提示APE1表達越高,其侵襲能力增強,治療敏感性下降,預后越差。此外,作者還發現,APE1的亞細胞定位與T、N分期相關,核表達者T、N分期均較早,而胞質異位表達,N分期較晚,均為N2、N3,說明APE1亞細胞分布模式與腫瘤的侵襲性和預后有密切關系,核內型總是與較早的T分期、較少的淋巴結轉移、較好的預后相關;相反,胞質型和核-質型染色狀態則與不良的預后因素相關。綜上所述,無論是肺原發病灶或是腦轉移病灶,APE1表達強度越高,其療效越差,預后越差;而APE1表達陰性或低表達的患者生存期明顯延長;APE1的細胞質異位表達則提示APE1隨著腫瘤病程的進展而增強,表現為由細胞核表達向細胞質表達過渡;當細胞質出現APE1強表達時可作為惡性生物學行為的標志,雖然這一結果無顯著統計學差異,但與作者前期352例大樣本回顧性研究已證實APE1基因的多態性與含鉑方案一線化療的晚期NSCLC的預后、不良反應具有相關性這一結果保持了高度一致性[19]。
總之,本研究證實APE1在NSCLC肺原發病灶及腦轉移病灶中的表達水平及其細胞分布具有差異,APE1的高表達及細胞質異位表達可降低其治療敏感性,與預后差相關。本研究的局限性在于樣本量不足,不能很好地對數據進行分層分析。本研究已發現顯著的臨床趨勢,還需要通過擴大樣本量來進一步驗證。后續的研究首選需增加樣本量,同時側重于功能的檢測,如DNA修復能力的測定將用于進一步研究DNA堿基切除修復基因單核苷酸多態性及與治療反應性和患者預后的關系,為基于分子變異的個體化治療這一新的治療模式提供理論依據。

