RNAi沉默survivin和HIF-1α基因對胃癌BGC-823細胞體外增殖和凋亡的影響
王 淼,母潤紅,李明成,李洪杰
(1.北華大學醫學檢驗學院免疫教研室,吉林 吉林 132013; 2.北華大學基礎醫學院免疫教研室,吉林 吉林 132013)
胃癌是全球最常見的惡性腫瘤之一,嚴重威脅人類健康。中國是胃癌高發國家,胃癌發病率和死亡率均高于全球平均水平,在全球居第4位。目前,胃癌可通過放化療等多種方式治療,但缺少對早期胃癌的篩查及診斷,大多數胃癌患者確診時己進入進展期,導致術后出現復發或喪失了手術的最佳機會[1-2]。隨著分子生物學技術的發展,從分子水平研究胃癌的發病原因,尋找胃癌進展的基因將對胃癌的綜合治療有重要的意義[3-4]。腫瘤的發生發展并非單基因和單因素過程,而是多基因和多因素的復雜過程,抑制其基因的表達,可控制腫瘤的發生[4]。RNA干擾(RNA interference,RNAi)是進行靶基因表達抑制的核酸操作技術,現已成為研究腫瘤基因治療的有效工具[5-6]。survivin基因是凋亡抑制蛋白(inhibitors of apoptosis protein,IAP)家族新成員之一,由于其僅在腫瘤和胚胎細胞中特異表達,因而成為腫瘤基因治療的特異性靶點。國內外研究[7-8]表明:靶向沉默survivin基因的表達能抑制多種腫瘤細胞增殖并促進其凋亡。缺氧誘導因子1α(hypoxia inducible factor 1α,HIF-1α)是普遍存在于實體瘤組織中,抑制其表達對抑制腫瘤的發生發展也可能有重要的臨床指導意義[9]。本研究采用RNAi技術沉默胃癌BGC-823細胞中survivin和HIF-1α雙基因的表達,觀察其對胃癌細胞增殖和凋亡的影響,為胃癌早期診斷和治療提供新思路。
1 材料與方法
1.1 細胞、試劑和主要儀器 人胃癌BGC-823細胞(北華大學藥學院藥理實驗室保存),DMEM培養液和胎牛血清(杭州四季青生物工程材料有限公司),真核轉染試劑HifectinⅡ(北京普利萊基因技術有限公司),TRIzol試劑和AnnexinⅤ/PI雙染試劑盒(美國Invitrogen公司),逆轉錄聚合酶鏈反應(RT-PCR)試劑盒(日本TaKaRa公司),RIPA裂解液、兔抗人survivin和HIF-1α多克隆抗體及BCA蛋白濃度測定試劑盒(武漢博士德公司),臺盼藍(美國Sigma公司),辣根過氧化物酶標記的山羊抗兔IgG 抗體(北京中杉金橋生物技術有限公司)。
1.2 小干擾RNA(siRNA)設計策略 根據siRNA設計原則,從GenBank數據庫選擇survivin和HIF-1α的mRNA序列(NM_001168.2;NM_001012270.1;NM_001012271.1;XR_243654.2)基因信息,確定符合siRNA特征的靶序列,分別命名為siRNA-survivin和siRNA-HIF-1α,同時合成錯義RNA(scramble RNA,SCR)作為陰性對照(表1)。此外,設計熒光標記的無靶向siRNA(FAM-siRNA)用于測定siRNA的細胞轉染效率。siRNA合成和構建由上海吉瑪生物技術制藥公司完成。
1.3 人胃癌BGC-823細胞培養和轉染 人胃癌BGC-823細胞用含10%胎牛血清的高糖DMEM培養基,置于37℃、5% CO2、飽和濕度的恒溫培養箱中培養。每48 h傳代1次,取生長狀態良好的BGC-823細胞,以每孔1.2×105個細胞接種于6孔培養板中,24 h后待細胞鋪滿每孔約80%,將培養液換為無血清培養基,細胞轉染整個步驟完全按照HifectinⅡ真核轉染試劑提供的說明書操作。轉染siRNA-survivin、siRNA-HIF-1α和 SCR的各組細胞分別命名為sis組、siH組和非靶向特異性組(SCR組),同時設空白對照組(無血清培養基)。轉染效率=熒光陽性細胞數/篩選細胞總數×100%。

表1 人survivin和HIF-1α基因特異性干擾序列
1.4 RT-PCR法檢測細胞中survivin和HIF-1α mRNA表達水平 用TRIzol試劑提取sis組、siH組、SCR組和空白對照組BGC-823細胞的總RNA,經紫外分光儀測定RNA的濃度及純度。凝膠電泳觀察RNA的完整性。應用RT-PCR試劑盒逆轉錄為cDNA,以cDNA為模版,進行RCR擴增,檢測各組細胞中survivin和HIF-1α mRNA表達情況。PCR產物經1.5%瓊脂糖凝膠電泳后,在紫外成像儀中應用Tanon2500 Gel Imaging system 軟件獲取圖像,以GADPH作為內參,根據2-△△Ct法計算mRNA表達水平,每組實驗重復3次,取平均值。
1.5 MTT法檢測細胞增殖活性 取對數生長期BGC-823細胞接種于96孔板中,接種細胞數每孔3×103個,體積100 μL,每組設6復孔,終濃度均為100 nmol·L-1。實驗分為單干擾組(survivin-siRNA,sis組)、聯合干擾組(survivin-siRNA+HIF1α-siRNA,sis+siH組)、非靶向特異性組(SCR組)和空白對照組(無血清培養基)。轉染24、48和72 h,終止培養,各孔加入5 g·L-1MTT 20 μL,繼續孵育4 h,棄去上清,各孔加入DMSO 100 μL,繼續振搖10 min,充分溶解結晶,于酶標儀上490 nm處測定吸光度[A(490)] 值,以A(490)值代表細胞增殖活性。
1.6 Western blotting 法檢測細胞中survivin和HIF-1α蛋白表達水平 分組方法同1.5 。轉染后48 h,用試劑盒提取各組BGC-823細胞總蛋白。采用BCA法檢測總蛋白濃度。采用SDS-PAGE電泳分離。一抗為兔抗人survivin單克隆抗體(稀釋濃度1∶200)、HIF-1α單克隆抗體(稀釋濃度1∶300)和GADPH單克隆抗體(稀釋濃度1∶500),4℃過夜。再次用PBST洗膜,加入已稀釋的山羊抗兔二抗-HPR(稀釋濃度1∶2 000),置于室溫搖床孵育1 h。ECL顯影。以各實驗組灰度值與對照組灰度值之比表示蛋白相對表達水平。
1.7 流式細胞術檢測細胞凋亡率 分組方法同1.5 。轉染24 h后細胞用胰酶消化,PBS洗滌2次,制備成細胞懸液,加入5 μL Annexin Ⅴ-FITC 和5 μL PI染液,避光室溫孵育10 min,采用流式細胞術檢測細胞凋亡情況,結果應用WinMDI 2.9分析軟件進行分析。細胞凋亡率=凋亡細胞數/(凋亡細胞數+正常細胞數)×100%。
2 結 果
2.1 siRNA轉染胃癌BGC-823細胞效率的鑒定 siRNA成功轉染BGC-823細胞6 h后,PBS洗滌3~4次,在激光共聚焦顯微鏡下觀察各組細胞siRNA轉染效率。siRNA主要集中在細胞質中,轉染成功的細胞有清晰的細胞輪廓,與背景形成明顯的反差 (圖1,見插頁三)。熒光標記siRNA轉染細胞效率大于70%,可以完成后續實驗。
2.2 各組細胞中survivin 和HIF-1α mRNA表達水平 轉染48 h后各組細胞均有亮度相似的GADPH基因條帶表達,各組survivin/GADPH比值代表survivin基因的mRNA表達水平(圖2),HIF-1α/GADPH比值代表HIF-1α基因的mRNA表達水平(圖3)。與SCR組和空白對照組比較,sis組細胞中survivin mRNA表達水平和siH組細胞中HIF-1α mRNA表達水平明顯降低(P<0.05或P<0.01);SCR組與空白對照組比較差異無統計學意義(P>0.05)。見表2和3。
Lane 1: Blank control group; Lane 2:SCR group; Lane 3:Sis group.
圖2 轉染48 h后各組細胞中survivin mRNA表達電泳圖
Fig.2 Electropheregram of expressions of survivin mRNA in cells in various groups 48 h after transfection
Lane 1:Blank control group; Lane 2: SCR group; Lane 3:SiH group.
圖3 轉染48 h后各組細胞中HIF-1α mRNA表達電泳圖
Fig.3 Expression levels of HIF-1α mRNA in cells in various groups 48 h after transfection
表2 轉染48 h后各組細胞中survivin mRNA表達水平


GroupSurvivin mRNABlank control 0.927 0±0.021 7SCR 0.947 5±0.032 6Sis 0.457 3±0.021 4?△
*P<0.01 compared with blank control group;△P<0.01 compared with SCR group.
2.3 各組細胞增殖活性 與空白對照組比較,SCR組細胞增殖活性無明顯變化(P>0.05),sis組和sis+siH組細胞增殖活性明顯降低(P<0.05),生長曲線低平,且sis+siH組細胞增殖活性明顯低于sis組(P<0.05)。見圖4和表4。
2.4 各組細胞中surviving和HIF-1α蛋白表達水平 與空白對照組比較, sis組surviving蛋白表達水平、sis+siH組surviving和HIF-1α蛋白表達水平明顯降低(P<0.05);SCR組與空白對照組比較差異無統計學意義(P>0.05)。見圖5和表5。
表3 轉染48 h后各組細胞中HIF-1α mRNA表達水平


GroupHIF-1α mRNABlank control 0.826 3±0.032 6SCR 0.832 4±0.012 7SiH 0.351 6±0.011 6?△
*P<0.05 compared with blank control group;△P<0.05 compared with SCR group.
圖4 轉染不同時間各組BGC-823細胞增殖活性
Fig.4 Proliferation activities of BGC-823 cells in various groups at different time after transfection
表4 各組BGC-823細胞增殖活性
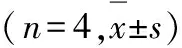

Group A(490)(t/h) 2448 72Blank control0.867 6±0.041 41.241 0±0.084 1 1.928 0±0.077 9SCR0.934 1±0.052 51.278 0±0.069 0 2.004 0±0.095 0Sis0.418 2±0.044 3?0.579 0±0.034 0? 1.349 0±0.156 5?Sis+siH0.313 7±0.032 2?△0.467 5±0.055 1?△ 0.941 0±0.096 1?△
*P<0.05 compared with blank control group;△P<0.05 compared with sis group.
2.5 各組細胞凋亡率 轉染48 h后,與空白對照組比較,sis組和sis+siH組細胞凋亡率明顯升高(F=109,P<0.01);空白對照組與SCR組間比較差異無統計學意義(P>0.05);sis+siH組細胞凋亡率略高于sis組,但組間比較差異也無統計學意義(P>0.05)。見圖6和表6。
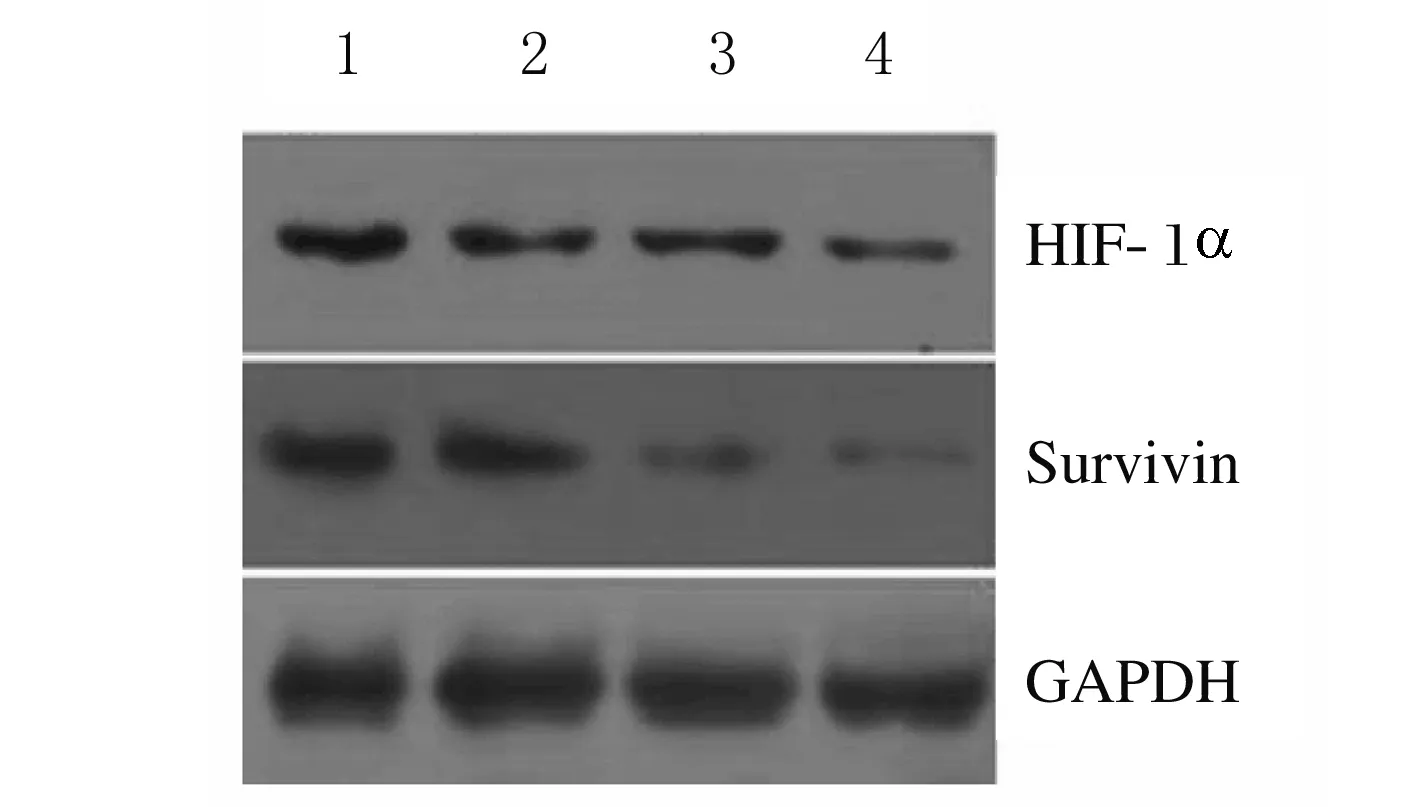
Lane 1: Blank control group; Lane 2:SCR group; Lane 3:Sis group; Lane 4:Sis+siH group.
圖5 各組細胞中survivin和HIF-1α蛋白表達電泳圖
Fig.5 Electrophoregram of expressions of survivin and HIF-1α proteins in cells in various groups
表5 各組細胞中survivin和HIF-1α蛋白表達水平
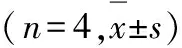
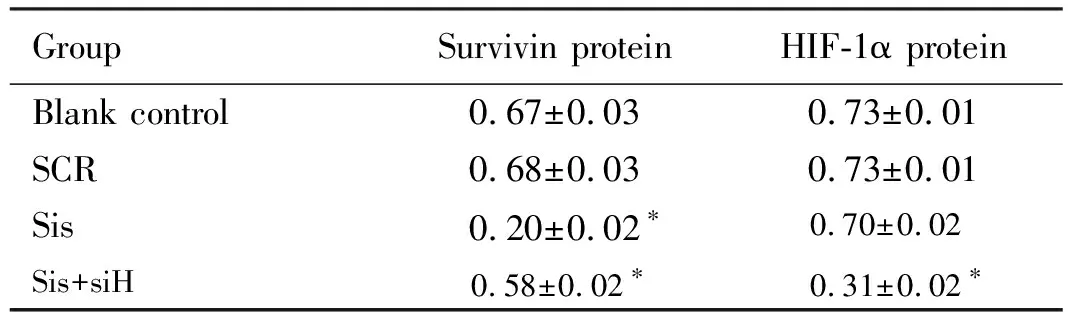
GroupSurvivin proteinHIF-1α proteinBlank control0.67±0.030.73±0.01SCR0.68±0.030.73±0.01Sis 0.20±0.02? 0.70±0.02Sis+siH 0.58±0.02? 0.31±0.02?
*P<0.05 compared with blank control group.
3 討 論
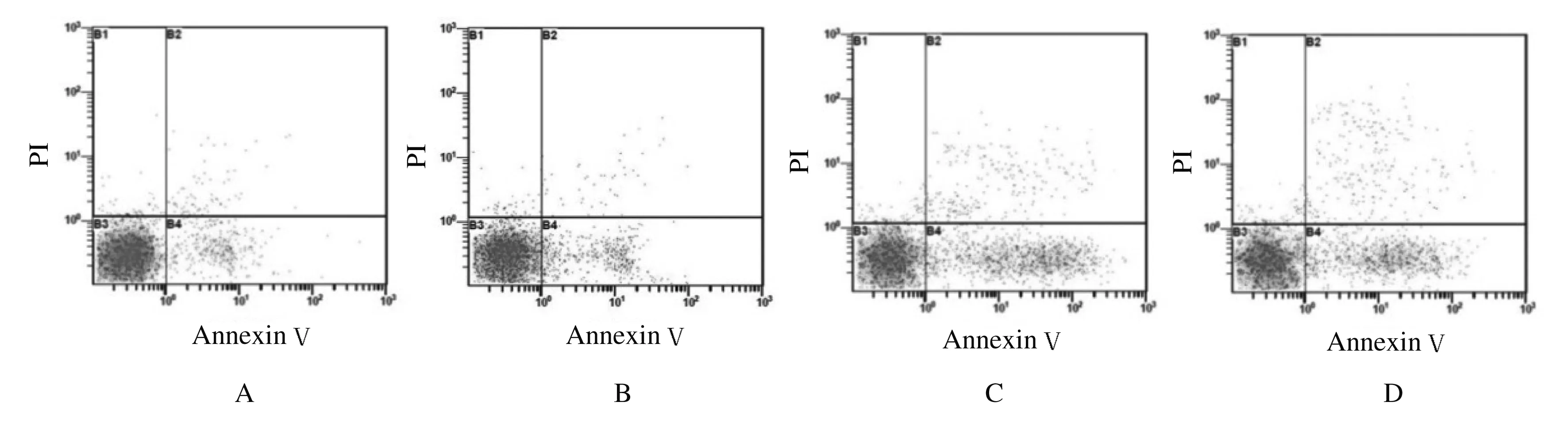
A: Blank control group; B:SCR group; C:Sis group; D:Sis+siH group.
表6 各組細胞凋亡率
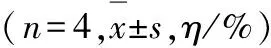

GroupApoptotic rateBlank control11.54±2.67SCR13.00±2.32Sis16.70±2.03?Sis+siH16.74±3.03?
*P<0.01 compared with blank control group.
研究[10-11]顯示:特異性抑制腫瘤細胞中靶向基因的表達,可有效抑制腫瘤細胞的侵襲,發揮腫瘤基因治療作用。研究[12-14]表明:survivin和HIF-1α在胃癌細胞內均有一定程度的表達,阻斷 其表達可抑制腫瘤細胞的生長。國內外學者成功地利用了RNAi技術沉默survivin,可明顯抑制胃癌SGC-7901和BGC-823細胞生長增殖[15-17],本研究結果也證實了該結論。本研究結果顯示:轉染48 h后,sis組和sis+siH組胃癌BGC-823細胞的生長受到明顯抑制,生長曲線低平,且sis+siH組的生長抑制作用明顯強于sis組。本研究結果表明:抑制胃癌BGC-823細胞中surviving和HIF-1α基因表達水平可降低胃癌細胞增殖能力。腫瘤細胞生長一方面由細胞周期的細胞數決定,另一方面也取決于細胞增殖與細胞死亡的比例[18-21]。因此,可通過檢測surviving和HIF-1α對胃癌BGC-823細胞凋亡的影響,來評價細胞增殖與凋亡之間的關系。本研究結果顯示:sis組和sis+siH組胃癌BGC-823細胞凋亡率明顯高于空白對照組和SCR組,空白對照組與SCR組間比較無明顯差異;sis+siH組細胞凋亡率略高于sis組,但組間比較差異無統計學意義。有研究[18]通過靶向誘導內皮細胞凋亡抑制腫瘤血管新生,結果顯示:促凋亡蛋白Bm和Bax表達及細胞色素C(CytC)的釋放明顯增加,而HIF-1α是血管內皮生長因子C(VEGF-C)的上游基因。本研究將surviving和HIF-1α基因作為靶向沉默基因,主要是利用該基因由線粒體釋放入胞漿,通過內源性凋亡途徑誘導細胞凋亡。
本研究利用Hifectin Ⅱ真核轉染試劑,將預先合成的HIF-1α和survivin 特異性siRNA直接轉染胃癌BGC-823細胞,避免了構建表達載體的過程。此外,為便于觀察,將熒光標記的無靶向siRNA(FAM-siRNA)一同轉染細胞內,用于測定siRNA的細胞轉染效率。本研究結果顯示:HifectinⅡ作為一種陽離子脂質體轉染試劑,與應用最為廣泛的Lipo2000比較,具有轉化效率高和操作便捷的優點。
綜上所述,RNAi沉默survivin和HIF-1α雙靶點基因,可抑制胃癌BGC-823細胞增殖,促進其凋亡。本研究結果初步提示:沉默survivin和HIF-1α基因有望成為胃癌基因治療的新方法,但其具體的分子作用機制仍需進一步研究。

