金 納 米 花 的 快 速 可 控 制 備 及 應 用
郭 攀, 郭新秋, 殷 姍, 陳 峰, 何 琳
(上海交通大學 a.化學化工學院;b.分析測試中心,上海 200240)
0 引 言
金納米花獨特的光學性質、高的光熱轉化效率、良好的生物相容性,在表面增強拉曼散射、生物醫用材料等方面得到普遍應用,并引起了研究者的重視[1-5]。
制備金納米花的主要方法是模板法[6]。表面活性劑在金納米花生長過程中起到模板-結構導向劑作用,對其形貌調控起到至關重要的作用[7-9]。目前合成金納米花的表面活性劑主要有:聚乙烯吡咯烷酮(PVP)[10]、N-(2-羥乙基)哌嗪-N-2-乙烷磺酸(HEPES)[11-12]、六亞甲基-1,6-雙(十二烷基二甲基銨溴)(C12C6C12Br2)[13]和N,N,N’-二甲基-N,N’-二十四烷基乙烷-1,2-二胺(C14C2C14Br2)[4]等。Xie等[14]采用HEPES為表面活性劑制備金納米花,以牛血清白蛋白為穩定劑,羅丹明B為拉曼探針,檢測出細胞內拉曼信號。Jia等[15]用十八烷基胺(C18N3)制備金納米花,獲得多分枝的金納米花,極大增強了表面拉曼散射強度。金納米花的制備雖然較成熟,但仍存在一些問題:① 制備時間長;② 金納米花不穩定;③ 生物相容性差。
HED3A[16]與金屬離子具有超強的螯合作用,且穩定性高和結構導向強。因此,本文采用HED3A作為合成金納米花的表面活性劑,高效制備出穩定性高、拉曼信號增強效果顯著和生物相容性好的金納米花。通過改變HED3A、AA和HAuCl4濃度,實現了對金納米花的形貌調控。該反應快速,1 min完成,制得的金納米花有以下優點:① 穩定性高,12個月形貌無變化;② 拉曼散射信號增強效果顯著,R6G檢出限可達10 nmol/L;③ 生物相容性好。
1 實驗部分
1.1 實驗試劑及儀器
主要試劑:氯金酸(HAuCl4·3H2O)、抗壞血酸(AA)、羅丹明6G(R6G)、二甲基亞砜(DMSO)(均購于國藥集團化學試劑),噻唑藍(MTT)購于Aldrich,細胞培養基(DMEM)、胎牛血清(FBS)購于PAA公司,大鼠肝臟細胞(BRL-3A)購于中科院上海細胞所。
主要儀器:FEI生物型透射電鏡(Tecnai G2 spirit Biotwin,)、核磁共振波譜儀(AvanceⅢ400 MHz,Bruker)、紅外光譜儀(IR/Nicolet 6700,Agilent)、高液相色譜-線性離子阱質譜聯用儀(HPLC1260<QXL,Thermo-fisher)、紫外可見分光光度計(UV/EV300,Thermo Electron CORP)、色散型共聚焦拉曼光譜儀(Senterra R200-L,Bruke)、酶標儀(Elx800,BioTek)。
1.2 金納米花的制備
根據文獻[16]中制備HED3A。取4個燒杯,依次加入不同濃度的HED3A溶液,混合均勻后分別加入HAuCl4,AA,1 min內溶液顏色由黃色變成褐色或紫色,證明反應完全,離心10 min,1 000 r/s,上清液除掉,將得到的金納米花分散在超純水中。
1.3 金納米花形貌的調控
1.3.1HED3A濃度的影響
將4 mL濃度為0.1、1、10及50 mmol/L的HED3A分別加入到反應體系中,然后加入2 mL 2 mg/mL的HAuCl4和 0.2 mL 0.08 mol/L的AA,其他制備過程與1.2節相同。
1.3.2AA濃度的影響
將4 mL 1 mmol/L的HED3A溶液,2 mL 2 mg/mL的HAuCl4溶液分別加入到反應體系中,然后加入2 mL濃度為0.06、0.08 、0.12及0.2 mol/L的AA溶液,其他制備過程與1.2節相同。
1.3.3HAuCl4濃度的影響
將4 mL 1 mmol/L的HED3A溶液分別加入到反應體系中,然后加入2 mL濃度為0.5、1、2及3 mg/mL的HAuCl4溶液和2 mL 0.08 mol/L的AA溶液,其他制備過程與1.2節相同。
1.3.4溫度的影響
向體系中分別加入4 mL 1 mmol/L的HED3A,2 mL 2 mg/mL的HAuCl4溶液,2 mL 80 mmol/L的AA溶液,改變反應溫度20 °C、30 °C、50 °C、80 °C,其他制備條件與1.2節相同。
1.4 表面增強拉曼光譜的測試
以R6G為拉曼探針,金納米花為基底,使用激發波長532 nm激光器,激發功率10 mV,曝光時間10 s。
1.5 細胞毒性測定
將BRL-3A細胞種植于96孔板中,放在培養箱(5% CO2和37 ℃)中培養,當細胞完全貼壁后,加不同濃度的金納米花,繼續培養細胞24 h或48 h后,加入MTT溶液,再將96孔板培養4 h后,加入DMSO,酶標儀測定490 nm處的吸光(A)值。
2 結果與討論
2.1 HED3A濃度的影響
保持體系中V(AA0.08 mol/L)=0.2 mL,V(HAuCl4 2 mg/mL)=2 mL不變,當HED3A濃度從0.1 mmol/L增加到10 mmol/L時,金納米花形貌由致密變得疏松(見圖1(a)~(c));隨著濃度繼續增大,則生成金納米球(見圖1(d))。由此可見,HED3A可有效調控金納米花的形貌,在金納米花合成過程中起到結構導向劑的作用。這種現象與有限配體和充足配體保護效應有關[17-18]。當HAuCl4及AA的濃度相同,HED3A濃度較低時,初期產生的金納米晶由于表面包裹的表面活性劑較少,為了減少體系的表面能,生成的金納米晶不穩定,作為晶核聚集成金納米花。隨著表面活性劑濃度的增加,包裹在金納米晶表面的表面活性劑較多,使金納米晶無法進行各向異性生長,從而生成最穩定的球形。


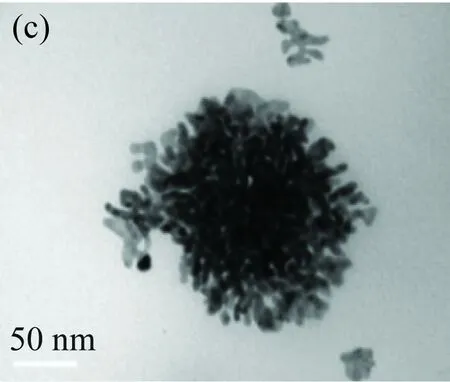

(a)0.1 mmol/L,(b)1 mmol/L,(c)10 mmol/L,(d)50 mmol/L
2.2 AA濃度的影響
保持體系中V(HED3A 1 mmol/L)=4 mL,V(HAuCl4 2 mg/mL)=2 mL不變,當AA濃度為0.06 mol/L時,得到金納米花結構較致密(見圖2(a));隨著AA濃度增加,金納米花形貌沒有顯著變化(見圖2(b)~(d))。表明AA濃度對金納米花形貌影響不大,不能實現對金納米花形貌的有效調控。當HED3A、HAuCl4濃度一定時,改變AA濃度,只是稍微改變金納米晶生長速度,對金納米花形貌影響不顯著。

(a)

(b)
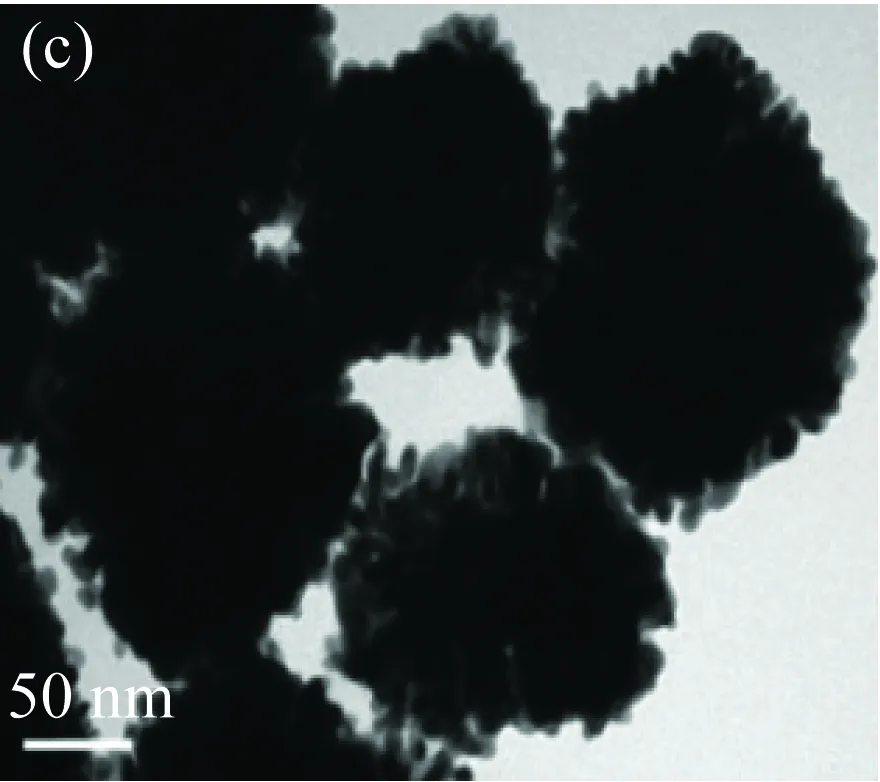
(c)

(d)
2.3 HAuCl4濃度的影響
保持體系中V(HED3A 1 mmol/L)=4 mL,V(AA 0.08 mol/L)=0.2 mL不變,當HAuCl4濃度小于0.5 mg/mL時,制備得到的是金納米球(見圖3(a));當濃度從0.5 mg/mL 增加至3 mg/mL時,制備得到金納米花(見圖3(b)~(d))。由此可知,改變HAuCl4濃度,可有效改變金納米花的形貌。當HED3A、AA濃度一定,HAuCl4濃度較低時,初期得到的金納米晶數目少,包裹在單個金納米晶表面的表面活性劑相對較多,阻止了金納米晶各向異性生長,趨向于生成最穩定的球形;隨著氯金酸濃度增加,初期生產的金納米晶數目增多,則單個金納米晶表面包裹的表面活性劑較少,金納米晶不穩定,聚集生成金納米花。
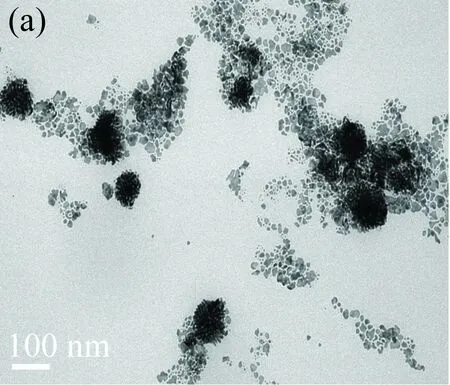



(a) 0.5 mg/mL,(b)1 mg/mL, (c)2 mg/mL, (d)3 mg/mL
2.4 溫度的影響
保持體系中V(HED3A 1 mmol/L)=4 mL,V(HAuCl4 2 mg/mL)=2 mL,V(AA 0.08 mol/L)=0.2 mL,不變,改變反應溫度,當溫度在10~50 °C變化時,得到金納米花(見圖4(a)~(c));當溫度升高到80 °C時,制得金納米球(見圖4(d))。表明控制溫度在80 °C以下,可有效地制備出金納米花。溫度過高,反應速度過快,得到金納米晶數目較多,制備得到金納米球。

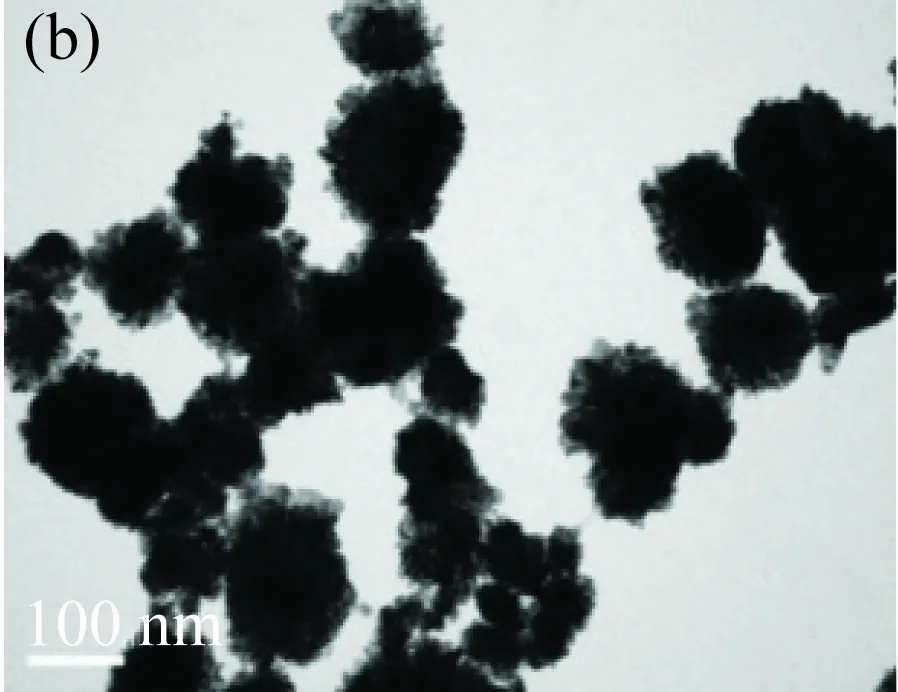


(a)20 °C,(b) 30 °C, (c) 50 °C, (d)80 °C
2.5 金納米花的穩定性測試
金納米花在室溫放置12月后,形貌基本沒有變化(見圖5(a)~(b)),表明此金納米花的穩定性好,可長期保存。
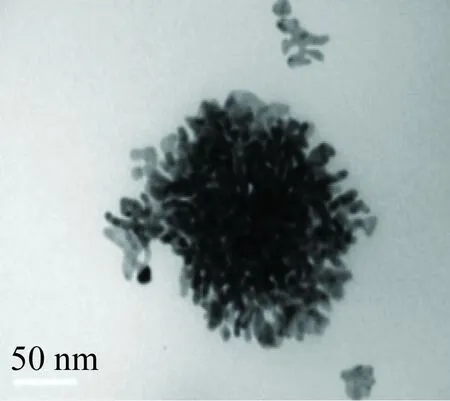

(a)0個月 (b)12個月
2.6 SERS性能測試
以金納米花作為拉曼基底,測得R6G的拉曼信號檢出限可達10 nmol/L(見圖6),表明該金納米花可顯著增強R6G的拉曼信號,是一種較好的拉曼增強基底材料。
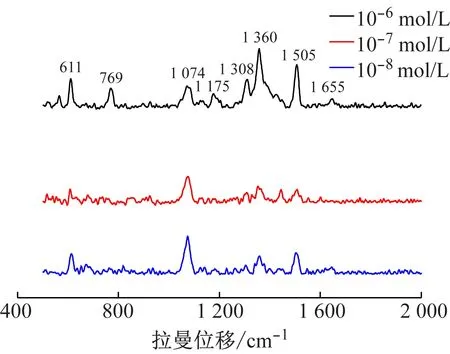
圖6 羅丹明6G的拉曼光譜圖
2.7 細胞毒性實驗
當金納米花的濃度達到4 mg/mL,與大鼠肝臟細胞共同培養48 h后,細胞的存活率仍>75%(見圖7),表明該金納米花具有較小的細胞毒性,是一種潛在的生物醫用材料。
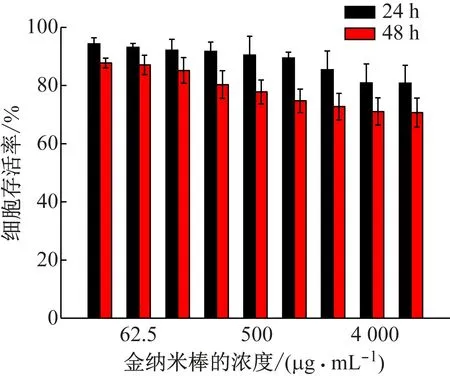
圖7 不同濃度的金納米花與大鼠肝臟細胞共同
3 結 語
本文以HED3A作為制備金納米花的表面活性劑。通過改變反應條件,制備出形貌可控的金納米花。實驗發現:HED3A、HAuCl4及溫度可有效調控金納米花的形貌。
制備得到的金納米花穩定性高,拉曼增強效果顯著、細胞毒性小,是一種潛在的表面增強拉曼及生物醫用材料。

