熱消融治療甲狀腺良性結節的療效及相關因素分析
胡 珂, 劉凌曉, 陸志強
1. 復旦大學附屬中山醫院內分泌科,上海 200032 2. 復旦大學附屬中山醫院閔行分院內分泌科,上海 201199 3. 復旦大學附屬中山醫院介入科,上海 200032
甲狀腺結節較為常見,可因甲狀腺良惡性腫瘤、增生、囊腫等所致[1]。對于無癥狀的甲狀腺良性結節,定期隨訪即可;出現壓迫癥狀、影響美觀、導致患者心理障礙或影像學提示存在惡變可能時,需要積極干預[2]。由于熱消融創傷小、并發癥較少,其在甲狀腺良性結節中的應用日益增多[3-5]。但是,消融后壞死的病灶依靠自身吸收,而病灶縮小程度及所需時間均有個體差異。本研究分析了熱消融治療甲狀腺良性結節后影響結節縮小的相關因素,從而為臨床治療提供參考。
1 資料與方法
1.1 一般資料 選擇2016年6月至2017年3月在我院接受局部熱消融治療已滿1年的單發甲狀腺性良性結節患者86例,均于消融前經甲狀腺細針穿刺細胞學檢查排除惡性。其中,男性24例,女性62例,平均年齡(49.6±16.2)歲。術前記錄患者性別和年齡。常規檢驗血常規、凝血功能、肝酶(ALT、AST)、甲狀腺激素(FT3、FT4、TSH)和喉鏡檢查。
1.2 結節評估 由同一名資深超聲科醫師采用德國西門子公司S2000超聲診斷儀器消融前對結節行常規超聲和超聲造影(contrast-enhanced ultrasound, CEUS)檢查,造影劑為意大利Bracco公司的SonoVue,每次2.4 mL。結節體積經CEUS直接計算得出,同時記錄結節成份[囊液成份為主(>50%)或實性成份為主(>50%)]。
1.3 消融治療 治療過程由同一資深介入科醫師完成。微波消融(MWA)采用上海維京醫療公司MTC-3C微波消融儀,微波針型號:MTC-3CAII37。射頻消融(RFA)是采用上海邁德醫療公司S-500射頻消融儀,射頻針型號:10-131161。患者平臥,充分暴露頸部,優先選擇全麻,部分主動脈重度狹窄、肺功能較差或無法耐受長時間平臥等不適合全麻的患者采用局部麻醉。超聲引導下再次確認結節位置和周圍解剖結構,確認穿刺路徑。采用移動靶點消融方式對多個位點逐個熱凝消融結節[6],微波輸出功率為25~35 W,射頻輸出功率調為10~20 W(阻抗模式)。超聲下見強回聲覆蓋該結節體且多普勒顯示瘤體內無彩色血流時,可停止消融。CEUS隨訪消融1年后結節體積,計算消融1年后結節縮小率(volume reduction ratio, VRR),VRR(%)=[(基線體積-消融后結節體積)/基線體積] ×100%。
1.4 美容評分及癥狀評分 消融1年后進行臨床評估,主要包括美觀評分和癥狀評分。接診醫師采用4分法按以下標準進行美容評價:1分,結節不能觸及;2分,結節不可見但可觸及;3分,結節僅在吞咽時可見;4分,結節明顯可見。
癥狀評分主要根據患者主觀感受判定。癥狀主要包括吞咽不適、呼吸困難和頸前區不適等,采用4分法按以下標準進行評價:1分,無癥狀;2分,輕度間斷;3分,輕度持續;4分,中度持續。
1.5 統計學處理 采用SPSS 23.0統計軟件進行分析。消融前后體積、美容評分和癥狀評分的比較采用成對樣本t檢驗,將患者年齡、性別,消融前FT3、FT4、TSH、ALT、AST,結節基線體積,消融方法和結節成份作為自變量,以VRR為因變量,進行單因素和多因素回歸分析。檢驗水準(α)為0.05。
2 結 果
2.1 療效評估 86例患者中,36例接受RFA,50例患者接受MWA。86個結節中,囊性成份為主23個,實性為主63個。消融前平均體積為(12.3±7.3) mL,消融1年后結節平均體積為(2.8±2.5)mL,VRR為(79.6±20.4)%,消融前后差異有統計學意義(P<0.001)。臨床癥狀較前明顯改善,美容評分[(1.04±0.19)分vs(2.95±0.75)分]和癥狀評分[(1.14±0.35)分vs(3.09±0.84)分]均較前下降,差異有統計學意義(P<0.001)。
2.2 影響療效的單因素分析 單因素分析結果(表1)顯示:年齡與VRR負相關(β值=-0.788,P=0.008);男性患者獲得的治療效果優于女性(β值=10.152,P=0.029);基線體積與VRR負相關(β值=-1.014,P=0.001);RFA療效較MWA更優(β值=10.881,P=0.018);甲狀腺激素水平(fT3、fT4、TSH)、肝功能(ALT、AST)和結節成份與VRR無相關性。
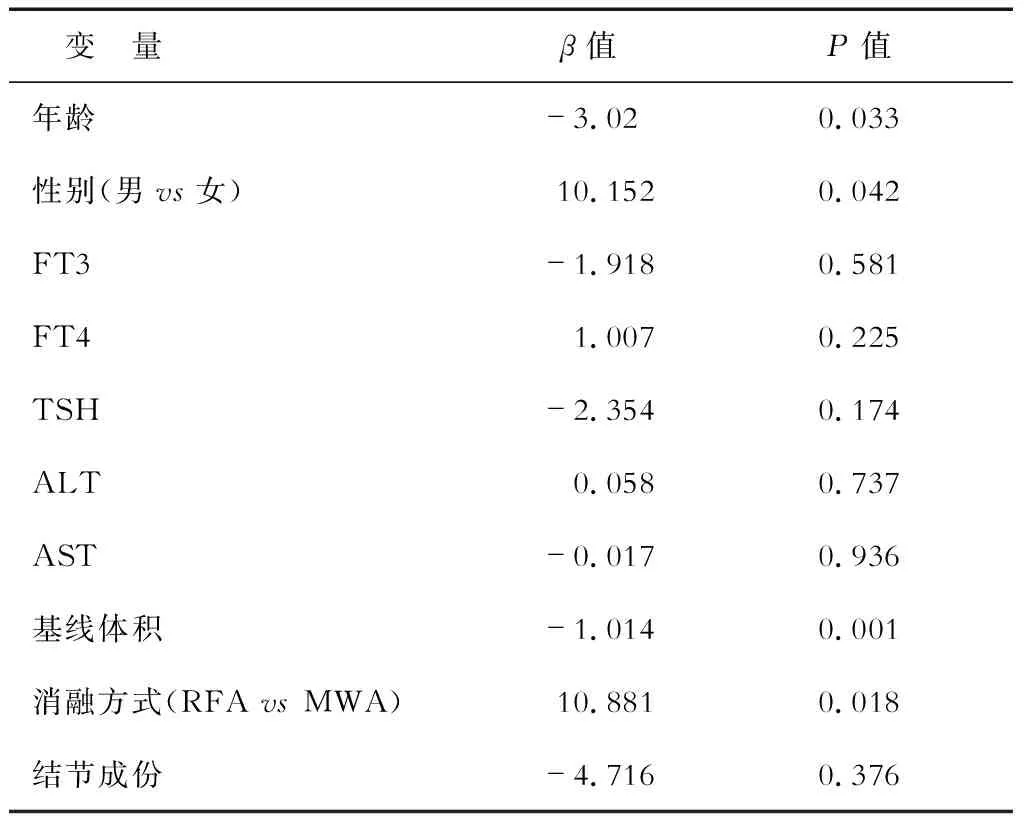
表1 VRR影響因素的單因素回歸分析
VRR:結節縮小率;FT3:血清游離三碘甲狀腺原氨酸;FT4:血清游離甲狀腺素;TSH:促甲狀腺激素;ALT:丙氨酶氨基轉移酶;AST:天冬氨酶氨基轉移酶;RFA:射頻消融;MWA:微波消融
2.3 影響療效的多因素分析 多因素分析結果(表2)顯示:結節基線體積、性別、消融方式是VRR的獨立影響因素(P<0.05)。
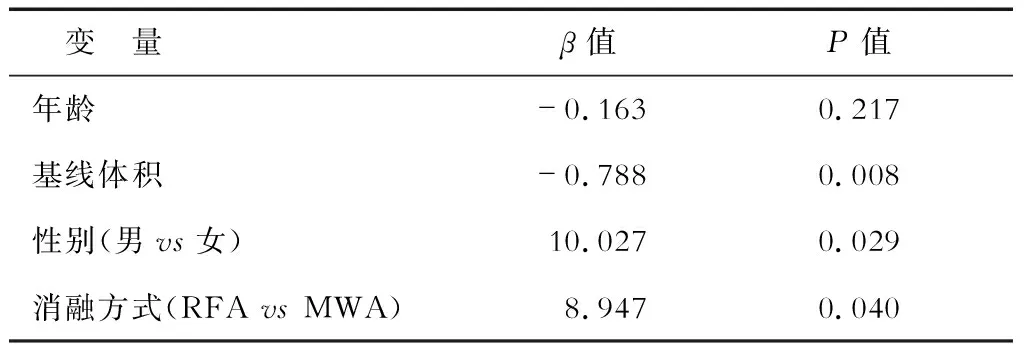
表2 多因素回歸分析影響結節縮小率的獨立危險因素
RFA:射頻消融;MWA:微波消融
3 討 論
甲狀腺結節多在體檢中偶然發現,大部分為良性,間隔6~18個月定期隨訪即可[7]。隨著超聲技術的快速發展,結節的檢出率也逐年上升[8]。對于有干預指征的甲狀腺良性結節,常規選擇開放性手術。然而即使手術一次性清除病灶,術后并發癥發生率仍較高[9-10]。近年來,微創介入手術快速發展,其主要針對生長較快、引起壓迫癥狀或影響美觀的結節。部分患者擔心惡變,也會選擇微創介入手術。
消融治療是指通過熱消融技術使病灶壞死,再由自身免疫系統清除壞死組織,使病灶慢慢縮小至消失。消融可分為2個階段[11]:第1階段為病灶發生熱變性和凝固性壞死,病灶全部滅活;第2階段是消融區域進入損傷修復期,消融區壞死組織被不斷地吞噬、清除,消融區域逐漸縮小,這個過程存在明顯的個體差異。甲狀腺結節的病因較復雜。有研究[12-14]認為,結節發病率與性別相關,碘攝入異常、放射線接觸、吸煙和年齡等與甲狀腺結節的發生相關;研究[15]指出,甲狀腺結節在糖脂代謝異常、肥胖、代謝綜合征患者中多發。然而,目前缺乏探討影響消融后結節縮小因素的研究。因此,本研究對此進行了分析,發現消融方法、基線體積和性別影響消融療效,年齡、結節成份、甲狀腺激素水平和肝功能與療效無關。
本院目前采用的熱消融方式主要包括RFA和MWA。研究[16]表明,RFA和MWA治療甲狀腺良性結節1年內的療效相似,但Cheng等[17]發現,消融6個月后,VRR與消融方式相關,RFA長期效果優于MWA。造成這種差異的原因除入組人數不同外,可能還與治療過程中消融的輸出功率不同有關,后者采用的輸出功率更高。本研究中微波的輸出功率為25~35 W,消融后12個月時,RFA的療效優于MWA。在MWA過程中,即使輸出相對較低的功率,也會導致組織的中心溫度過高,常超過150℃[18-19],使消融組織碳化,而這種碳化很難被機體吸收。而在RFA過程中,組織溫度一般不超過110℃[20],一般不發生消融組織中心碳化。如何在MWA有效消融病灶的同時減少中心碳化,以及降低功率能否減少碳化,仍有待進一步研究。
關于基線體積與VRR的關系,目前尚無明確結論[21-22]。本研究發現,結節基線體積越小,療效越好。大結節病灶難以全部被消融覆蓋,而且消融過程中出現的不規則低弱回聲在覆蓋病灶同時會影響操作者對結節邊界的判斷。因此,操作過程中會適當擴大消融范圍來保證一次性完全消融,而這樣的操作可能影響消融后結節的體積,還需要大樣本數據進一步研究認證。
此外,本研究發現,消融術后女性VRR明顯小于男性,這可能與激素水平相關。既往有學者[23-24]報道,正常的甲狀腺組織中存在雌激素受體(estrogen receptor, ER),表明雌激素可直接通過ER作用于甲狀腺組織,進而促進其增殖。因此,血清雌激素水平的增加可以導致細胞增殖及組織病變,從而影響VRR。
本研究的局限性在于:(1)納入指標相對局限,在與甲狀腺結節形成相關的代謝指標中,僅納入了肝功能指標,而未納入空腹血糖、血脂、胰島功能等代謝指標,也未納入血壓、肝脂肪定量等相關代謝因素;(2)熱消融還包括激光消融,但本院尚未開展;(3)隨訪時間較短、樣本量小。因此,結論仍須完善數據后進一步驗證。

