內鏡下全層切除十二指腸黏膜下腫瘤的臨床療效分析
范文階, 姜 飛, 王 暉, 陸品相, 郭 琦, 鐘蕓詩
1. 上海市徐匯區中心醫院普通外科,上海 200031 2. 復旦大學附屬中山醫院內鏡中心,上海 200032
十二指腸黏膜下腫瘤(SMT)較少見,大多數患者沒有明顯臨床癥狀[1-2]。雖然內鏡下治療胃腸道腫瘤應用越來越多[3-4],但十二指腸病變部位特殊,內鏡下切除尤其內鏡下全層切除術(EFR)治療十二指腸SMT的應用并不多。
因此,本研究回顧性分析我院12例十二指腸SMT行EFR術的臨床經驗,為后續進一步的臨床實踐提供參考。
1 資料與方法
1.1 一般資料 徐匯區中心醫院內鏡中心2015年4月至2017年12月行內鏡下切除十二指腸黏膜下病變(SMT)45例,其中26.67%(12/45)行內鏡下十二指腸EFR,其余33例患者接受內鏡黏膜下剝離術(ESD)治療(表1)。12例患者中男性8例,女性4例,年齡22~67歲,平均(44.8±24.4)歲。病變最大徑1.0~7.0 cm,平均最大徑(3.38±0.4)cm;病變位于球部8例,降部3例,球降部交界處1例。所有患者均行CT檢查以了解病變生長方式和與腔外器官的關系。其中4例CT提示向腔外生長。術前均經超聲內鏡檢查,術中判斷腫瘤層次后行EFR。所有患者均知情同意并簽署知情同意書,本研究經醫院倫理委員會審核批準。
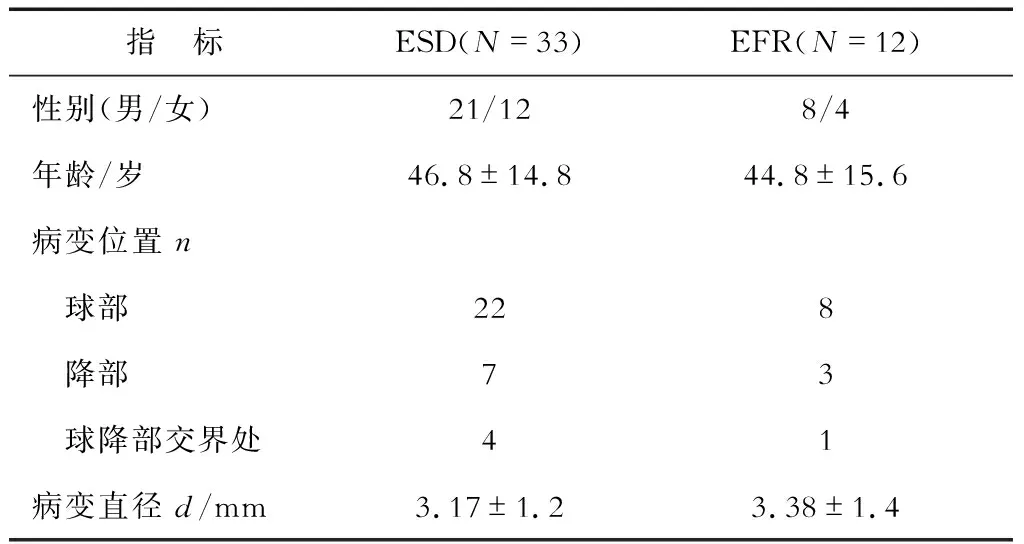
表1 患者一般臨床資料
1.2 內鏡下全層十二指腸切除術治療SMT
1.2.1 主要器械 ERBE公司海博刀,IGG-200高頻電切裝置和APC300氬離子凝固器;Olympus公司GIF Q260Z胃鏡,GIF-2T240雙鉗道胃鏡,EU-M 30 內鏡超聲系統,微超聲探頭采用UM-2R和UM-3R,頻率分別為12 MHz、20 MHz。D-201.11802透明帽,KD-620LR HooK刀,NM-4L-1注射針,FG-8U-1異物鉗,SD-230U.20圈套器,FD-410LR熱活檢鉗,HX-600-135止血夾,CO2氣泵。
1.2.2 超聲內鏡檢查 胃鏡檢查發現十二指腸SMT病灶后,采用脫水充盈法對病灶進行超聲掃描,觀察病變大小、外形、邊界、內部回聲強度及起源于十二指腸壁層次。
1.2.3 EFR切除十二指腸SMT 術前空腹,采用氣管插管全身麻醉。EFR步驟如下(圖1),標記:應用氬氣刀于黏膜隆起病灶邊緣進行電凝標記。注射:于標記點外側黏膜下多點注射靛胭脂和含腎上腺素的0.9%氯化鈉溶液。切開病變外側黏膜:用海博刀和IT刀沿標記環切開十二指腸黏膜。切除病灶:用IT刀沿病灶邊緣進行黏膜下剝離,判斷病灶位置深,同固有肌層關系密切時,決定全層切除,用IT刀沿病灶邊緣全層切除病灶。創面處理:應用氬離子凝固術(APC)或熱活檢鉗處理創面出血點和可見的小血管,必要時金屬止血夾鉗夾處理出血點,止血完全后改用雙鉗道治療鏡,使用金屬鈦夾和尼龍繩“荷包縫合”縫合創面。
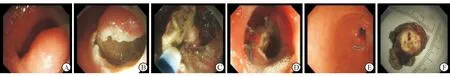
圖1 EFR全層切除十二指腸SMT
A:十二指腸黏膜下腫塊;B:標記后切開;C:ERBE公司海博刀全層切除;D:尼龍繩縫合創面;E:縫合后;F:完整切除標本
1.3 術后處理及隨訪 EFR術后于內鏡下常規放置胃管,置于十二指腸創面下5 cm,術后患者半臥位,予禁食、十二指腸引流,預防感染,抑制胃酸分泌,補液等處理。觀察有無遲發性出血,腹腔感染等。術后第1天均行上腹部CT檢查了解腹腔內滲出情況。一般于術后第5天拔除胃管,逐步進食流質、半流質飲食。1個月后隨訪內鏡,觀察創面愈合情況,術后3、6、12個月各復查1次,之后建議患者每年復查。
2 結 果
2.1 手術情況 結果(表2)表明:12例十二指腸SMT均一次性行EFR完整切除,病灶起源于固有肌層。術前超聲檢查結果與術中評估對照,病灶起源層次基本一致,為11/12(91.67%),內鏡治療耗時28~55 min,中位時間40.5 min,住院時間6~12 d,中位住院時間8 d。術后病理:胃腸道間質瘤(GIST)6例,Brunner腺瘤2例,脂肪瘤1例,類癌1例,異位胰腺1例,囊腫1例。
2.2 術后隨訪及并發癥處理 術中出血:術中活動性出血予氬氣電漿凝固術(APC)和(或)熱活檢鉗處理;2例術中因出血量大(約250 mL),上述方法止血效果不佳,予快速切除病灶,沖洗創面,充分顯露出血點后,熱活檢鉗電凝止血加金屬夾鉗夾處理后成功止血。術后遲發性出血:2例術后第3天胃管內有間斷性鮮紅血,出現遲發性出血,1例經保守治療后出血停止,1例經再次內鏡下止血成功。術后疼痛:術后4例患者出現中上腹部較劇烈持續性疼痛,多次腹部CT檢查提示手術區域有少量滲液,經保守治療2 d后疼痛緩解。12例患者無1例因出血或無法縫合創面而中轉外科手術或死亡。12例患者接受了2~31個月隨訪,無進食習慣改變及腹部不適、無狹窄。隨訪1個月時內鏡檢查創面基本愈合。
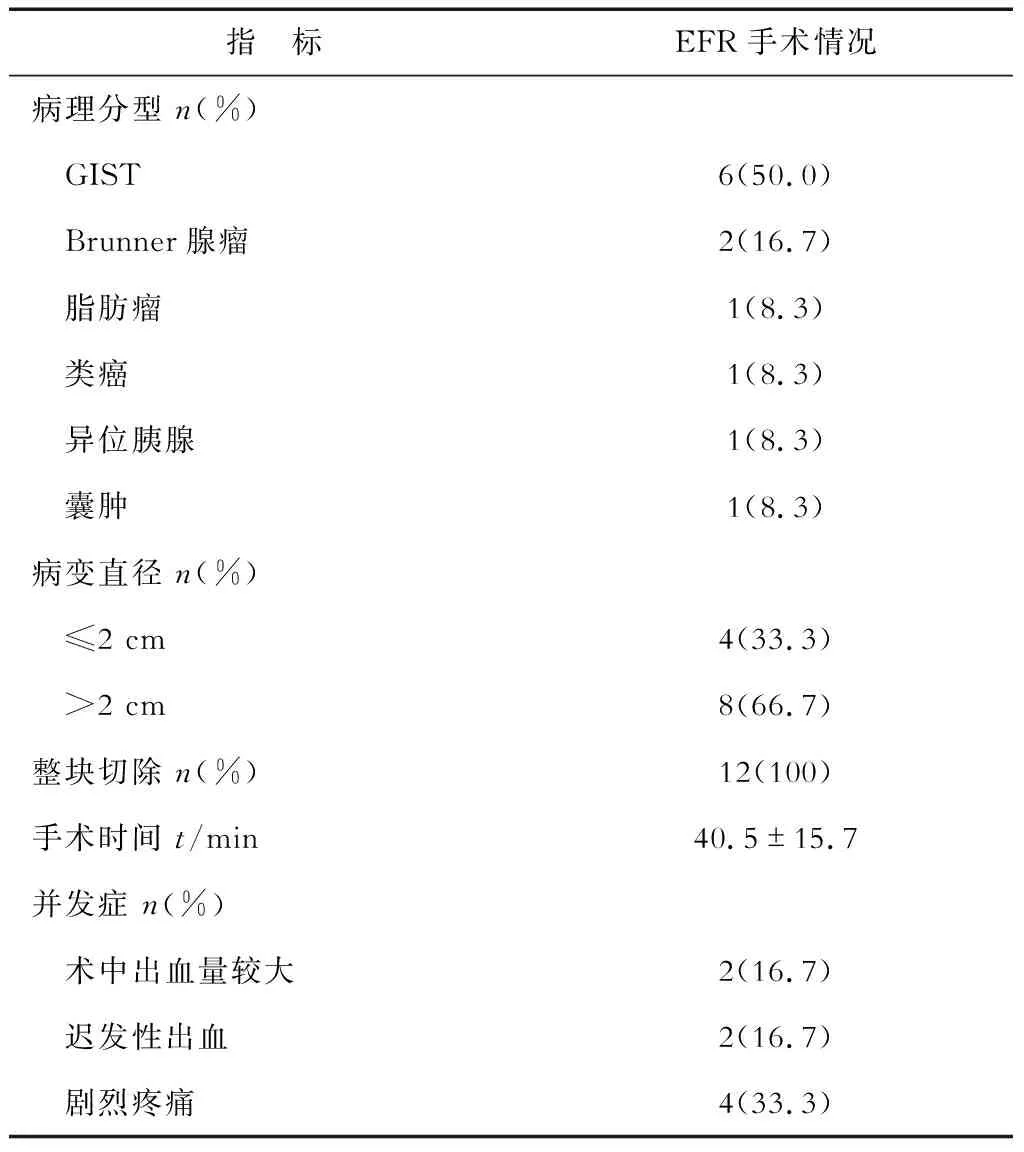
表2 十二指腸SMT行EFR手術情況分析
GIST:胃腸道間質瘤
3 討 論
原發性十二指腸腫瘤發病率低(0.02%~0.59%),該部位SMT的發病率更低[1]。十二指腸SMT的臨床表現與腫瘤的大小和部位有關,主要表現為惡心、嘔吐、上腹部疼痛等。由于SMT癥狀不典型,診斷常較困難。其內鏡下形態多樣,多表現為黏膜下隆起,而黏膜表面完整。內鏡超聲目前是術前診斷消化道黏膜隆起性病變尤其是SMT的最好方法[2]。十二指腸SMT病理類型多樣,包括Brunner腺瘤、異位胰腺、炎癥、脂肪瘤、GIST及囊腫等,尤以前兩者多見。本研究病理資料顯示,GIST 6例,Brunner腺瘤 2例,以GIST最多見,可能與納入研究的病例起源于肌層有關。
十二指腸SMT尚無明確的治療指南,GIST、類癌均有惡性潛質[5],異位胰腺、Brunner腺瘤則有惡變可能[2,6]。十二指腸SMT首選治療方法為外科手術切除,包括胰十二指腸切除術、十二指腸節段切除、十二指腸腫瘤局部切除等。十二指腸位置特殊,與胰腺關系密切,手術創傷大,易造成嚴重術后并發癥,因此患者常難以接受。近年來隨著超聲內鏡和內鏡黏膜下剝離術(ESD)的廣泛開展,對于絕大多數十二指腸SMT均能通過內鏡手術切除,但對于瘤體較大、瘤體與漿膜層緊密連接,特別是向腔外生長的間質瘤,ESD術往往對瘤體切除不完整,手術操作時間長,出血量大,術中穿孔等并發癥發生率高,甚至需要中轉開腹。隨著ESD技術的提高,出現了對部分消化道黏膜下病變進行全層切除的技術,即EFR。
近3年來,本院共施行了45例十二指腸SMT內鏡下切除術,其中12例因瘤體大,與固有肌層緊密連接或腫瘤向腔外生長,施行了內鏡下EFR術。術前充分準備,在手術室做好腔鏡聯合或開腹手術準備。具體操作:沿病灶標記,環形切開正常黏膜剝離顯露病灶,證實病灶來源于固有肌層,與固有肌層聯系緊密或向腔外生長;使用IT刀沿病灶邊緣環形全層切除(IT刀由于刀前緣絕緣,不易損傷十二指腸腔外臟器);術中避免切除病灶掉入腹腔,可用牙線將病灶固定于十二指腸黏膜上,通過圈套器取出病灶;改用雙鉗道,對創面用金屬鈦夾和尼龍繩進行荷包縫合。12例SMT行內鏡下EFR手術,均順利完整切除病灶,手術耗時較ESD時間短,切除病灶需約20 min,整個手術中位耗時約40 min。
由于十二指腸解剖位置特殊,腸腔彎曲,操作空間狹小,且與膽管胰管毗鄰,手術難度大,需要具有豐富內鏡手術經驗的醫師才能勝任。EFR的并發癥主要包括術中出血、術后遲發性出血、創面縫合不嚴密外滲、術后十二指腸狹窄梗阻。術中出血影響內鏡下手術視野,可導致手術失敗而中轉手術,因此術中即刻出血預防和處理顯得至關重要[7-8]。術中邊緣動脈出血,出血量大,巧用玻璃帽壓迫,沖洗顯露出血點,熱活檢鉗電凝止血。本組2例術中出血量較大,約250 mL,其中1例沖洗顯露創面邊緣出血點,熱活檢鉗電凝止血成功;另1例電凝止血失敗,快速切除病變,沖洗顯露邊緣出血點,金屬鈦夾夾閉止血成功。由于創面暴露在十二指腸液胰液和膽汁中,術后遲發性出血和滲漏是嚴重的并發癥。為預防術后遲發性出血,病灶完整切除后,創面邊緣仔細搜尋滲血情況和出血,予以APC處理和熱活檢鉗電凝止血。術中胃鏡直視下將胃管置于十二指腸創面下方。術后禁食、抗炎、抑制胃酸分泌、生長抑素抑制胰酶分泌。胃管及時引流十二指腸液,減少胃液、十二指腸液對創面刺激及外滲。嚴密觀察引流液顏色和腹部體征。術后24 h行腹部CT檢查,了解創面周圍和腹腔滲出情況。本組12例患者均予以十二指腸引流和術后第1天常規腹部CT檢查。2例術后第3天出現胃管內鮮紅血液,考慮為遲發性出血。1例經保守對癥處理出血停止;另1例經再次胃鏡檢查發現創面有活動性出血,予以熱活檢鉗電凝止血后出血停止。4例出現中上腹部持續較劇烈腹痛,CT提示創面周圍和后腹膜有少量滲出,經胃管引流和對癥處理,第2天腹痛明顯緩解。復查CT創面周圍滲出緩解。12例無1例中轉手術或術后外科手術處理。平均住院8 d后出院。12例患者隨訪1個月時創面基本愈合,無狹窄梗阻。
綜上所述,內鏡下EFR是一種一次性整塊完整切除病灶的微創治療方法,安全有效,較外科手術治療創傷小,代表了內鏡治療發展方向。Sakon等[9]認為,對于胃鏡、超聲內鏡及CT提示病變體積較大(最大徑>3 cm),與固有肌層密不可分,尤其向腔外生長為主的十二指腸SMT,可行腹腔鏡聯合內鏡技術(LECS)。該類患者經嚴密術前準確評估和準備,術后積極十二指腸引流及抗炎、抑酸、抑酶治療處理,內鏡下EFR術后可恢復快。因此,內鏡下EFR可作為十二指腸SMT,特別是向腔外生長病變內鏡微創治療的選擇之一。

