慢性束縛應激聯合特殊飲食制備腹瀉性腸易激綜合征(IBS-D)大鼠模型的研究
馬曉玲,夏提古麗·阿不利孜,石磊嶺,陳 剛,劉雪松,張大鵬,魏鴻雁*
(1.新疆維吾爾自治區中藥民族藥研究所,烏魯木齊 830002; 2.新疆大學生命科學與技術學院,烏魯木齊 830002)
腸易激綜合征(irritable bowel syndrome,IBS)是一種以慢性或者反復發作的腹痛伴排便習慣改變為特征的功能性腸病,并缺乏形態學和生化標志的異常。IBS是一種全球性疾病,人群患病率較高,其癥狀可反復發作,嚴重影響患者的生活質量,并占用了大量的醫療資源[1]。根據患者排便情況可分為便秘型腸易激綜合征(constipation-predominant of irritable bowel syndrome,IBS-C)、腹瀉型腸易激綜合征(diarrhea-predominant of irritable bowel syndrome,IBS-D)和腹瀉便秘交替型腸易激綜合征(alternating-predominant of irritable bowel syndrome,IBS-A),臨床上以IBS-D最為多見。IBS-D一直是中藥方劑治療消化系統疾病的研究熱點,然而對該病的實驗研究難點之一是迄今未有理想的動物模型[2]。IBS-D作為IBS的一個亞型,除了腹痛和腹部不適之外,腹瀉是其主要癥狀,內臟高敏感性是其主要特征,基于內臟高敏感模型,疊加致瀉是目前復制IBS-D的一個思路。
在現有造模方法中,兩種方法聯合建模所占比例占一半以上,Barone等[3]建立了冷環境+束縛應激法的IBS-D大鼠模型,袁秀榮等[4]以束縛應激+番瀉葉灌胃法建立了肝郁脾虛型IBS模型,趙文娟等[5]以夾尾刺激+醋酸灌腸法建立了內臟高敏感性IBS模型,諸如此類兩種方法建模的文獻報道很多,這其中高乳糖飼料喂養結合束縛應激刺激法操作簡單易行且對動物損傷小。然而由于藥物制備方法及束縛造模工具等差異,很難量化不同造高乳模方法的應激強度,難以把握模型的具體程度和分期。因此本研究基于主流的造模方法[6-8],進一步觀察不同乳糖比例、束縛時間及造模持續時間對模型造成的影響,以期量化其中的量效與時效關系,彌補現有造模方式的不足,為中藥方劑治療等研究提供可靠的動物模型。
1 材料和方法
1.1 實驗動物
SPF級SD大鼠40只,體質量140 ~ 160 g,6周齡,雌雄各半,由新疆實驗動物中心提供[SCXK (新) 2016-0001]。飼養條件:SPF級實驗室,相對濕度:30% ~ 40%,溫度:20℃ ~ 30℃[SYXK (新) 2016-0007];SPF級飼料由新疆實驗動物中心提供,高乳糖飼料按相應配比自制。保持各組實驗動物飼養條件一致。實驗期間,遵循3R原則給予實驗動物人道主義關懷。動物實驗的開展取得了新疆維吾爾自治區中藥民族藥研究所實驗動物倫理委員會批準(編號:IACUC2015-03-002)。
1.2 主要試劑與儀器
乳糖(上海昌為醫藥輔料技術有限公司,批號:81112812);生理鹽水(國藥集團新疆制藥有限公司,批號:1503015)。MD3000型多道生理儀(安徽正華生物儀器設備有限公司);LG103型飼料顆粒機(曲阜市林工機械有限公司);尼康正置顯微鏡(日本Nikon公司)。
1.3 實驗方法
1.3.1 分組和模型制備
大鼠適應性飼養1周,按體質量水平隨機分為5組:正常對照組、模型A組(30%乳糖+束縛1 h)、模型B組(30%乳糖+束縛1.5 h)、模型C組(45%乳糖+束縛0.5 h)、模型D組(45%乳糖+束縛1 h),每組8只,雌雄各半。除正常組外,其余各組飼喂相應比例乳糖飼料,并每日上午進行束縛應激:用醫用橡皮膏束縛大鼠雙后肢,并懸掛于1 h,使之無法行動,煩躁不安,造成一定的應激刺激,正常組不做干預。
1.3.2 日常觀察
每日觀察動物狀態:進食進水、激惹行為、好斗傾向、排便次數、糞便形態、毛色和精神狀況。
1.3.3 糞便形態及其含水量[9]
分別于造模前1 d和造模第7、10、14天將大鼠單獨置于代謝籠中飼養12 h后收集糞便,采用Bristol分型積分[10]評價動物的糞便形態,積分方法見表1,并采用《中國藥典》2015版附錄水分測定方法測定糞便含水量。
1.3.4 容量閾值[11]
分別于造模后第7、10、14天測定各組大鼠腹部回縮反射的容量閾值。測定前禁食禁水12 h,各組大鼠分別于清醒狀態下放入自制的固定器,將6 F導尿管經肛門緩慢插入,氣囊末端距肛門約2 cm并固定。30 min后經外口氣囊內先后注入37℃生理鹽水(0.8,0.9,1,1.1,1.2 mL)擴張,以腹部回縮反射作為標準,記錄容量閾值。為得到準確的評估結果,對每一閾值都重復進行3次擴張,數據取均值。
1.3.5 在體平滑肌運動[12]
分別于造模第7、10、14天測定各組中隨機抽取的3只大鼠。各組大鼠禁食12 h,灌胃新鮮牛乳(20 mL/kg)1 h后,麻醉、固定后于劍突下2 cm處做正中切口,剪開后分離出回腸,將針式電極正、負極按要求連接,多道生理信號采集處理系統記錄餐后1 h空腸平滑肌運動波,分析計算運動波振幅和頻率。
1.3.6 結腸組織病理檢查
大鼠解剖后對腸組織進行肉眼觀察,截取結腸中段進行病理觀察。
1.4 統計學方法

2 結果
2.1 各種造模方式的日常觀察和體質量變化
造模前,各組動物毛色和精神正常,糞便呈香腸狀,表明光滑柔軟。造模后第4天起模型A、B、D組動物均出現易激惹、少動、皮毛凌亂無光澤、肛門有不成形糞便附著,造模第7天起模型C組也出現上述癥狀。與正常對照組比較,各組大鼠的體質量水平在第7、10、14天也出現不同程度的降低,體質量變化趨勢見表2。
2.2 各種造模方式對糞便形態和含水量的影響
糞便形態以Bristol分型積分法描述并計算平均值,結果見表3,同時收集每只動物24 h內排便,稱量糞便干、濕重,計算糞便含水率,分別與正常對照組進行組間對照,至第7天起,各模型組糞便Bristol積分值發生顯著改變,各模型組大鼠糞便含水量也較正常對照組發生顯著變化,如表4所示,各模型組大鼠的糞便含水量均顯著升高。表明四種造模方式均在7 ~ 14 d內發生腹瀉。

表1 Bristol分型積分標準Table 1 Bristol classification integration standards

表2 各組動物體質量變化Table 2 Changes in body mass of the rats in each group
注:與正常對照組比較,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.

表3 各組大鼠糞便Bristol分型積分值Table 3 Bristol classification integral values of rat feces in each group
注:與正常對照組比較,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.

表4 各組大鼠糞便含水量Table 4 Fecal water content of the rats in each group
注:與正常對照組比較,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.
2.3 各種造模方式對腹部回縮反射的容量閾值的影響
分別于造模后的第7、10、14天以CRD球囊法測定動物的腹部回縮反射的容量閾值,以此考察其胃腸道敏感程度及其時間變化。如表5所示,在造模后第7、10、14天,與正常對照組比較,四個模型組的容量閾值均發生明顯降低,其中模型D組尤為明顯(P< 0.01),且模型C、D兩組較模型A、B兩組的腹部回縮反射的容量閾值更低,而隨時間延長,各組內容量閾值差異無顯著性(P> 0.05),表明乳糖飼料比例的改變對動物胃腸道敏感程度的影響更大,且模型在造模7 ~ 14 d內保持穩定。

表5 各組大鼠腹部回縮反射容量閾值變化Table 5 Changes in capacity threshold of abdominal retraction reflex of the rats in each group
注:與正常對照組比較,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.
2.4 各種造模方式對在體平滑肌運動的影響
經多道生理信號采集處理系統記錄餐后1 h空腸平滑肌運動,與正常對照組比較,各模型組大鼠空腸平滑肌運動波振幅均顯著升高,以模型D組尤為明顯(P< 0.01)。在平滑肌運動波頻率的改變上,除模型C組外,各模型組大鼠空腸平滑肌運動波頻率均顯著降低,其中模型B、D兩組的平滑肌運動頻率更低,而隨時間延長,各組內平滑肌運動波振幅和頻率均未發生明顯改變(P> 0.05),表明束縛0.5 h并不能改變動物胃腸應激節律,結果見表6所示。
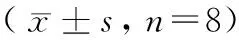
表6 各組大鼠餐后1 h空腸平滑肌運動波振幅和頻率Table 6 The wave of jejunum smooth muscle movement in rats at 1 hour after feeding
注:與正常對照組比較,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.
2.5 結腸組織病理改變
模型C組和模型D組結腸縮短,可見淋巴細胞、中性粒細胞和嗜酸性粒細胞浸潤,模型B組可見淋巴細胞浸潤,其余各組未見異常(見圖1)。
3 討論
IBS-D按其癥狀歸屬中醫“泄瀉”、“腹痛”等病癥范疇,與“大腸瀉”、“痛瀉”等關系密切,病位在腸腑,與肝、脾、腎等臟腑功能失調相關,中醫對其認識有著悠久的歷史,在多部古籍文獻資料中均有記載。近代中醫認為肝郁脾虛、肝脾失和是其基本病機,歷代醫家對其認識不斷深化,提出了一系列治療方劑,如痛瀉藥方、芍藥甘草湯、柴胡疏肝散、逍遙散、胃腸安丸、易激膠囊等在臨床上多有應用[13]。
目前尚無公認統一的IBS-D實驗動物模型,IBS發病原因復雜,可能涉及胃腸道動力障礙、內臟感覺過敏、腦腸軸紊亂、腸道菌群失調、腸道炎癥和免疫反應、精神心理因素、遺傳等[14-16]。制備良好的IBS動物模型是研究IBS發病機制、病理生理、藥物治療等方面的基礎,制約了此類藥物的研究和發展,而現有的文獻報道的多數造模方法中,乳鼠母嬰分離造模時間長且耗費大、死亡率高,外周致敏如腸道感染模型則不能很好模擬人類的IBS發病,唯有束縛應激聯合其他刺激能更好得模擬人的IBS發病。慢性束縛應激過程為非損傷刺激且更接近人的心理應激,符合IBS的發病機制。本研究通過考察飼料中的乳糖添加量、束縛時間和造模持續時間對IBS-D大鼠模型的影響,以疼痛閾值評價其內臟敏感性,以腹瀉指數評價其腹瀉程度,并以空腸平滑肌運動波振幅和頻率評價其胃腸動力。結果顯示,四種造模方式均可導致動物于7 ~ 14 d內發生腹瀉狀態;而當乳糖比例為45%時,其容量閾值發生顯著降低,表明其發生典型的內臟高敏感性癥狀;對于在體平滑肌運動頻率和振幅的考察中發現束縛0.5 h并不能改變動物胃腸應激節律。鑒于這幾方面因素的綜合考察,本課題組認為當飼料中乳糖比例高于30%,束縛時間在1 h以上時,造模動物在7 ~ 14 d發生典型IBS-D的胃腸動力異常,以及出現內臟高敏感狀態。

