成骨不全的研究進展
潘婷婷 綜述 馮正平 審校
重慶醫科大學附屬第一醫院內分泌科,重慶 400016
成骨不全(Osteogenesis imperfecta,OI)是一種主要侵犯骨骼系統的罕見的先天性結締組織疾病,也可累及眼、耳、皮膚等,其特征為易骨折、關節松弛、牙質發育不全、藍鞏膜、耳聾。相比骨質疏松,本病具有家族性和遺傳性,但也有少數為散發病例[1]。本文就近年來OI研究進展作一綜述。
1 成骨不全分型
目前臨床應用最廣的為Sillence 分型:Ⅰ型:最為輕微,無肢體變形;Ⅱ型為圍產期致死型;Ⅲ型存在嚴重長骨畸形;Ⅳ型介于Ⅰ和Ⅲ之間,嚴重程度不等,臨床表現差距甚大[2],Glorieux 等人根據獨特的巨大骨痂形成以及尺橈骨融合與橈骨頭脫位等表型特征、骨礦化缺陷病理特征、骻內翻、近端肢體短小等特征將Ⅳ型中擴充至Ⅴ~Ⅶ型[3,4]。其后,Ⅷ~ⅩⅤ型 隨著新致病基因的發現順序而先后被命名。近來又發現新的致病基因[5,6]。 Marini等人提出可以通過遺傳檢測、代謝機制與診治方法相結合作為新的分類形式[7]。
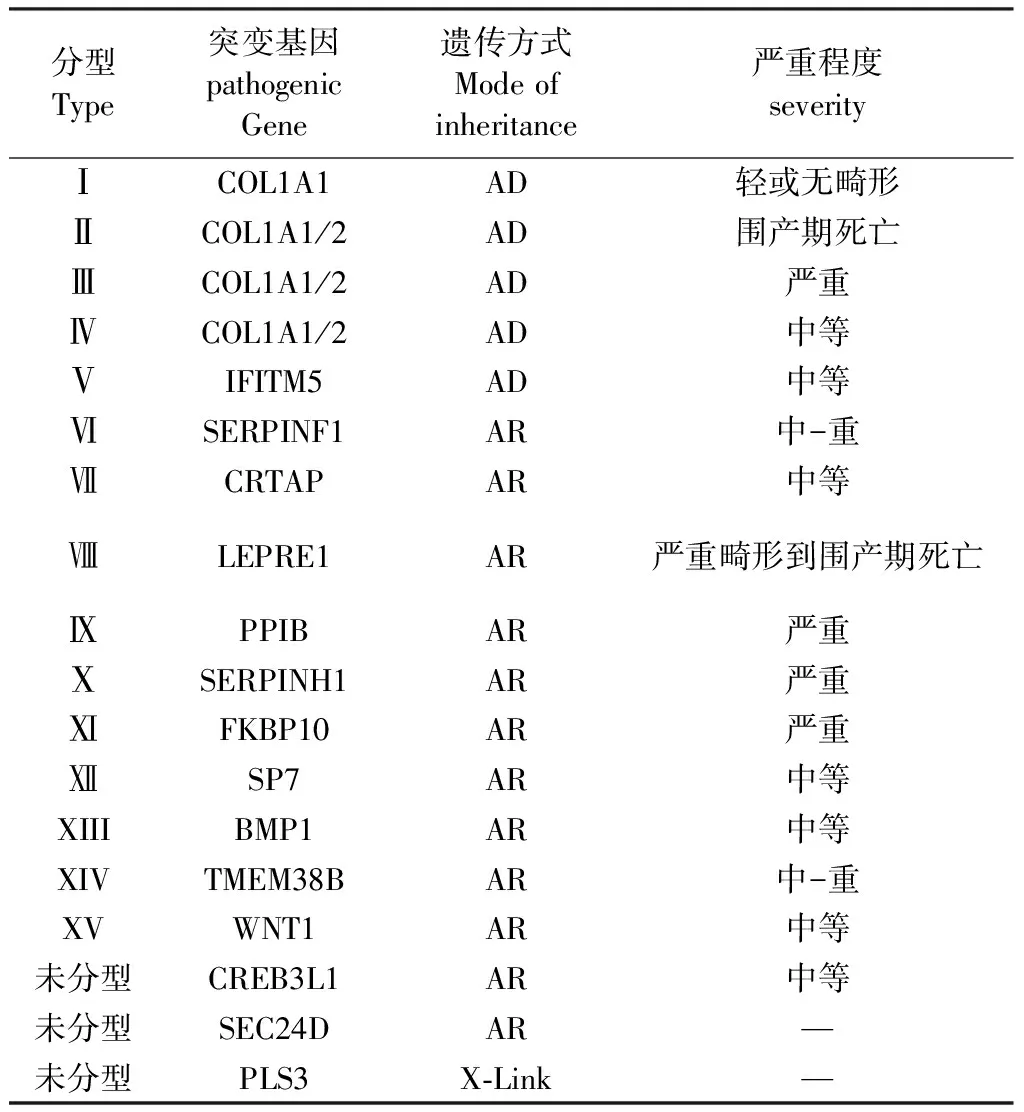
表1 成骨不全分型Table 1 The type of osteogenesis imperfecta
注:AD:為常染色體顯性遺傳;AR:常染色體隱形遺傳;X-Link:X染色體遺傳。
Note: AD: autosomal dominant inheritance; AR: autosomal recessive inheritance; X - Link: X chromosome inheritance.
2 成骨不全發病機制
目前大多數OI患者系常染色體顯性遺傳,因COL1A1/2、IFITM5基因突變導致 mRNA 的合成減少,翻譯的Ⅰ型膠原蛋白數量減少,而Ⅰ型膠原的存在對三螺旋的形成至關重要[8,9]。COL1A1 和 COL1A2 基因的錯義突變導致甘氨酸被替換,前膠原α鏈不能正確合成,Ⅰ型膠原分子的結構異常,引起Ⅰ型膠原三級螺旋結構不穩定,因被替換的氨基酸不同而表現出表型的多樣性[10-12]。IFITM5基因的錯義突變,編碼干擾素誘導的跨膜蛋白5,也稱為骨限制性IFITM樣蛋白(Bril),僅在骨組織中表達,導致異常基質礦化,骨內膜鈣化[13,14]。
常染色體隱形遺傳機制較為復雜,基因表型多樣化,致病基因分別為 SERPINF1、 CRTAP、 LEPRE1、 PPIB、 SERPINH1、 FKBP10、 SP7、 BMP1、TMEM38B、WNT1,擴充了成骨不全的Ⅵ~ⅩⅤ型。SERPINH1、 FKBP10基因的蛋白產物HSP47、FKBP65優先向前膠原三重螺旋的N端,并協助穿梭的膠原蛋白正確折疊入高爾基體,從而使膠原蛋白折疊穩定[15]。因BMP1和C-前肽裂解位點中的突變,C-前肽從I型前膠原中切割受阻,前肽區剪切的延遲,可能會削弱其剪切加工賴氨酰氧化酶 LOX 酶原的作用,影響膠原纖維分子間以及分子內的交聯反應[16]。TMEM38B基因編碼三聚體細胞內陽離子通道B(TRIC-B),充當K+通道,作用于維持不可興奮細胞中的細胞內鈣釋放,涉及膠原代謝中的多種蛋白質是鈣依賴性的,TMEM38B突變可以改變膠原蛋白的翻譯后修飾,因為它可以調節鈣網蛋白與親環蛋白B和蛋白質二硫鍵異構酶的相互作用,由TMEM38B突變引起的鈣釋放減少會通過Ca2 +依賴性酶/磷酸酶信號使Ca2 +依賴性激酶使失活,因此,抑制多能間充質細胞轉化成成骨細胞;異常Ca2 +可能導致ER膜的快速重組并激活解折疊蛋白反應,導致ER應激,可導致細胞毒性,誘導成骨細胞凋亡并影響骨基質的分泌;故細胞內或細胞外代謝途徑的幾個改變可能與TMEM38B突變誘導的OI發病機制有關[17]。部分常染色體隱性遺傳致病基因突變并引起前膠原α 鏈的翻譯后修飾、前膠原蛋白的分泌、加工等,導致前膠原蛋白的合成代謝異常,從而參與疾病的發生[18]。
WNT1基因編碼Wnt1蛋白,而Wnt信號通路在骨細胞發育和骨內穩態中起關鍵作用,可進一步分為典型和非典型途徑。在經典的Wnt-β-catenin通路中,Wnt1作用于Frizzled受體和輔助受體,即LRP5(脂蛋白受體相關蛋白5)和LRP6(脂蛋白受體相關蛋白6),Wnt1和LRP5的結合通過抑制泛素介導的蛋白水解降低了β-catenin的降解。多余的β-catenin積聚在細胞核中,結合轉錄因子4或淋巴增強子結合因子4,并將誘導下游基因表達,促進間充質干細胞向成骨細胞分化[19,20]。在非典型途徑的上下文中,Wnt1作用于Fzds和Dv1以觸發下游級聯,并參與細胞骨架組織和成骨細胞分化的調節[21]。WNT1 基因突變降低成骨細胞活性,骨架結構失穩,骨強度降低,使OI患者即在輕微創傷下表現出骨量減少和骨折。
3 成骨不全的診斷
有陽性家族史基礎,伴有脆性骨折、藍鞏膜典型臨床特征的患者不難診斷,在輕度骨骼改變但沒有OI骨骼外部特征的兒童中,很難在臨床上建立診斷。Ⅵ型臨床嚴重程度為中到重度,但有“魚鱗”狀骨板的特征,VI型OI患者中血清色素上皮衍生因子(PEDF)含量下降[22],可針對出生患兒提供診斷思路。OI患者無根治方法,故產前診斷預防患兒出生尤為重要。產前超聲檢查尤其是22-26周的四維系統B超可以較準確觀察到胎兒骨骼系統的畸形。而對于有家族史或者產前超聲異常的高風險人群,可通過PCR擴增及DNA測序、高通量基因測序、高分辨溶解曲線分析檢測致病基因,提高陽性診斷。
有研究者在一項74例高危胎兒產前基因診斷得出,攜帶OI致病突變胎兒的檢出率可達54%(40/74);胎兒及其父母和(或)先證者的基因型分析表明:夫婦一方為OI患者時,OI陽性胎兒的檢出率為68.9%(40/58);夫妻基因基因型正常時,所生胎兒OI陽性檢出率為0。由此可見,OI患者的后代具有較高的OI發病風險;相反,當先證者為散發病例時,其父母再次生育患兒的風險較小。因而,OI患者必須在完成自身基因診斷的基礎上進行產前基因診斷,有效預防新生患兒的產生[23]。
4 成骨不全治療
OI的治療是需要多學科共同協作。OI患者常反復或自發性骨折,畸形愈合多見,肢體常彎曲或成角,對于畸形嚴重者可采取措施矯正畸形,改善負重力線。髓內伸縮棒的應用可以減少骨折次數及維持長骨功能[24]。矯正器的使用有益于患者日常活動。在藥物降低骨折風險同時配合手術矯正,可提高患兒生活質量。
雙膦酸鹽是治療OI最主要的藥物,已經被證明可以減少骨痛,改善肌力,提高骨密度,降低骨折風險。靜脈注射帕米膦酸鈉治療成骨不全的標準給藥方案為1 mg/(kg·d),每次注射時間為3-4 h,連續注射3天,間隔周期2-4個月,藥物累計劑量為每年9 mg/kg[25]。最近,有學者提出雙膦酸鹽對成長中的兒童長期影響和安全性仍有一些擔憂,長期使用雙膦酸鹽與青少年的非典型股骨骨折相關[26,27],主要影響機制被認為是雙膦酸鹽對骨重塑抑制作用,導致非愈合性微裂紋,最終致全骨折。 Shane E等人在一項93例OI兒童患者予以雙膦酸鹽基礎治療、持續治療和中斷3組的回顧性隊列研究,發現三組的骨折模式相似,骨折最常見的位置是中軸骨或遠端骨,其次是轉子間和遠端骨折;幾乎所有骨折均為橫向或傾斜,即用雙膦酸鹽治療的OI患兒股骨骨折模式無任何改變[28],仍可繼續應用。
特立帕肽(teriparatide)為PTH的N端1~34片段,其作用機制主要為促進骨骼形成,目前主要用于骨質疏松癥的治療。在一項為期24月的臨床試驗,3名具有WNT1錯義突變,3名具有PLS3剪接突變的OI患者,每日接受20 μg特立帕肽治療,所有患者在3-6個月骨轉換指標如P1NP、骨鈣素和CTx增加;5例患者腰椎BMD從5.2%升至7.9%,4名患者股骨頸BMD自2.6%增至7.8%[29],基于BMD顯著提高為治療OI提供證據。
OI類型不同,治療方法略有差別。OI的VI型多由SERPINF1突變所致,其可通過RANK/ RANKL通路激活破骨細胞,此類型患者對雙膦酸鹽治療反應不佳,其機制可能是由于患者類骨質礦化不良所致[30]。denosumab是人源性RANKL的單克隆抗體,能抑制RANKL和RANK結合,通過抑制破骨細胞活性,抑制骨吸收、增加骨密度、降低骨折風險[31]。4名成骨不全VI患者每間隔12周予以1 mg / kg劑量的denosumab治療,2年后表現出BMD的增加,骨畸形改善,骨折風險降低和肌肉增強[32]。
OI的Ⅶ小鼠體內大量分泌TGF-β,其由成骨細胞分泌,在骨吸收時被釋放、活化,能與蛋白多糖結合參與膠原纖維形成。在鼠模型中抗TGF-β抗體可以修復骨表型,因此TGF-β骨細胞信號通路的藥物可能是對OI Ⅶ有希望的療法[33]。
有研究發現對WNT1突變OI患者予以雙膦酸鹽治療,BMD有增加,但骨折風險未明顯降低。BPS804一種中和性抗硬化蛋白抗體,通過Wnt信號通路刺激成骨細胞,有利于改善骨骼質量和減少長骨脆性,促進骨形成,減少骨吸收并增加OI患者的腰椎BMD,達到增加骨密度同時減低骨折風險[34,35]。
藥物治療可以改善OI的癥狀,根治則需依靠基因治療,目前基因治療主要用于COL1A1和COL1A2基因,通過RNA干擾使致病基因沉默,siRNA特異性抑制異常mRNA表達,將突變基因封鎖成無效等位基因[36]。已報道的COL1A1和COL1A2基因突變的位點超過八百個,部分等位基因的區別僅限于一個核酸的不同,利用靶向雜交體的siRNA理論上增加等位基因的特異性,提高治療基因OI的可能性。有研究發現將有標記基因的重組泡沫病毒載體注射到兔子的股骨骨髓腔,有效的改善骨礦物質密度和微結構,且采取髓內輸注可能是干細胞治療OI的有效細胞遞送途徑,優于全身給藥,骨髓間質干細胞移植有望用于OI的治療[37,38]。
5 結論
OI多由I型膠原蛋白的基因突變所致,隨著分子遺傳學的進展多個隱性基因表型逐漸發現,其致病機制逐漸明確。目前雙膦酸鹽是有效治療OI的方法之一,其可提高骨密度,緩解骨痛,降低骨折風險,甲狀旁腺素氨基端片段、抗硬化蛋白抗體等藥物,有望增加骨密度、改善骨骼微結構且降低骨折風險。而基因治療、骨髓間質干細胞移植新型治療手段漸進入視野,應用于臨床還需要經一步研究。

