MicroRNAs對骨質疏松癥發病機制的研究進展
王愛飛 王亮 徐又佳
蘇州大學附屬第二醫院骨科 蘇州大學骨質疏松癥診療技術研究所,江蘇 蘇州 215000
骨質疏松癥是老年人常見的代謝性骨病,以骨量減少、骨密度下降和脆性骨折風險增高為特征,目前已成為全球性的公共健康問題。骨的代謝是骨吸收和骨形成不斷轉換的動態平衡,成骨細胞和破骨細胞的分化和功能活性在骨形成和骨吸收中有著關鍵作用。骨形成的主要是成骨細胞,成骨細胞是由間充質干細胞分化而來,其分化受多種激素、細胞因子的調控,如BMP2,4,7、TGF-β1/2、IGF1、VEGF、FGF2等[1]。骨吸收主要由破骨細胞進行,破骨細胞是唯一進行骨吸收的細胞。破骨細胞是一種TRAP(tartrate-resistant acid phosphatase)染色陽性,由多個前體破骨細胞聚集融合而成的多核巨細胞。成熟有功能的破骨細胞表面會有一種肌動蛋白環,其與破骨細胞的功能密切相關。破骨細胞由骨髓造血干細胞分化而來,其前體細胞為單核巨噬細胞,其分化受RANKL、M-SCF等細胞因子調控[2]。
1 MicroRNA的概述
Lee RC等在1993年發現了miRNA[3],對RNA家族有了進一步的認識。miRNA是一種單鏈的、非編碼的小RNA,其長度約20-22個核苷酸[4]。成熟的miRNA一般有兩個來源:原始RNA(pri-miRNA)和前體RNA(pre-miRNA)。兩者在核糖核酸酶Ⅲ(Drosha酶和Dicer酶)的作用下逐步形成成熟的miRNA[5]。原始RNA(pri-miRNA)由RNA聚合酶II轉錄而成的長度約1000核苷酸,含莖環結構的多聚苷酸轉錄物。核糖核酸酶Ⅲ(Drosha酶)和其輔因子DGCR8形成一種蛋白復合物(microprocessor),它能夠將pri-miRNA修飾成長度約65核苷酸,發夾結構的前體RNA(pre-miRNA)[6]。細胞核轉運因子(Exp5)可以將pre-miRNA從細胞核轉運到細胞質中,在細胞質中Dicer酶將pre-miRNA修飾成長度約22核苷酸,成熟miRNA雙鏈結構。miRNA雙鏈結構中的一條鏈會成為成熟的miRNA形成RNA誘導沉默復合物(RISC),同時另一條鏈被降解[7]。
miRNA通過和靶基因mRNA上的3’端非編碼區域(3’UTR)結合,降解或抑制靶基因的mRNA,從而降低其翻譯效率,在基因轉錄后水平發揮負性調控作用。一般來講,每個miRNA都能作用于多個目標mRNA,大約1/3的蛋白基因序列都受到miRNA調控。因此,miRNA在基因調控中起重要作用,其在細胞的分化、增殖、凋亡、代謝的調控及其他許多生理過程中都具有重要作用[8]。近年來,研究發現多種miRNA在骨代謝異常和骨質疏松癥的發生、發展中起著重要的調控作用。文獻報道:miR-34c在小鼠體內的過表達可誘發年齡相關的骨量下降,miR-218可通過抑制破骨細胞的形成從而緩解骨質疏松癥的發展[9]。
miRNA不僅在細胞內、組織內可以檢測到,且在人的體液中,如血液、尿液、唾液及腦脊液中都可檢測到[10]。miRNA一般會以兩種形式被釋放到細胞外液中,一種是以包含于胞囊內的形式釋放到細胞外液中,包含miRNA的胞囊有兩種,分別是外泌體和微小囊泡;另一種是以與其相關蛋白結合成復合物的形式釋放到細胞外液。外泌體是由細胞內體發育為多囊小體,再由多囊小體形成直徑約40-100 nm的小胞囊,它能夠承載多種RNA,miRNA也包括在其中。外泌體與miRNA的轉運的關系十分密切,其表面分子能夠決定它被相應器官攝入的特異性[11]。因此,將miRNA作為相應疾病診斷的生物標志物和治療的靶點是有意義的。
2 MicroRNA與成骨細胞
成骨細胞是最重要的骨形成細胞,在骨代謝中,成骨細胞是骨形成的主要承擔者,它的增殖、分化以及功能活性直接影響著骨形成。因此,骨質疏松癥和成骨細胞的關系十分密切。文獻報道MicroRNAs在成骨細胞的增殖、分化過程中起著不同的作用,直接或間接地調控著成骨細胞的增殖、分化(表1)。
2016年《Natural Communication》報道miR-214-3p能夠抑制骨形成。由破骨細胞分泌的miR-214-3p,經外泌體轉運到成骨細胞,與ATF4(影響成骨細胞功能的一個重要轉錄因子)mRNA的3’非編碼基因結合,抑制骨形成。通過抑制破骨細胞分泌miR-214-3p,能有效地促進骨形成[4]。另有研究表明:miR-214能夠直接作用于FGFR1,降低FGFR1的表達水平,影響FGFR/FGFR1信號通路下游的Runx2和ERK1/2的磷酸化,抑制間充質干細胞向成骨細胞的分化[12]。
轉錄因子Runx2是影響成骨細胞分化和功能活性的一個重要因素,它受到BMP、TGF-β、Wnt等信號通路的調控。Smad7能夠通過Smurf2介導的Runx2的降解抑制成骨細胞分化。miR-590-5p可以直接與Smad7的mRNA的3’非編碼區域結合,使其翻譯受到抑制,從而減輕Smad7對Runx2的抑制作用,間接地促進了成骨細胞的分化[8]。
Wnt/β-catenin信號通路在成骨細胞的增殖、分化以及骨組織的再生中起著重要作用,該通路的激活可以促進骨組織的再生。miR-10 a可作用于β-catenin的mRNA,降低β-catenin的蛋白表達水平,阻遏Wnt/β-catenin信號通路,抑制成骨細胞的分化[13]。
在許多骨質疏松癥的患者中,間充質干細胞會由向成骨細胞分化轉變為向脂肪細胞分化,而miR-27 a在這個轉變過程中起著十分關鍵的作用。miR-27 a可以直接與Mef2的mRNA的3’非編碼區域結合,降低Mef2的表達水平,使間充質干細胞更多地向成骨細胞分化,從而使骨相關指標上升[14]。然而,也有研究闡述了SATB2作為一個能夠和Runx2相互作用促進成骨分化的因子,其mRNA能夠被miR-27 a降解,使成骨細胞的分化受到抑制[15]。
miR-33家族中的miR-33-5p,是一種對機械力敏感的miRNA,可以促進成骨細胞的分化。高遷移率族蛋白(high mobility group AT-hook 2,Hmga2)在胚胎發育、細胞分化、細胞周期的變化、細胞凋亡、DNA的修復等多種細胞病理生理過程中起著重要作用,也能夠負性調節成骨細胞的分化。miR-33-5p可以作用于Hmga2的3’非編碼區域,降低Hmga2的蛋白表達水平,削弱Hmga2對成骨細胞分化的抑制作用,從而促進成骨細胞的分化[16]。
Zebing Hu等發現在失重所致的骨量丟失中,成骨細胞中的miR-132-3p水平明顯上升。EP300是一種組蛋白乙酰基轉移酶,能夠將乙酰基與目的蛋白上的殘余賴氨酸結合,從而保護它們不發生泛素介導的蛋白水解。EP300對Runx2的活性和穩定性的維持十分重要。miR-132-3p能夠直接作用于EP300,降低EP300的表達水平,使得Runx2的穩定性和乙酰化水平大大下降,從而抑制成骨細胞的分化和功能活性[17]。
TNF-α是具有調節骨量變化功能的一種炎癥因子,不僅可以提升破骨細胞的分化及功能活性,還能夠抑制成骨細胞的分化。TNF-α/NF-kB信號通路能夠直接提高miR-150-3p的表達水平,其中TNF-α能夠直接刺激miR-150-3p的表達,NF-kB通過作用于miR-150的增強子,刺激miR-150-3p的表達。miR-150-3p能夠直接和β-catenin的mRNA的3’非編碼區域結合,降低β-catenin的表達水平,抑制成骨細胞的分化[18]。
H Li等研究發現,miR-216 a在人脂肪源性間充質干細胞(hAMSC)向成骨細胞分化過程中的表達水平明顯上升,且可減輕地塞米松對成骨細胞分化的抑制作用。c-Cbl是一個編碼泛素連接酶(RING finger E3)的基因,E3連接酶在許多信號通路中都有著重要的作用,影響著多種細胞的功能活性,其中磷酸肌醇3-激酶(IP3K)和絲氨酸蛋白激酶(ATK)相關的IP3K/ATK信號通路就受其負性調控。miR-216 a通過在轉錄后水平下調c-Cbl的表達水平,減輕c-Cbl對IP3K/ATK信號通路的拮抗作用,促進成骨細胞的分化[19]。
同源盒基因HOXA10,是一種骨形成蛋白BMP2可誘導的基因,能夠激活骨形成轉錄因子Runx2及調節成骨細胞的基因表達,從而促進骨形成。在人骨髓間充質干細胞中,miR-320 a直接作用于HOXA10的mRNA,降低HOXA10的蛋白表達,從而抑制了人間充質干細胞向成骨細胞的分化[20]。
在成骨相關信號通路Wnt信號通路中,Wnt信號通路的眾多抑制因子中,DDK2和SFRP2是miR-218的直接作用靶標,miR-218過表達能夠同時抑制DDK2和SFRP2在基因水平和蛋白水平的表達[21]。因此,miR-218能夠通過DDK2和SFRP2增強Wnt信號通路的活性;與此同時,Wnt信號通路活性的增強也可以引起miR-218的表達,形成正反饋調節[22]。
骨發育的過程中,miR-335-5p在成骨細胞中的表達水平會明顯上升。miR-335-5p能夠特異性地和DDK1的3’非編碼區域結合,降低DDK1的表達。DDK1作為Wnt信號通路的抑制因子,在被抑制后,Wnt信號通路活性明顯增強,成骨細胞的分化和功能活性也得到增強[23]。
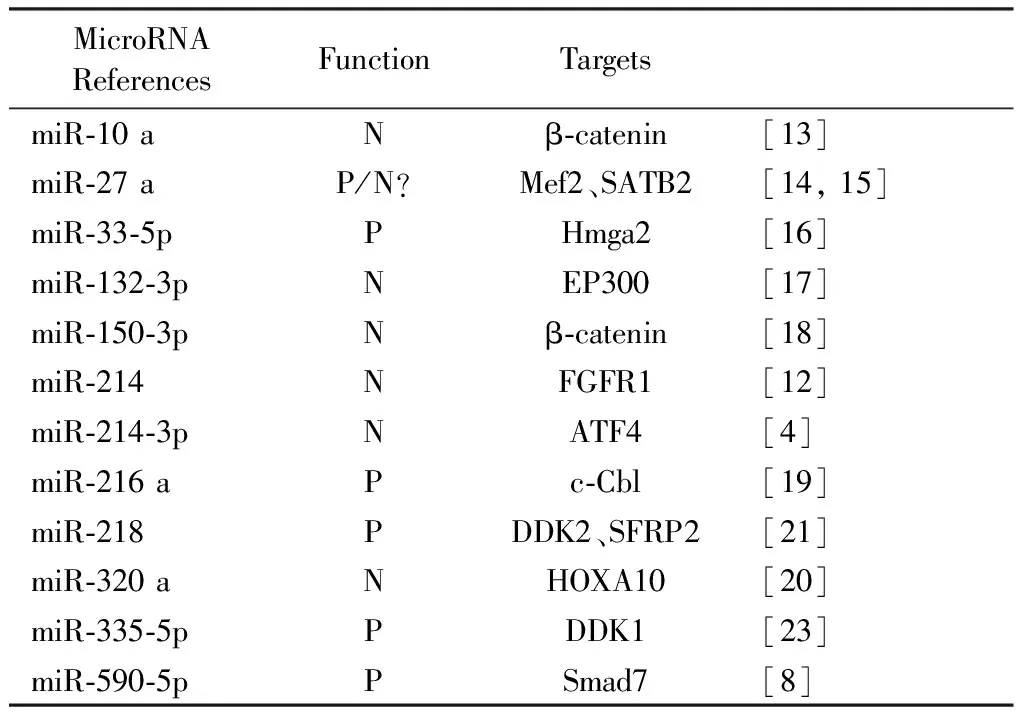
表1 MicroRNA參與成骨細胞分化和功能Table 1 MicroRNAs involved in osteoblast differentiation and function
P,Positive regulator of osteoblastogenesis;N,Negative regulator of osteoblastogenesis.
3 MicroRNA與破骨細胞
破骨細胞是進行骨吸收的主要細胞,功能過度增強,會使骨平衡向骨吸收方向偏移,造成骨量減低。因此,破骨細胞的分化和功能活性直接影響骨量的變化。文獻報道,多種miRNA參與了破骨細胞分化和功能的調控,其表達水平與骨質疏松癥的發生、發展密切相關(表2)。
自噬是指無效的細胞元件被程序性降解的過程。自噬相關蛋白(ATG)在自噬泡形成中起關鍵作用,它的缺失會毀損破骨細胞的胞壁元件,減少骨吸收。研究發現miR-20 a能夠特異性的與Atg16l1的3’非編碼區域結合,降低其表達,抑制破骨細胞的分化和功能活性。低氧介導的破骨細胞分化,可通過上調的HIF-1α因子抑制miR-20 a的表達,減弱miR-20 a對Atg16l1的抑制,使破骨細胞分化和功能增強[24]。
Jing Y等發現在OVX小鼠骨質疏松模型中,小鼠的骨吸收增強和骨量丟失能夠被miR-34 a相關處理明顯改善。Tgif2能夠經RANKL相關轉錄因子的正反饋調節通路,刺激自身及RANKL相關因子的表達,從而促進破骨細胞的形成。miR-34 a能夠與Tgif2的mRNA的3’非編碼區域結合,削弱其對破骨細胞分化的促進作用,抑制破骨細胞的分化[25]。
RANK-RANKL信號通路在骨質疏松癥發生過程種發揮重要的作用,細胞因子RANK和其受體RANKL在前體破骨細胞表面結合,促進成熟多核巨細胞向破骨細胞分化,進而促進骨吸收。miR-106b能夠和RANKL的3’非編碼區域結合,降低其表達,抑制前體破骨細胞聚合,使破骨細胞分化降低[26]。
在佐劑性關節炎的小鼠模型中,用Pre-miR-124治療,可使破骨細胞的數量明顯減少。NFATc1是破骨細胞分化的一個關鍵因素,miR-124能夠直接作用于NFATc1,抑制破骨細胞的分化,緩解關節炎的發展[27]。
腫瘤壞死因子受體相關因子(TRAF6)在破骨細胞的分化和多核破骨細胞的形成及成熟過程中起關鍵作用。在破骨細胞分化的過程中,miR-125 a的表達水平明顯下降,是破骨細胞分化的負性調節因子。miR-125 a可直接作用于TRAF6因子mRNA 的3’非編碼區域,抑制破骨細胞的分化和成熟[28]。
蛋白激酶(PKCα)是一種調控細胞分化和凋亡的絲/蘇氨酸激酶,其對RANKL介導的破骨細胞分化及成熟有著關鍵作用。在RANKL相關的破骨分化和成熟過程中,miR-142-3p能夠在mRNA和蛋白水平同時降低PKCα的表達,減少前體破骨細胞之間的連接和融合,抑制破骨細胞的功能[29]。
骨髓間充質干細胞(BMMSCs)可誘導破骨細胞的凋亡,雌激素能夠使Fasl蛋白在BMMSCs中積聚來促進破骨細胞的凋亡。miR-181 a能夠和Fasl基因mRNA的3’非編碼區域結合,降低Fasl蛋白的表達。雌激素就是通過對miR-181 a的抑制,提高Fasl的表達,促進BMMSCs誘導的破骨細胞凋亡[30]。
研究發現RANKL介導的破骨細胞形成過程中,RANKL可抑制血紅素加氧酶(HO-1)的表達,而上調的HO-1能抑制破骨細胞的分化。HO-1的表達能夠被miR-183拮抗,miR-183可與HO-1mRNA的3’非編碼區域結合,降低其翻譯效率,減弱HO-1對破骨細胞分化的抑制作用,從而促進破骨細胞的分化[31]。
miR-214的過量表達,會導致骨密度降低和骨量減少。研究發現,miR-214不僅會抑制成骨細胞的分化和功能,且可促進破骨細胞的分化。在M-SCF和RANKL誘導的破骨細胞形成中,miR-214的水平明顯上升。miR-214通過直接與Pten的3’非編碼區域結合,激活PIK3/Akt/NFATc1信號通路,促進破骨細胞的分化[32]。
miR-218的表達在破骨細胞分化過程中會明顯降低,過量表達的miR-218能夠負向調節破骨細胞的形成。miR-218可作用于p38MAPK信號分子,抑制p38MAPK-c-Fos-NFATc1信號通路,阻止前體破骨細胞融合成有功能的成熟破骨細胞,并且抑制破骨細胞表面的肌動蛋白環的形成,從而抑制破骨細胞的成熟和功能[9]。
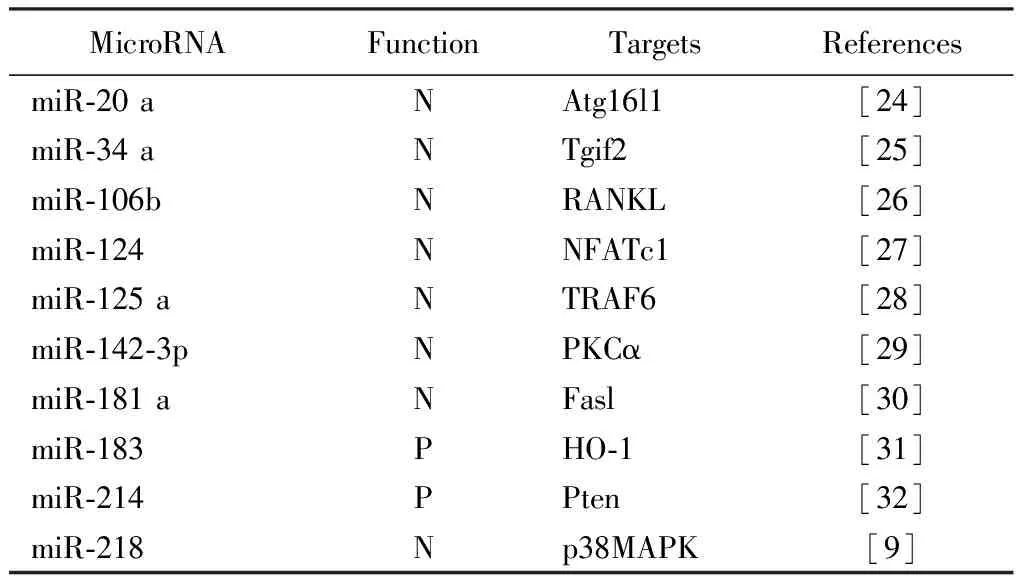
表2 MicroRNA參與破骨細胞分化和功能Table 2 MicroRNAs involved in osteoclast differentiation and function
P,Positive regulator of osteoclastogenesis;N,Negative regulator of osteoclastogenesis.
4 MicroRNA的臨床應用
MiRNA受到廣泛了的關注,尤其是在臨床應用方面,因其容易在血清中得以檢測,方便快捷,可作為相關疾病治療的靶點或某些疾病的診斷的生物學標記。研究報道:2015年miR-34激動劑類藥物能有效且安全地作用于原發性肝癌和轉移性肝癌患者白細胞中的目標基因[33]。
miR-21在肝纖維化疾病模型(CDAA)小鼠肝臟中的水平比對照組CSAA要明顯升高,在第3天到第24周都有明顯上升,在第4周達到最高峰。miR-21在血清中的水平與在肝臟中水平是一致的,其上升是在第1周到第24周,最高峰也是在第4周.因此,血清中的miR-21水平,能夠反映肝臟的纖維化,可作為肝纖維化疾病的血清指標[34]。
血清甲胎蛋白AFP作為肝細胞癌的診斷指標已是公認的,但約有1/3的早期患者的AFP血清水平不會發生明顯變化,且特異性并不高,肝炎和肝硬化患者的AFP血清水平都會發生改變。研究發現肝細胞癌患者血清中的miR-27b-3p和miR-192-5p水平會明顯上升,且其敏感性和特異性較AFP好,可作為肝細胞癌的診斷指標,尤其是對AFP陰性的肝細胞癌患者[35]。
臨床研究表明,miR-10 a-5p的水平在急性髓細胞白血病(AML)患者血清中明顯上升,其水平在血清中的敏感性和特異性都高達80%。且miR-10 a-5p的水平在AML發展地不同過程中是變化的,一定程度上影響著的AML患者病情的發展。MiR-10 a-5p血清水平較高的AML患者,預后較miR-10 a-5p水平不高者差,miR-10 a-5p有重要的臨床應用價值[36]。
miR-216 a是一種胰腺特異性的miRNA,其在血清中的水平可以作為急性胰腺損傷的生物學標志[37];miR-200 a,200b,200c可以用于卵巢腫瘤良惡性的診斷[38],其中miR-200b,200c還可以用于預測卵巢腫瘤患者的生存率[39];miR-18 a, miR-221, miR-2222,miR-224可以應用于肝腫瘤和肝硬化的診斷[40];miR-29 a,miR-150可以判斷非小細胞肺癌放療的放射毒性的大小等[41]。
miRNAs不僅僅應用于上述疾病的診斷和治療,在骨質疏松癥的臨床應用方面也有了初步的進展。Deng等發現在骨損傷的大鼠模型中,通過敲降miR-31可使得骨髓基質干細胞更多地向損傷部位遷移,行使其功能,有效地提高了骨損傷的修復[42]。2012年,Wang等挑選了20位絕經后白人女性,并將她們分為骨密度正常組和低骨密度組各10人,通過篩選365種miRNAs在其血液單核細胞中的表達情況,發現miR-133 a在低骨密度組中的水平明顯高于正常骨密度組,認為其可能是一種有效的臨床指標[43]。此后,Weilner等擴大了樣本量,將近期伴有骨質疏松性骨折的患者和年齡相近的健康人的血清miRNA進行了篩選,發現了10個在兩組人群中有顯著差異的miRNAs,又在隨后的體外實驗中確認了et-7 g-5p, miR-10b-5p,miR-100-5p,miR-148 a-3p和miR-21-5p影響著成骨細胞的形成和功能,其中miR-148 a-3p和miR-21-5p也被認為和破骨細胞的活性有著密切關系[44]。
總的來說,目前已經有許多miRNA被認為可以作為更有效的臨床指標,用于疾病的診斷、預后評估、了解腫瘤轉移等,部分已經應用于臨床,miRNA類的藥物研究也在開展,說明進一步研究miRNA具有潛在的臨床應用價值。
5 結語
骨質疏松癥發病機制的研究日益深入,也面臨許多難點,目前miRNA與骨質疏松癥的研究成為近年來的新熱點。大量研究證實多種miRNA對成骨細胞、破骨細胞的分化和功能活性起關鍵作用,直接或間接地影響著骨質疏松癥發生、發展。因此,miRNA在骨質疏松癥的精確診斷和精準治療中有著重大意義。但體液中的miRNA與骨質疏松癥之間的關系,以及如何有效地將miRNA作為靶點治療骨質疏松癥還有待進一步研究。

