膠質瘤疫苗的研究進展
祁 婧,張鵬幸,任東妮,涂艷陽 (空軍軍醫大學唐都醫院實驗外科,陜西西安710038)
0 引言
多形性膠質細胞瘤(glioblastoma multiforme,GBM)是成年人中最常見且最具侵襲性的原發性腦腫瘤,對常規治療方法具有抗性。雖然臨床中常用手術后輔助放療和化療的治療策略,但是每年15 000例患者的中位生存時間僅為14.6個月[1]。治療難度集中于腫瘤本身的遺傳異質性、患者異質性、腫瘤誘導的免疫抑制、血腦屏障的有限性和不可避免的腫瘤復發等方面。盡管面臨諸多挑戰,然而研究人員在GBM治療方面仍然取得了可觀的進展,特別是在免疫治療領域,多項藥物已經進入不同程度臨床試驗。
腫瘤疫苗是將腫瘤抗原以多種形式如腫瘤細胞、腫瘤相關蛋白或多肽以及表達腫瘤抗原的基因等導入患者體內,以克服腫瘤引起的免疫抑制狀態[2],增強免疫原性,激活患者自身的免疫系統,誘導機體細胞免疫和體液免疫,從而控制或清除腫瘤[3-4]。
根據抗原呈遞給免疫系統的方式將疫苗分為非細胞疫苗與細胞疫苗兩大類。其中非細胞疫苗是指患者直接接種特異性腫瘤抗原,其又被呈遞給宿主抗原呈遞細胞(antigen presenting cell,APC)以引發免疫應答。而細胞疫苗由APC組成,APC在體內被啟動并通過疫苗重新引入宿主,導致抗原的出現和腫瘤特異性T細胞反應的擴增(圖1)。
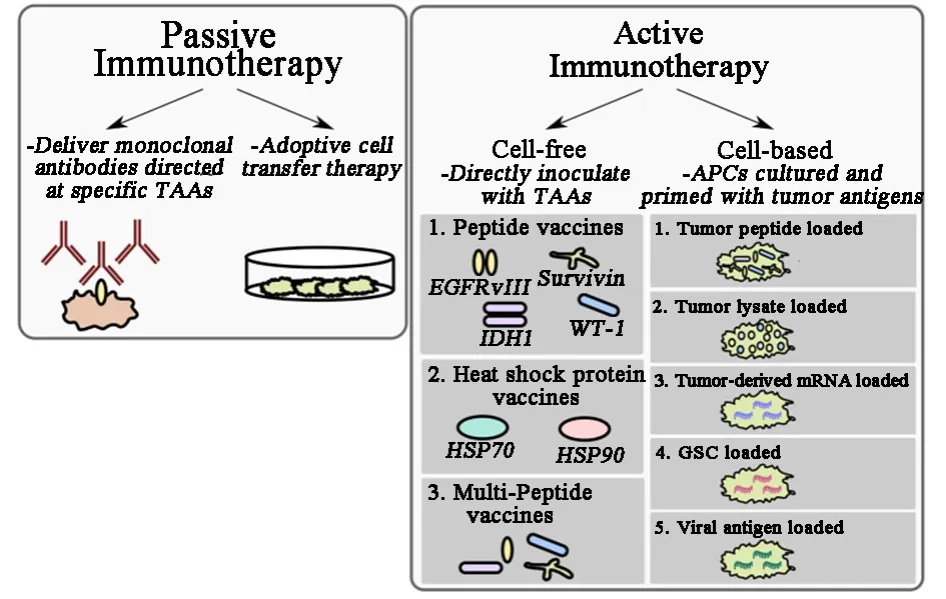
圖1 被動和主動免疫治療策略示意圖[4]
1 非細胞疫苗
1.1 肽疫苗肽疫苗由一個或多個短的或長的氨基酸序列作為腫瘤抗原,也能結合某些疫苗佐劑[5]。這些肽通常與載體蛋白連接以增強免疫原性[例如破傷風類毒素或鑰孔血藍蛋白(KLH)][6-7]。 另外,它們經常與免疫刺激劑如Toll樣受體(toll-like receptor,TLR)激活劑(例如脂多糖)或細胞因子[例如,粒細胞巨噬細胞集落刺激因子(granulocyte/macrophage-colony stimulating factor, GM-CSF),白細胞介素(IL)-2]一起使用以增強免疫反應[8-9]。膠質瘤發生與幾種TAA的異常產生相關,可能有潛質用于肽疫苗的開發。然而,挑戰難度在于鑒定腫瘤特異性,均勻表達的抗原,并具有足夠的免疫原性[10]。在許多潛在的GBM抗原靶標中,只有少數符合這些標準。
1.1.1 EGFRvIII 在肽疫苗中,關于表皮生長因子受體Ⅲ型突變體(epidermal growth factor receptor variantⅢ,EGFRvⅢ)的研究最廣泛。通常,表皮生長因子或轉化生長因子α誘導的EGFR激活促進受體二聚化,導致細胞內酪氨酸激酶結構域的自磷酸化和促進增殖的Ras/絲裂原活化激酶信號傳導[11-12]。蛋白質的其他部分的融合也產生與新的甘氨酸殘基的獨特連接,其側翼是野生型蛋白質中不存在的氨基酸序列[13-14]。 重要的是,EGFRvIII在 GBM 患者(25%~30%)中表達,與長期存活者的不良預后有關。此外,這種突變的存在可以通過免疫組織化學分析來確定,作為標準病理學處理的一部分[15-18]。研究報道EGFRvIII在膠質瘤干細胞也表達,即使其表達在腫瘤內是異質的,EGFR vIII陽性細胞也可以影響相鄰細胞,隨后提供增殖信號[19-20]。鑒于這些因素,EGFRvIII已經成為免疫治療的靶點。
在臨床前模型中評估了EGFRvIII疫苗的有效性。Heimberger等[11]報道相對于對照組接種導致顱內腫瘤小鼠的存活率增加了26%。此外,還證明在腫瘤植入之前接受疫苗接種的小鼠體內腫瘤不再繼續發展。為了臨床評估皮內給藥的EGFRvIII疫苗(CDX-110/rindopepimut)在 EGFRvIII陽性患者中的安全性和有效性,啟動了 3個Ⅱ期試驗:ACTIVATE[5],ACT Ⅱ[22]和 ACT Ⅲ[18]。 3 項試驗均給予患者連環磷霉素和GM-CSF作為佐劑。無論如何,與接受標準治療的匹配對照組相比,中位生存時間和無進展生存期(PFS)時間均顯著增加。ACTⅡ報告在疫苗治療的患者(n=22)中,歷史對照組(n=17)的中位生存時間為6.3個月,中位PFS時間(組織學診斷)為15.2個月。接種疫苗的患者和歷史對照的總生存時間分別為 23.6和 15個月。調整患者年齡和Karnofsky表現量表評分后,差異有統計學意義(P<0.05)。值得注意的是,復發時,腫瘤被認為是EGFR-vIII陰性,表明抗原性喪失[5]。這是源于天然疾病過程還是免疫消除是未知的,但表明靶向異質表達的抗原可能不滿足臨床要求。對于使用靶向EGFRvIII的嵌合抗原受體方法的結果較為理想啟動了第Ⅳ期Ⅲ期試驗。在安慰劑對照的雙盲研究中,患者接受了rindopepimut/GM-CSF或 KLH,以及 TMZ維持治療。不幸的是,2016年3月7日,Celldex宣布停止 ACT IV。該決定是基于臨時數據分析的結果,顯示接受疫苗接種的患者與對照組患者相比,總體生存率并未有明顯改善。盡管結果不理想,ReACTⅡ期試驗目前正在進行,并將CDX-110與貝伐珠單抗聯合使用,結果仍在分析中。
靶向EGFRvIII(ADU-623)的另一種藥物目前正在Ⅰ期臨床試驗中進行評估。ADU-623是靶向EGFRvIII和NYESO的活減毒李斯特菌疫苗,其是另一種已知的腫瘤抗原,據報道具有高免疫原性[19-25]。這項試驗正在招募患有復發性高級膠質瘤的患者,結果仍在分析中。
1.1.2 存活素 盡管EGFRvIII是研究最多的,但還有用于GBM肽疫苗的其他抗原候選物正在研究中。存活素是屬于凋亡蛋白家族抑制劑的分子。盡管其作用機制尚未得到充分描述,但研究表明,存活素既是有絲分裂的調節劑,又是細胞死亡抑制劑[25]。它在幾種癌癥中被上調,成為免疫治療的潛在靶標。重要的是,生存素在GBM中比在正常組織中表達水平更高,且預后較差[26]。 在使用 SVN53-67/M57(一種源自存活蛋白的肽疫苗)的研究中評估了存活蛋白作為免疫治療靶標的有效性,其可以激活對存活蛋白表達細胞的免疫應答。該疫苗與KLH結合,單個半胱氨酸取代蛋氨酸,增強免疫原性,增加腫瘤反應[30]。SVN53-67/M57在體外產生細胞毒性T細胞介導的人神經膠質瘤細胞的殺傷作用。此外,注射SVN53-67/M57(與GM-CSF組合)顯著增加存活時間,并減少GL261膠質瘤小鼠的腫瘤負荷。基于這些結果和完成的Ⅰ期試驗,SVN53-67/M57-KLH和TMZ的Ⅱ期試驗目前正在招募惡性膠質瘤患者。
1.1.3 異檸檬酸脫氫酶1 異檸檬酸脫氫酶1(isoci-trate dehydrogenase 1,IDH1)是可在膠質瘤中突變的酶。在精氨酸132殘基中最常發生突變,產生2-羥基戊二酸代謝產物,基因組超甲基化和惡性轉化。IDH1 R132H突變,特別是在≥90%的次級GBM中表達[27]。IDH1 R132H是癌癥免疫治療的重要靶標,因為它是腫瘤特異性抗原,在腫瘤細胞中具有統一的表達[27]。EGFRvIII的臨床經驗突出了GBM抗原異質性在免疫治療發展中的挑戰。建議靶向驅動突變,如IDH,可以避免異質性誘導的免疫逃逸[28-29]。最近的研究表明,用突變型IDH1肽接種的小鼠誘導特異性T細胞應答。此外,疫苗接種抑制了攜帶 IDH1 R132H表達肉瘤的小鼠的腫瘤生長。這種效應在表達野生型IDH的肉瘤中未見,證實該反應是突變特異性的[30]。需要進一步的數據來確定IDH疫苗是否適用于膠質瘤。目前有一項Ⅰ期臨床試驗,用于評估IDH1 R132H突變膠質瘤患者IDH1肽疫苗的安全性,計劃入組39例,結果仍在分析中。
1.1.4 WT1 Wilms腫瘤基因 WT1 在多種實體瘤中過表達,被認為是致癌基因[31-32]。WT1編碼鋅指轉錄因子,其參與細胞增殖和凋亡[33-36]。多項研究[37-39]已經確定了WT1在膠質瘤中的表達。Hashiba等[40]報道,73 例膠質瘤患者中有 70 例(95.9%)檢測到WT1蛋白,該表達與WHO等級相關。在另外評估829例膠質瘤樣品中,Rauscher等[41]報道,彌漫性星形細胞瘤中的WT1表達與WHO分級相關。由于WT1蛋白已經被鑒定為TAA,因此假設WT1產物可能適合開發基于肽的免疫治療。最近公布的Ⅰ期臨床試驗測試了7例新診斷為GBM的患者中基于WT1的肽疫苗聯合TMZ施用的安全性,并報告了PFS時間為 5.2 至 49.1 個月[42]。 在小型非隨機Ⅱ期試驗中,21例患有WT1/人白細胞抗原(HLA)-A? 2402陽性復發性GBM的患者用HLAA?2402限制性WT1肽的真皮內接種治療。研究[43]報道6個月PFS為33.3%,治療副作用最小。然而,沒有一個患者具有完整的放射成像反應。
1.2 多肽疫苗在實用性方面,肽疫苗具有多種益處,包括易于批量生產,直接給藥(例如皮內)[44]。幾種肽疫苗(不包括EGFRvIII肽)的一個局限性是,它們僅限于hla-02單倍體,然而,GBM患者存在多種單倍型,限制了該療法的通用性[45]。第二個局限性是,只有一小部分患有GBM的患者才能最終從靶向單個腫瘤抗原中獲益。最后,肽疫苗,特別是單一肽的主要缺點是GBM中抗原表達的異質性[20]。在CDX-110接種后腫瘤復發的EGFRvIII疫苗試驗中證實了這種現象,82%的病例表現出靶抗原(EGFRvIII)的喪失[46]。這表明復發后接種需要替代治療或聯合治療。
為了規避這些問題,已經開發了靶向各種腫瘤抗原的多肽疫苗。為了鑒定潛在的免疫原性腫瘤抗原,從GBM細胞的HLA復合物中洗脫肽。使用液相色譜-質譜法,鑒定出3000個肽。45例新診斷的GBM患者接受了手術切除,然后進行標準治療,完成了IMA950(加 GM-CSF)第一期Ⅰ/Ⅱ試驗[47]。 IMA-950與國立癌癥研究所環磷酰胺,GM-CSF和咪喹莫特組合的第二階段研究由于入組速度過慢被提前終止。值得注意的是,使用這些類型的肽和輔助方法的克隆型T細胞擴增的程度是否足以消除腫瘤也是未知的[48]。SL701是目前在臨床試驗中進行評估的另一種最近開發的多肽疫苗。SL-701由對應于在膠質瘤中過表達的靶標的3種肽組成:靶向存活蛋白、IL-13受體α-2和ephrin A2的高免疫原性突變體,結果仍在分析中。
另一種方法是根據單個腫瘤的抗原特征生成個性化的肽疫苗。一種策略是從患者的手術切除腫瘤組織中制備疫苗,以及從其他切除腫瘤中收集到的同種異體抗原。ERC-1671(Gliovac)是GBM腫瘤裂解物,來自患者的自體腫瘤細胞(從切除的腫瘤生成)和來自3種不同GBM供體的腫瘤細胞組成的多肽疫苗。該疫苗構建的目的是最大限度地使患者暴露于異種的GBM腫瘤抗原。暴露于更多的同種異體和自體腫瘤相關抗原,可減少腫瘤免疫逃逸的機會。ERC-1671在臨床評估中顯示出較為理想的結果[49-50]。9例復發性GBM患者,接受標準放化療和貝伐單抗治療ERC 1671導致生存期增加。具體來說,Gliovac患者6個月生存率為100%,而歷史對照組為33%[50]。基于這些結果,正在進行Ⅱ期試驗,以評估ERC1671(與GM-CSF和環磷酰胺聯合使用)加貝伐單抗在復發性GBM患者中的安全性和臨床療效。
當然,肽疫苗可以與免疫檢查點抑制劑聯合使用。雖然這具有明顯的理論吸引力,但實施可能是有挑戰性的。例如,雖然 30%的 GBM具有針對rindopepimut/CDX-110 的 EGFRvIII 靶標表達[16],但只有6%的患者在腫瘤內存在程序性死亡受體1(PD-1)+T 細胞,1%具有 PD 配體 1(PD-L1)共表達[55]。授予PD-1+T細胞和/或PD-L1表達可能只是用于響應免疫檢查點抑制劑的富集生物標志物,并且患者可在沒有這些生物標志物的情況下作出反應[52-54]。盡管如此,這些數據表明,這種類型的組合只能使少數患者受益。已經發現高腫瘤突變載量與其他癌癥中免疫檢查點抑制劑的反應相關[55-59],但是這些水平(每兆塔變化12個突變)僅在<10%的膠質母細胞瘤患者中發現[60]。
1.3 熱休克蛋白(heat shock protein, HSP)疫苗HSP是分子伴侶蛋白,通過防止蛋白質聚集和指導錯誤折疊的蛋白質的降解,在細胞應激反應中起重要作用[61]。包括HSP70和HSP90在內的某些HSP亞型已顯示與GBM中的腫瘤抗原結合并模擬先天性和適應性反應[62]。HSP-抗原復合物通過在APC上表達的CD91進行受體介導的攝取。在內化后,通過蛋白酶體處理復合物以加載到MHC I類分子上并呈遞至CD8細胞毒性T細胞。此外,HSP-抗原復合物還通過各種受體(即 CD36、CD91、CD40、CD14、TLR2 和TLR4)結合巨噬細胞,并刺激促炎細胞因子的產生[63]。HSP接種需要從患者切除的腫瘤中純化HSP,隨后重新接種于患者,以使HSP與宿主APC和主要效應細胞與抗原肽相互作用[63]。HSPs有助于抗原肽呈遞循環的APC,隨著APCs與HSP結合,吞噬其伴侶蛋白,并提出這些抗原多肽靶向T細胞介導的細胞毒性破壞,隨后引發免疫應答[63-64]。
大多數HSP疫苗試驗使用HSP-肽復合物96(HSPPC-96),其包含由HSP糖蛋白-96伴隨的抗原肽[65-66]。在12例復發性GBM患者的Ⅰ期試驗中,HSP疫苗治療顯示無顯著毒性,其中有11例發現腫瘤特異性免疫反應(在腫瘤微環境和外周血中都觀察到)[67]。在隨后的單次非隨機Ⅱ期試驗中,手術切除后,41例復發性GBM患者每周接受一劑HSPPC-96,持續4周。中位PFS和總生存期分別為19.1和42.6周[68]。在新近診斷的GBM且正在接受放化療標準治療的患者中,HSPPC-96的Ⅱ期臨床試驗已經完成并正在出版(NCT00905060)。另外,一項隨機Ⅱ期試驗結合HSPPC-96和貝伐珠單抗復發性GBM患者也正在積極招募,估計入組222例。
通過在疫苗接種期間檢測各種類型的潛在抗原蛋白的能力來鑒定這種治療策略。HSP疫苗也可能通過多種機制刺激先天和適應性免疫系統的反應。除細胞毒性T細胞外,HSP還誘導巨噬細胞分泌促炎細胞因子,如腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、GM-CSF 和 IL-12等。 IL-12隨后激活淋巴細胞和天然殺傷細胞的細胞毒活性。HSP復合物還能夠增加DC和巨噬細胞中一氧化氮的產生和分泌。最后,HSP誘導不成熟的DCs成熟[69],這可能有助于更強大的免疫反應。應該注意的是,HSP疫苗的局限性在于需要大量的組織來產生疫苗[63]。
2 細胞疫苗
2.1 DC疫苗DC是專業的APC,并且是細胞介導的免疫應答中最強大的激活劑。在MHC的背景中,DC吞噬、加工和呈遞后,將抗原呈遞給初始T細胞,引發抗原特異性CD8+和CD4+淋巴細胞反應。除此之外,T細胞功能通過促炎細胞因子活化的DC分泌增強。由于這些功能,DC是疫苗開發的理想選擇。在疫苗制備中,從患者中提取DC,離體培養并加載TAA。隨后將這些引發的DC再次引入患者以促進抗原特異性T細胞活化。
DC疫苗已在GBM中進行了研究。成功的臨床前研究和小型臨床研究已經引起人們的興趣,以確定最佳分子加載到DC以產生最強大和腫瘤特異性的反應[70]。盡管構建直流疫苗的過程比肽疫苗的費用要高得多,但其最大的優點在于其靈活性能夠為DC提供廣泛的刺激物,包括肽、腫瘤裂解物和癌癥干細胞,所有這些都是針對腫瘤的個體而定制。
2.1.1 腫瘤肽負載的DC疫苗 在最基本的水平上,可以用與肽疫苗相同類型的肽表位來刺激DC。在臨床試驗中,EGFRvIII是加載到DC中的最早的肽之一。在Ⅰ期研究中,12例新診斷的GBM患者接受了EGFRvIII特異性肽(PEPvIII)-KLH脈沖的DC手術切除和放射治療。進展時間和總生存時間(從疫苗接種)的中位數分別為6.8和18.7個月。沒有觀察到嚴重的不良反應或毒性。Phuphanich等[71]進行了ICT-107的Ⅰ期臨床試驗,一種由患者DC與6種相關GBM肽抗原組成的自體疫苗。在21例患者的初步資料中,接種疫苗后產生良好的生存期,中位PFS和總生存時間分別為16.9個月和38.4個月。目前正在招募患者進行Ⅲ期臨床試驗評估。
2.1.2 腫瘤裂解物負載DC疫苗 在這種技術中,腫瘤裂解物由外科手術切除后獲得的自體腫瘤細胞制備。裂解患者腫瘤細胞以產生細胞碎片,隨后脈沖進DC。DC暴露于這些腫瘤片段允許吞噬和隨后的肽抗原呈遞到MHC I類和II類[72]。使用腫瘤溶菌素的優點是無偏性地刺激DC以充分補充患者特有的TAAs,包括未被認識的腫瘤抗原[73]。或者,這可能產生非腫瘤特異性免疫應答或可將T細胞的克隆型擴增稀釋為弱免疫原性抗原。在Ⅰ期研究中,確定了自體腫瘤裂解物基DC疫苗的安全性和生物活性。此外,復發性GBM(n=8)患者的中位生存時間是133周[4]。在這種疫苗亞型中更加強效的治療方法是DC-VaxL。DCVaxL目前正在進行Ⅲ期臨床試驗,其結果非常符合預期[74].
2.1.3 mRNA負載DC疫苗 DC也可以加載腫瘤衍生的mRNA。與腫瘤蛋白質相比,mRNA可以在體外擴增,使這種技術具有實際的優勢。擴增可用相對較小的細胞來源用于生產大量抗原負載的DC。此外,有報道[74]稱,RNA在 DC誘導 T細胞中優于 DNA。目前有幾項實施這項技術的臨床試驗。
2.1.4 膠質瘤干細胞負載DC疫苗 神經膠質瘤干細胞(glioma stem cells,GSCs)是與其余腫瘤細胞相比獨特的細胞亞型,表現出自我更新能力[75]。已知GSCs具有耐化療作用并且導致復發[76-77]。GSCs也具有抑制T細胞增殖和活化,誘導調節性T細胞和觸發 T 細胞凋亡的能力[78]。 已有研究[8]稱 GSCs作為DC免疫治療的靶標,因為有效地破壞了腫瘤介導的免疫抑制的驅動因素,可能會有更大的療效。Pellegatta等[79]報道,加載GL261神經球(富含干細胞)的DC治療了80%的GL261荷瘤小鼠,而用含有GL261裂解物的DC治療的小鼠僅為50%。Vik-Mo等[80]報道了在I/Ⅱ期用干細胞的DC疫苗治療的7名患者。分離GBM標本,在體外分離并擴增患者干細胞。之后,將干細胞mRNA擴增并加載到DC中。在接種疫苗的患者中,沒有觀察到嚴重的毒性。此外,治療患者的PFS間期是匹配對照的2.9倍(分別為694 d vs 236 d,P=0.0018)。 目前的第一階段試驗正在測試ICT-121的安全性,ICT-121是一種基于DC的疫苗,靶向CD133+(干細胞標記)細胞。應該注意的是,使用GSC生成/收獲的技術是昂貴且困難的,這可能限制了該手段的廣泛性。
2.1.5 病毒抗原負載DC疫苗 2002年初確定了巨細胞病毒(CMV)及其基因產物的存在,CMV被認為在致癌途徑中具有相關的作用[81]。考慮到這一點,廣泛的研究致力于開發GBM免疫治療的這一功能。人CMV病毒粒子被一種天然殼包圍著。最豐富的蛋白質是pp65,這種CMV抗原可用于靶向免疫治療。臨床試驗正在評估基于CMV的治療GBM的策略。在本研究中,自體DC裝載有CMV pp65-溶酶體相關膜蛋白 mRNA,并與抗 CD25單克隆抗體(basiliximab)組合施用。抗CD25的作用是抑制T調節細胞并增強CMV特異性T細胞活性。最近的研究[81]發現,使用召回抗原破傷風/白喉(Td)類毒素預處理疫苗部位可以促進DC歸巢到淋巴結和DC疫苗接種的功效。研究[82]報道,用Td類毒素預處理的患者具有增強DC遷移并顯著改善生存的作用,ELEVATE是一項Ⅱ期隨機臨床試驗。
2.1.6 綜合治療中DC疫苗 由于DC疫苗接種的臨床前和臨床前景,該免疫治療策略已經與其他形式的免疫治療相結合,以增強所需的免疫應答。免疫系統抑制途徑可能特異性地破壞DC疫苗接種的效果。免疫檢查點是參與這些途徑的受體。最近的一項臨床前研究[83]評估了腫瘤裂解物脈沖DC與免疫檢查點封鎖相結合的功效,特別是抑制PD-1/PD-L1軸。該信號軸已涉及幾種癌癥,已被證明可以減少效應T細胞的活化并促進腫瘤免疫反應。在膠質瘤小鼠中,DC接種和PD-1抗體的聯合治療導致腫瘤浸潤淋巴細胞中免疫記憶和歸巢(即L-選擇蛋白、整聯蛋白α-4鏈)的標志物的上調。此外,用聯合治療治療的動物比用單一療法治療的動物存活時間顯著更長。具體來說,單藥治療未見效果,但聯合治療組長期存活率為40%[83]。Ⅰ期試驗(AVERT)正在測試CMV特異性DC疫苗與尼莫單抗(抗PD-1抗體)的聯合治療方案,目前正在招募復發性高級膠質瘤患者.
3 結論
腫瘤疫苗允許免疫系統被引導到腫瘤靶標,并且在適當的背景中可以誘導長期的免疫應答。目前有多項臨床試驗探索該治療平臺。基于迄今為止關于腫瘤疫苗的研究結果,未來的研究應該重點關注將疫苗接種治療與常規治療相結合,結合靶向不同抗原的疫苗和潛在的其他形式的免疫治療(例如檢查點抑制,過繼轉移治療)。聯合治療可能降低腫瘤免疫耐受和逃逸的潛力。此外,需要更準確地了解免疫治療的時間,以及疫苗接種方案的標準化,佐劑和監測患者免疫應答的方法。此外,還需要解決這一患者群體頻繁并發使用類固醇的問題,因為經常需要減少顱內壓和癥狀的類固醇治療可能會破壞所需的免疫反應[83]。腫瘤因子對疫苗療效的影響也沒有完全闡明,特別是對于低級膠質瘤。具體來說,這包括諸如腫瘤部位、切除程度、原發性與繼發性GBM以及復發性疾病與初始治療相關的因素[75]。總體來說,疫苗治療是一種具有潛力但仍需進一步優化的治療策略。

