棉花SSR標記種質資源純度鑒定及遺傳多樣性分析
石建斌 周紅 王寧 許慶華 喬文青 嚴根土
(中國農業科學院棉花研究所 棉花生物學國家重點實驗室,安陽 455000)
棉花作為我國重要的經濟作物,在推動國民經濟的發展與人民生活水平的提高方面起著重要作用。隨著棉花產業的持續發展,新品種審定速度快、數量多,而骨干親本數量有限且反復利用導致棉花品種的遺傳差異越來越小。另外,隨著轉基因技術在棉花育種中的應用,在原品種基礎上改良少數或單個性狀的衍生品種增多,完全依據形態性狀進行棉花品種的辨別越來越困難[1],且傳統的棉花品種真實性和純度是通過田間種植的方法鑒定的,耗時長、成本高、時效性差,易受環境因素的影響[2]。目前,生產上應用的棉花類型有常規品種和雜交品種,大多數優勢雜交棉花品種是通過人工去雄制種,制種過程中,母本因去雄不徹底或漏去雄易形成自交鈴,嚴重影響雜交種純度,而常規品種的遺傳純度(位點純合)和非遺傳混雜(生產或加工時的異源種子的摻入、異源花粉的異花授粉等)也會給棉花品種純度和遺傳多樣性的鑒別帶來很大問題。如果不能及時、準確地進行鑒定,則會給棉花生產帶來嚴重的損失。因此,對棉花品種快速、準確而高效的純度檢測,對于棉花品種的推廣應用意義重大。
棉花品種純度的檢測方法有種子形態學、幼苗鑒定、蛋白質電泳以及田間小區種植鑒定等。近年來,隨著生物技術的飛速發展與在育種途徑的多樣化,分子標記技術因其準確可靠、批量操作及不受環境因素制約等優點已被廣泛應用于農作物品種真實性與純度鑒定中[3]。其中,由于SSR多態性豐富,而且覆蓋整個基因組的編碼區和非編碼區,成為一種新興分子標記[4]。棉花基因組中存在著豐富的SSR標記,SSR標記以其獨特的優勢,已被廣泛用于棉花的遺傳圖譜構建、目標基因定位、遺傳多樣性分析、種質鑒定及分子標記輔助選擇等方面的研究。馬軒等[5]利用SSR標記構建了彩色棉的指紋圖譜,為彩色棉品種的真偽鑒定和純度檢測提供了方法。武耀廷等[6]針對SSR引物的多態性進行了篩選,認為篩選的SSR標記可對棉花雜交種進行純度鑒定。劉勤紅等[4]以轉基因抗蟲雜交棉魯棉研15號母本、父本及其F1代為材料,通過篩選217對棉花異源四倍體的SSR引物,獲得了十幾個區分魯棉研15號親本及其F1代的標記位點,為魯棉研15號雜交種的純度鑒定提供了方法。郭寶生等[7]利用9對SSR引物對46份陸地棉與海島棉品種(系)進行了遺傳多樣性分析,結果表明,漸滲系主要遺傳背景為陸地棉,由于漸滲位點和基因不同,從而造成一定的差異,被聚類到不同小組。滕中華等[8]通過對4個棉花栽培種的29份棉花品種/品系SSR遺傳多樣性分析表明,棉花栽培種陸地棉、海島棉、中棉和草棉種內遺傳差異小,認為種間雜交漸滲系的培育是增加陸地棉遺傳多樣性的有效途徑。李武等[9]利用SRAP標記對國內外的56份海島棉品種進行了遺傳多樣性分析,結果表明,我國現在育成的品種相對于早期品種遺傳多樣性在逐漸降低。吳大鵬等[10]利用SSR技術研究了不同海島棉生產國的海島棉品種資源的遺傳親緣關系和遺傳多樣性,結果表明SSR標記能較好地揭示供試棉花品種之間的遺傳差異和親緣關系。李成奇等[11]對來自前蘇聯、中國、美國和埃及的20份海島棉種質資源進行SSR分析,較好地揭示了供試棉花品種之間的遺傳差異和親緣關系。
目前,采用田間調查品種性狀的方法因耗時長、成本高、效果差而特別容易受到環境條件的影響,SSR標記因其操作簡單、重復性好、對DNA質量要求不高、屬共顯性標記而被認為是品種鑒定較為理想的分子標記之一,成為品種鑒定技術的研究熱點[12]。基于SSR分子標記已構建了水稻[13-14]、大豆[15]、小麥[16-17]、玉米[18-19]、馬鈴薯[20]等主要農作物的指紋圖譜。SSR標記技術在棉花中也逐步得到了廣泛的應用[21-22]。本研究采用SSR引物首先對現有的58份棉花種質資源進行純度鑒定,確保對種質資源的有效利用,并通過遺傳多樣性分析,進一步了解種質間的親緣關系與遺傳組成,旨為雜交親本的選擇利用、合理組配提供參考依據。
1 材料與方法
1.1 材料
供試材料為中國農業科學院棉花研究所提供的棉花種質資源,包括國家審定品種及國外引進品種共58份(表1)。所用26對核心SSR引物由國家區試站付小瓊老師提供,由上海生物工程公司合成。
主要儀器包括細胞破碎儀(Retsch MM400)、高速低溫離心機(Bio-Rad)、PCR儀(Bio-Rad)、水浴鍋、DYY-6C型電泳儀和微量移液槍(Eppendorf)等。
主要試劑包括N,N-甲叉雙丙烯酰胺(Bis)、丙烯酰胺(Acr)、三羥甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、過硫酸銨(APS)、硼酸、三氯甲烷、異丙醇、異戊醇、CTAB、無水乙醇和硝酸銀等,以上試劑均為分析純,購自上海生物工程公司。10×buffer、dNTPs、Taq酶等購自天根生物公司。
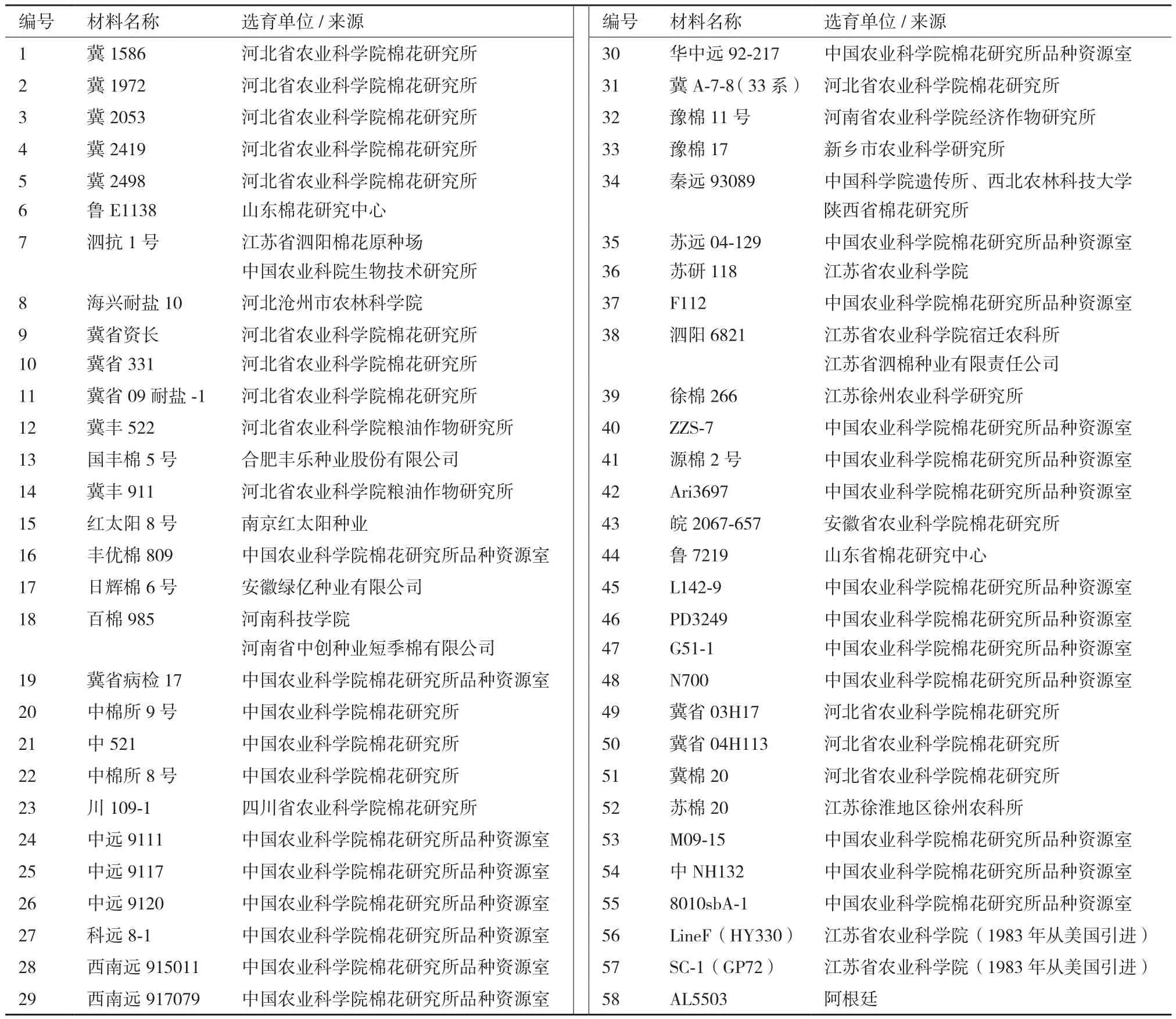
表1 棉花種質資源供試材料
1.2 方法
1.2.1 棉花葉片DNA的提取 在棉花幼苗期(5-6片真葉)進行取樣,取植株頂部完全展開的幼嫩葉片,每個棉花材料連續選取10株,取完后植株掛牌,葉片采集后立即放入冰盒內帶回-80℃保存。采用CTAB法提取棉花葉片DNA[23],并且參照付小瓊等[4]方法進行改進,用核酸和蛋白測定儀測定棉花基因組DNA在230、260和280 nm處的OD值,讀取稀釋后樣品DNA濃度,根據樣品OD260/OD280和OD260/OD230的比值判斷DNA樣品的純度,并用1%瓊脂糖凝膠電泳檢測基因組DNA的質量及完整性。
1.2.2 SSR-PCR擴增與聚丙烯酰胺凝膠電泳 SSRPCR 反應體系為 20 μL,包含 10×PCR Buffer 2.0 μL、dNTPs(10 mmol/L)0.8 μL、Taq 酶(2.5 U)0.3 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、DNA 模版 1.0 μL 和 dd H2O 13.9 μL。PCR反應程序為95℃ 5 min;94℃ 30 s,45 s,72℃90 s,30個循環;72℃ 10 min;4℃保存。
取2 μL PCR產物加Loading buffer,于8%聚丙烯酰胺凝膠上進行電泳,恒壓200 V,時間1.5 h,電泳結束后拆板,并用蒸餾水漂洗2次,將膠加入染色液(0.2%的AgNO3、1%的冰醋酸、10%的無水乙醇)進行銀染,然后用蒸餾水漂洗2次,再加入顯影液(1.5%的無水NaOH,每200 mL溶液加1 mL甲醛)進行顯色,最后用數碼相機對凝膠進行照相,并統計條帶。
1.2.3 條帶統計與數據處理 依據SSR-PCR產物在凝膠上的相對位置,對各引物擴增的基因帶型進行統計,按條帶有無分別賦值,有帶記為1,無帶記為0,統計總位點數和多態性位點數。根據各引物擴增譜帶結果計算SSR標記的變異的多態性信息含量(Polymorphism information content,PIC),PIC=1-∑(Pi)2,其中,Pi表示第i條譜帶出現的頻率[24]。各類群內多樣性指數H0=-∑PilnPi,n個不同群體的平均多樣性指數Hgroup=ΣH0/n,總的多樣性指數Hsp= ΣPlnP是把所有的供試材料群體作為一個整體時,以表型頻率P計算而得到的多樣性[25]。利用NTsys-pc 2.10軟件進行遺傳多樣性分析,計算各樣本間的遺傳相似系數(Genetic similarity,GS);聚類分析按基于Nei-Li遺傳相似系數按不加權成對數算術平均法(Unweighted pair group method with arithmetic,UPGMA)進行。
2 結果
2.1 棉花基因組DNA質量檢測
棉花種質材料經CTAB方法提取DNA后,于1%瓊脂糖凝膠電泳檢測其完整性(圖1),并經核酸測定儀測定其質量,結果表明,提取的DNA質量較好,OD260/OD280在1.73-2.00,可以作為進行SSR-PCR擴增的模板。

圖1 DNA瓊脂糖檢測
2.2 棉花種質資源純度檢測
利用26對核心引物對供試材料進行SSR-PCR電泳檢測,分析純度。讀取條帶時,同一材料中若每株植株有2對及以上的引物擴增譜帶與其他植株不同,則定義為雜株,未達到2對引物擴增譜帶不同的植株定義為正常株。通過電泳檢測發現,各種質資源材料中所含雜株數情況不一(圖2),在同一引物擴增條件下,M1和M2材料中的所有植株譜帶一致,表明在該引物條件下,M1和M2材料純度高,無雜株;M3材料中的1和7植株與其他植株譜帶不同,M4材料中的4植株與其他植株的譜帶不同,在該引物檢測條件下,將M3材料的植株1和7、M4材料的植株4視為雜株,表明M3和M4材料的品種純度降低。
不同棉花種質資源的SSR標記純度檢測結果如圖3所示,純度概率在20%-90%,其中AL5503的純度最低,為20%,占供試材料的1.7%;冀2053、海興耐鹽10、冀省331、國豐棉5號、中遠9120、華 中 遠 92-217、 豫 棉 11號、Ari3697、L142-9、PD3249、SC-1(GP72)等11份種質材料的純度較高,為90%,占供試材料的19.0%;純度為70%-80%的種質材料最多,共有31份,占供試材料的53.4%。
分子標記檢測可以與田間性狀觀察相互驗證,在引物2和引物5擴增條件下,供試材料“冀省03H17”的植株中出現了譜帶不一致的情況(圖4-A,圖4-B),此時將具有特異譜帶的植株定義為雜株。通過田間定株觀察表型性狀,發現雜株的葉形與葉色與正常株存在一定的差異(圖4-C和圖4-D),與正常植株葉片相比,雜株葉形表現為典型“雞腳葉”,裂口較深,且葉色較淺有斑紋。分子標記鑒定與田間性狀觀察結果一致,說明SSR純度檢測的準確度較高,可作為快速檢測棉花種質資源純度的方法。
2.3 SSR引物多態信息分析
由表2可知,26對SSR核心引物在58份材料中共擴增出85種多態性基因型,每個標記檢測到的基因型數為2-5,最多的為NAU1167、DPL0528、DPL0917(圖5)和TMB1638引物,最少的為NAU3419、HAU1300、NAU1362、MON168、BNL3033、BNL1026、NAU1102、CGR6410、BNL3173和CIR170引物,平均每對引物擴增出3.27個基因型,基因型數大于平均值的標記12個,占比46.2%;標記間的多態性信息含量介于0.0737-0.9281,平均為0.3639,其中多態性信息含量大于平均數的標記14個,占比53.8%,基因型數和多態性信息均大于平均值的標記5個,占比19.2%。
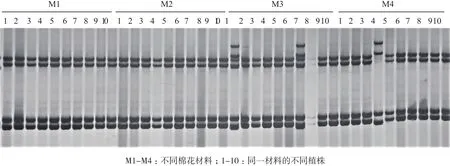
圖2 同一SSR引物進行的不同棉花種質資源電泳檢測
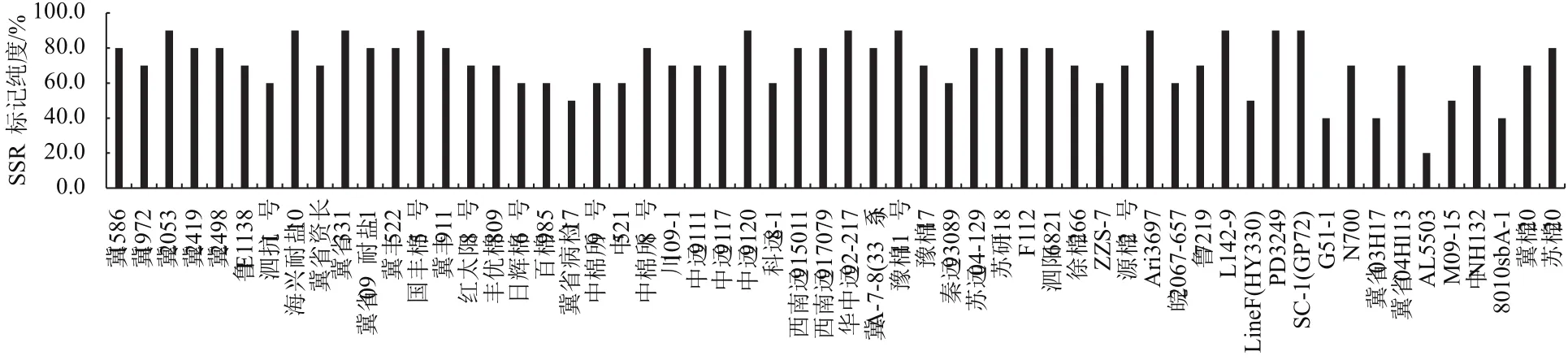
圖3 不同棉花種質資源SSR標記純度檢測

圖4 棉花種質材料SSR檢測與表型鑒定對比
2.4 遺傳相似性分析
采用Nei-Li相似系數(GS)計算供試材料的電泳譜帶結果,得到供試材料相似系數矩陣。58份棉花種質資源材料的GS變化范圍為0.3051-0.8983,變幅為0.5932。由相似系數矩陣可以看出,“AL5503”與“SC-1(GP72)的遺傳相似系數最小,為0.3051,其次是與“G51-1”、“冀省病檢17”、“西南遠917”等材料的相似系數最小,其遺傳距離較大,表明這些材料之間的親緣關系最遠。而“川109-1”和“中遠9120”的遺傳相似系數最大,為0.8983,即兩者遺傳距離最小,表明它們的親緣關系最近,該結果與其遺傳背景接近有關。
2.5 聚類分析
對供試棉花種質資源遺傳差異按UPGMA法進行聚類分析。聚類結果(圖6)顯示,58份種質材料在遺傳相似系數0.63水平上分為5個類別。第一類包含24份供試材料,占41.4%,其遺傳相似系數為0.4915-0.8644,變化幅度為0.3729,多樣性指數為13.83。該組內又可分為3個亞類,其中“冀1972”與組內其他材料的遺傳相似系數較小,表明在遺傳背景上,與其他材料有較大差異;第二類包含7份供試材料,分別為“日輝棉6號”、“F112”、“蘇遠 04-129”、“泗陽 6821”、“皖 2067-657”、“LineF(HY330)”和“PD3249”,占12.1%,其遺傳相似系數為0.5424-0.8475,變化幅度為0.3051,多樣性指數為10.62。其中“LineF(HY330)”和“PD3249”為國外引進種質資源;第三類包含18份供試材料,占31.0%,包括“中遠”系列材料3份,“冀”系列材料6份,另外還包括“豫棉11號”、“魯7219”等材料,表明該組內主要包含黃河流域的棉花種質資源。組內遺傳相似系數為0.5593-0.8983,變化幅度為0.3390,多樣性指數為11.05;第四類包含8份供試材料,占13.8%,分別為“魯E1138”、“百棉 985”、“蘇棉 20”、“豐優棉 809”、“徐棉 266”、“中棉所8號”、“蘇研118”和“源棉2號”,遺傳相似系數為0.5762-0.7966,變化幅度為0.2204,多樣性指數為9.15;第五類包含1份供試材料,為“AL5503”,該材料與“SC-1(GP72)”的遺傳相似系數最小,為0.3051,與“冀省資長”的遺傳相似系數最大,為0.6610,表明在所有供試材料中,“AL5503”與“SC-1(GP72)”的遺傳背景差異較大,而與“冀省資長”的遺傳背景最為接近(圖7)。

表226對SSR引物在58份棉花品種中的引物多態性信息含量
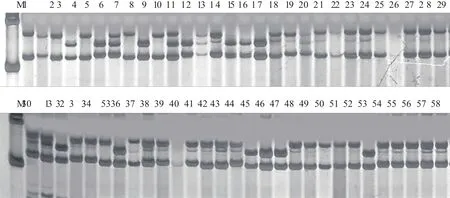
圖5 引物DPL0917對58份棉花種質資源的擴增電泳圖
2.6 群體多樣性指數分析
基于聚類分析結果,分別統計每個位點譜帶出現的頻率,按公式計算各類群內的多樣性指數、平均多樣性指數、類群內多樣性指數及類群間多樣性指數(表3)。從表3可以看出,除了第五類群只有一個材料外,其他各群體多樣性指數在9.15-13.83,平均多樣性指數為8.93,類群內多樣性指數為0.82,類群間多樣性指數為0.18,表明棉花種質資源的遺傳變異更多的是來群體內,各類群間差異不大。
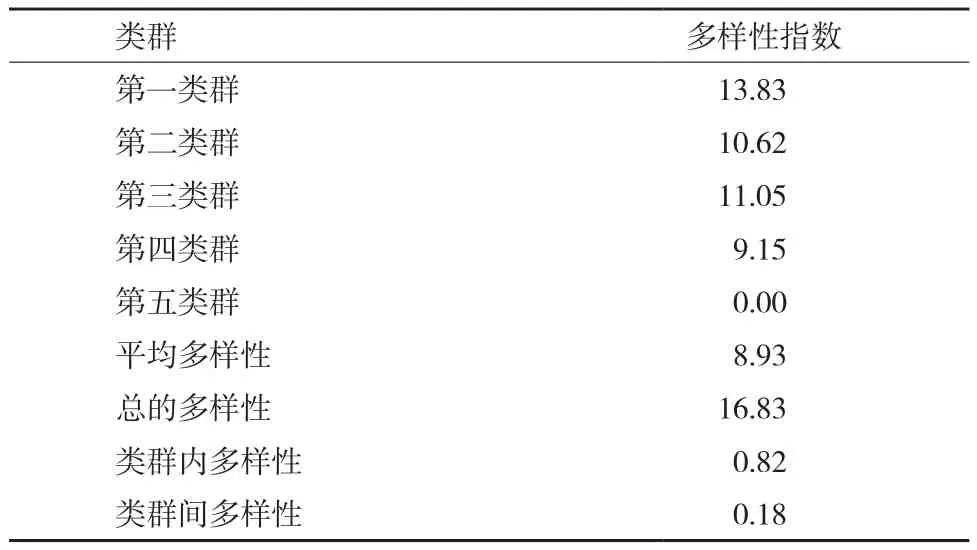
表3 供試棉花種質資源遺傳多樣性指數分析
3 討論
3.1 利用分子標記進行棉花純度鑒定的意義
棉花的性狀大多屬數量性狀,由多基因控制,易受環境影響。現有的鑒定方法中,同工酶和蛋白質電泳可檢測的位點少,蛋白質類型不多,多態性水平低,對于不同品種不能有效區分。分子標記則是在分子水平上揭示不同材料之間存在的遺傳差異,如棉花產量、纖維品質均表現為數量性狀的遺傳方式,易受外界環境條件影響,分子標記技術可在棉株生育早期檢測后期性狀,準確鑒定棉花品種間的差異,對于提高種子純度檢測效率有重要意義。一種理想的分子標記應具有多態性高、重復性和穩定性好、簡便宜操作、帶型清晰易統計、在染色體上分布均勻及開發使用成本低等特點[26]。SSR標記具有按孟德爾遺傳方式分離、共顯性遺傳等特點,且多態性較高,程序簡單,成本較低,目前已廣泛應用于許多作物的基因定位、QTL分析、品種真實性鑒定、種子純度檢測及遺傳多樣性研究當中[27]。本研究結果表明,53.4%的種質材料純度在70%-80%,來源于阿根廷的“AL5503”材料純度最低,這可能是由引進過程中繁種方式及選種時的機械混雜造成的。通過田間表型觀察發現,“冀省03H17”材料植株中存在葉色與葉形區別于其他植株的雜株,結合SSR譜帶類型發現,該雜株擴增出了特異譜帶類型,表明SSR純度檢測的準確性較高,是一種快速進行棉花品種純度檢測的方法。
3.2 棉花種質資源聚類結果分析
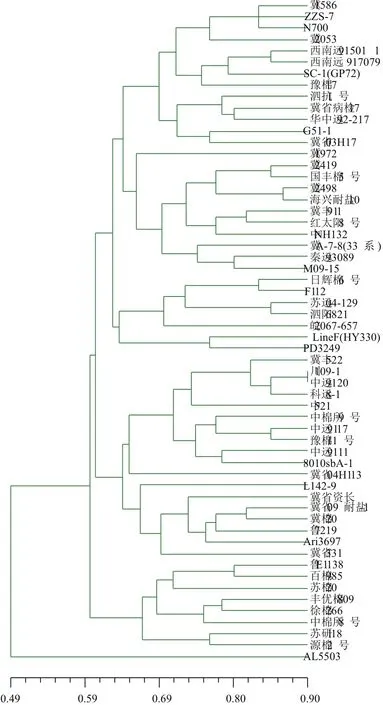
圖6 棉花種質資源聚類圖
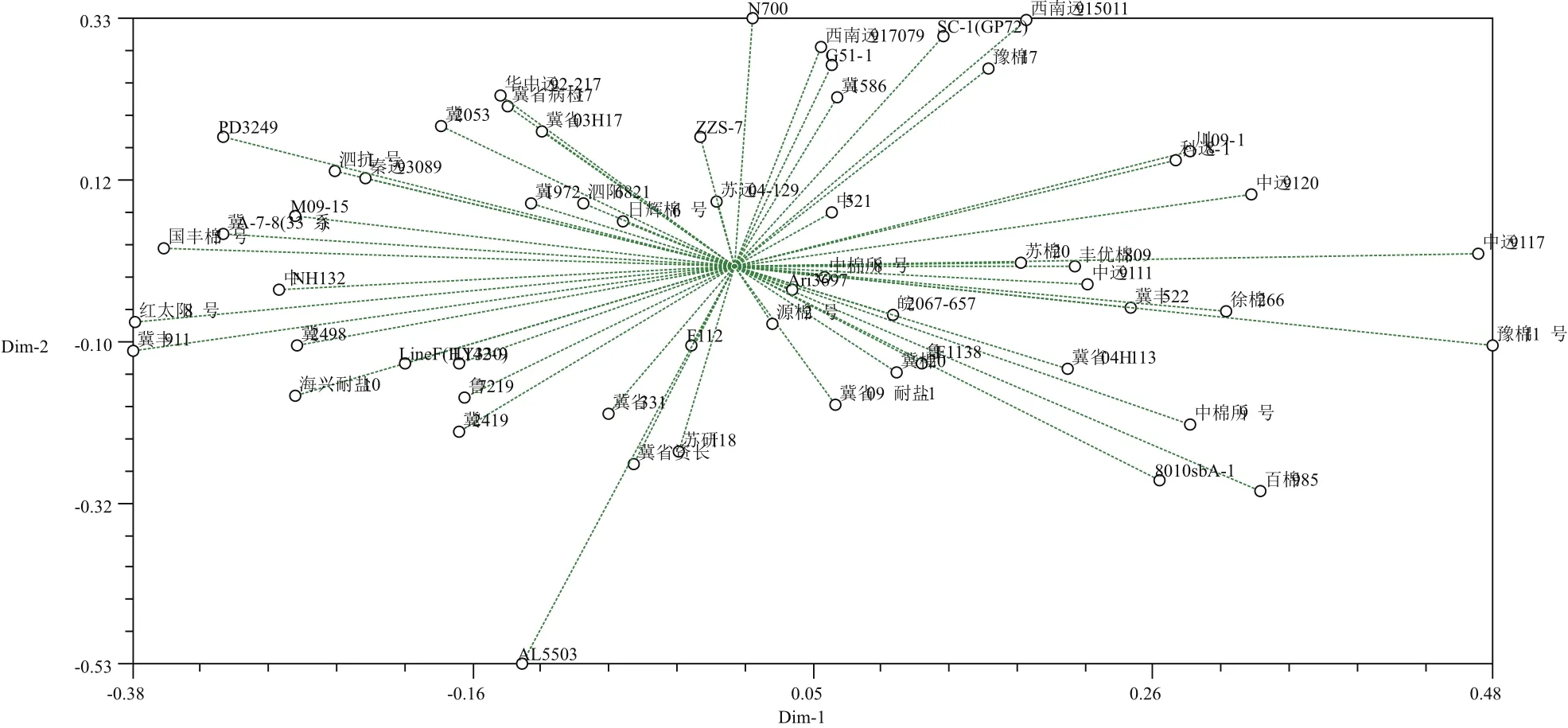
圖7 棉花種質資源聚類分析二維分布圖
58份棉花種質資源材料的相似系數矩陣表明,來源于阿根廷的“AL5503”與其他材料的遺傳相似系數較小,同為遠緣后代的“川109-1”和“中遠9120”的遺傳相似系數最大,說明種質間的遺傳相似性與遺傳背景有關。在遺傳相似系數0.63水平上將58份資源分為5大類,與系譜分析結果[28]部分吻合。例如,“豫棉11號”是以(中棉所12號×(河南69×(完紫×科遺)))組合選育而成的,而“中棉所12號”又是經“烏干達4號”與“冀棉1號”雜交獲得的,所以“豫棉11號”既帶有“烏干達棉”的血統,又帶有“冀棉1號”的血統。“冀棉20”則是從((海陸野×海陸野)×冀棉10號)組合后代中選育而成的,“冀棉10號”則是從(冀棉5號×冀棉1號)的組合中選育得到的,因此,“冀棉20”也帶有“冀棉1號”的血統。“中棉所9號”則是從((中棉所4號×烏干達3號)×陜3778)的組合中得到的,帶有烏干達棉血統。所以,“豫棉11號”、“冀棉20”和“中棉所9號”被歸在了第三類。“徐棉266”是由((蘇棉20×渝棉1號)×徐99-2)復合組合中選育而成的,與“蘇棉20”歸在第四類。這表明,這些品種資源的DNA聚類與其地理生態來源無關,而是與品種的親緣關系相關性較高,親緣關系近,則較早聚為一類,反之,則較晚才聚一類。但也有不吻合的情況,如“豫棉17號”是以“朝陽1號”后代((中383-1×373-3)×中6331)組合后代在病圃中選抗病株育成,追溯其系譜來源,“豫棉17號”帶有“中棉所8號”的血統,但兩材料卻分別歸屬于第一類和第四類,追溯其系譜發現,盡管“豫棉17號”是從“中棉所8號”的復交后代群體中選育而成,但由于經過多代復交,其復交花粉來源于雜交后代,所以其遺傳基礎比較復雜,不能單從系譜來源來推斷其聚類結果,利用分子標記分析的是總DNA水平的差異,其聚類結果能更真實地反映品種間的遺傳差異。對58份種質材料的遺傳相似系數聚類分析結果基本上反映了品種之間的親緣關系。
品種選育過程是復雜的,育成品種的遺傳基礎不僅與選擇方法、目標性狀及生態環境因素有一定的關系,還與選用的親本有直接關系[29]。通過遺傳多樣性分析,可明確各材料間親緣關系的遠近,結合種質材料自身品質和產量性狀的優缺點進行優勢互補,為針對性的選擇雜交親本提供參考依據,對拓展棉花種質基礎、發掘和利用優異等位基因進行新品種培育具有重要意義。
4 結論
利用SSR分子標記方法,對58份棉花種質資源的純度與遺傳多樣性進行了檢測與分析,所測材料的純度概率介于20%-90%,且分子標記檢測結果與田間表型相吻合。SSR-PCR共擴增出85種多態性基因型,每個標記檢測到的基因型數在2-5,平均為3.27個,引物多態性信息量(PIC)介于0.0737-0.9281,平均為0.3639,在GS=0.63水平上,將供試材料分為5大類,系譜分析表明,這些品種資源的DNA聚類與其地理生態來源無關,而是與品種的親緣關系相關性較高,表明棉花種質資源遺傳的多樣性與復雜性。

