辛硫磷、滅多威和dsRNA飼喂對棉鈴蟲ace基因表達的影響
張亭 楊璇璇 雷勤 劉娟娟 李繼剛
(河北大學生命科學學院 河北省微生物多樣性與應用重點實驗室,保定 071002)
棉鈴蟲(Helicoverpa armigera)是農作物的重要害蟲,因其寄主范圍廣、繁殖潛能大、種群能遠距離遷移和對環境適應力強等特點,條件適宜時常大面積爆發成災,造成棉花、玉米、花生、豆類、蔬菜、花卉等的嚴重損失,其中以棉花遭受的損失最大,例如1992年在我國棉區的棉鈴蟲大爆發[1]。隨后,在我國出現了大量的關于棉鈴蟲殺蟲劑的研究[2-3]。其中,以辛硫磷為代表的有機磷農藥與以滅多威為代表的氨基甲酸酯類殺蟲劑被廣泛應用。
乙 酰 膽 堿 酯 酶(Acetylcholinestrase,AchE,EC3.1.1.7)能快速水解神經遞質乙酰膽堿(Acetylcholine,Ach)生成膽堿及乙酸,終止神經遞質乙酰膽堿對突觸后膜的興奮作用,保證神經信號在生物體內的正常傳遞[4]。AchE上有有機磷與氨基甲酸酯類化合物的作用位點,這兩類化合物與AchE結合后,會造成酶催化部位的磷酰化與氨基甲酰化,破壞了正常的神經傳導作用,生物長期處于神經興奮狀態,最終死亡[5]。
棉鈴蟲的AchE由ace1和ace2兩種基因編碼,ace1是AchE的主要編碼基因[6]。大量研究表明,昆蟲的抗藥性便與ace基因的過量表達有著密切關系[7-9],且ace基因在農藥壓力的選擇下發生著進化[10]。其中,Fournier 等[11]研究表明,果蠅種類的抗藥性與ace過量表達有關,而在有機磷農藥和氨基甲酸酯類殺蟲劑誘導的棉鈴蟲中,ace1與ace2所發揮的作用尚未見報道。
RNA 干 擾(RNA interference,RNAi) 是 指dsRNA進入細胞后使內源的mRNA發生特異性的降解,從而引起靶基因的沉默,使得其相應的功能及表型缺失。自從1998年首次在秀麗隱桿線蟲中發現注射dsRNA能夠引起基因沉默以來,dsRNA引起的RNA干擾廣泛應用于昆蟲學研究中[12]。2013年,Xiong等[13]喂食表達HaHR3 dsRNA的菌液或者轉基因葉片后,蟲子體內HaHR3 mRNA和蛋白水平急劇下降,從而導致發育畸形及幼蟲致死。喂食dsRNA可以引起昆蟲RNAi,為深入闡明昆蟲抗藥性機理和害蟲防控提供了新思路。
為此,本實驗采用實時定量PCR方法檢測辛硫磷、滅多威誘導和飼喂表達dsRNA的菌液后,棉鈴蟲幼蟲中ace1和ace2轉錄水平的變化,旨為進一步研究有機磷農藥、氨基甲酸酯類殺蟲劑在基因分子水平上對棉鈴蟲的AchE的作用機制和以AchE為靶標基因的RNAi效應提供參考。
1 材料與方法
1.1 材料
1.1.1 供試昆蟲 棉鈴蟲卵購買自河南科云生物公司,人工氣候箱進行孵化,其幼蟲為有機磷和氨基甲酸酯類殺蟲劑的敏感品系,孵化的幼蟲采用人工飼料(本實驗提供)飼養,溫度28±2℃,相對濕度65±5%,光周期16 L∶8 D。成蟲用10%蜂蜜水飼養。
1.1.2 主要試劑 辛硫磷購自Sigma公司;滅多威購自Aladdin公司;PrimeScriptTMRT reagent Kit with gDNA Eraser購自寶生物工程(大連)有限公司;TRIzon Reagent購自北京康為世紀生物科技有限公司;熒光PCR試劑FastStart Universal SYBR Green Master購自Roche公司;IPTG從自寶生物工程(大連)有限公司購買;引物由蘇州金唯智生物科技有限公司合成。
本實驗dsRNA的細菌表達采用L4440/HT115系統[14]。宿主菌 HT115(DE3 溶原菌)RNase III缺陷,可在IPTG誘導下,高效表達克隆于含兩個噬菌體T7啟動子的質粒上(L4440)的基因的dsRNA[14]。本實驗所用L4440已經過改造,使用Xcm I酶切后,3'端各突出一個“T”堿基,因此可方便地通過TA克隆技術將棉鈴蟲ace1(GenBank 檢索號DQ001323,取1109 bp的片段)和ace2基因序列(GenBank 檢索號AF369793,取500 bp的片段)各一個片段分別構建成dsRNA表達載體。
1.2 方法
1.2.1 實驗處理 殺蟲劑實驗組處理:供試棉鈴蟲飼養至4齡1 d時,取180條幼蟲分為3組,在滅多威處理組,每頭幼蟲點滴滅多威藥液0.1×7 μL(實驗組一),在辛硫磷處理組,每頭幼蟲點滴辛硫磷藥液0.3×10 μL(實驗組二),處理后的棉鈴蟲單獨放入玻璃管中,用人工飼料喂養,用清水作為對照組,之后移入培養箱中,分別在12 h、24 h、30 h、48 h、60 h取樣。重復3次。
RNAi實驗組處理:將含有雙鏈RNA表達載體的HT115菌,在含有100 μg/mL Amp LB 培養基中以37℃的溫度和220 r/min的轉速進行12 h的震蕩培養。得到的菌液按照1∶100的體積比接種到液體LB培養基中。當OD600= 0.6時,加入IPTG至終濃度為0.45 mmol/L,37℃過夜培養。取新鮮發酵液,經4℃,4000 r/min,離心15 min后棄上清液,加入新的LB制成10倍細菌濃縮液。將新鮮的飼料與100 μL濃縮細菌液攪拌均勻后備用。取180只二齡的棉鈴蟲,分為A、B、C三組,A組飼喂含有空菌的飼料,B組飼喂含有能夠表達ace1基因dsRNA菌液的飼料,C組飼喂能夠表達ace2基因dsRNA菌液的飼料。所有棉鈴蟲都放置在人工氣候箱內給予相同的生長環境。在飼喂的過程中每24 h更換加入菌液的飼料,取樣并拍照觀察幼蟲生長發育狀況。本實驗設3個生物學重復。
1.2.2 棉鈴蟲總RNA的提取及cDNA的制備 按照TRIzon Reagent試劑盒說明書方法,分別提取試驗組和對照組不同時間點幼蟲的總RNA,用紫外分光光度計測定其純度和濃度。用PrimeScriptTMRT reagent Kit with gDNA Eraser反轉錄試劑盒將提取的不同樣不同時間點的RNA分別反轉錄成cDNA,備用。
1.2.3 實時熒光定量PCR分析 采用Beacon Designer 8軟件,按照Real-time PCR要求設計ribosomal protein S3a(RPS3A) 內 參 基 因 和 ace1、ace2基因的引物(表1)。以合成的cDNA為模板,采用LigtCycler?PCR QC Kit試劑盒對各基因進行實時熒光定量PCR,具體步驟按照試劑盒說明書進行,反應體系為20 μL。反應程序為:95℃預變性3 min,95℃變性12 s,60℃退火40 s,72℃延伸12 s,40個循環。每個樣品重復3次。
1.2.4 數據處理 用LightCycler?96熒光PCR儀(Roche)所帶的 LightCycler?96 SW 1.1 軟件中讀取數據,使用2-△△Ct的方法[15]分析數據,使用SPSS 19.0軟件處理數據,采用GraphPad Prism 5軟件制作圖表。
2 結果
2.1 殺蟲劑處理后棉鈴蟲ace基因表達規律
采用RT-qPCR對殺蟲劑處理后的乙酰膽堿酯酶基因在不同時間點的表達量進行檢測。

表1 實時熒光定量PCR檢測基因和內參基因的引物
結果(圖1)顯示:滅多威處理后ace1基因表達量在12 h、24 h、48 h、60 h為顯著下調。辛硫磷處理后ace1基因表達量在12 h、24 h、48 h顯著下調,在60 h上調。從整體趨勢上分析,滅多威處理后ace1基因表達量的變化是下調,辛硫磷處理后棉鈴蟲ace1基因表達量的變化是先下調后上調。

圖1 殺蟲劑處理后棉鈴蟲ace1基因表達規律
滅多威處理后ace2基因表達量在12 h顯著下調,在24 h、36 h、60 h顯著上調。辛硫磷處理后ace2基因表達量在12 h、24 h顯著下調,在48 h、60 h顯著上調。從整體趨勢上分析,滅多威處理后棉鈴蟲ace2基因表達量的變化是先下調后上調,辛硫磷處理后ace2基因表達量的變化是先下調后上調(圖 2)。
2.2 殺蟲劑處理后棉鈴蟲的形態變化
取四齡的棉鈴蟲分為3組,A組為清水對照組,B組為滅多威處理組,C組為辛硫磷處理組。在殺蟲劑處理后12 h、24 h和36 h皆出現棉鈴蟲嚴重蜷縮的現象。同時與A組相比,B組和C組化蛹更早,但從蛹到蛾的時間更長,羽化的失敗率更高,且出現多種形態的畸形(圖3)。

圖2 殺蟲劑處理后棉鈴蟲ace2基因表達規律

圖3 殺蟲劑處理前后棉鈴蟲表型變化
2.3 喂食表達dsRNA的細菌液后棉鈴蟲ace基因表達規律
對棉鈴蟲喂食表達ace1基因dsRNA的細菌液后,棉鈴蟲ace1基因表達量在24 h、48 h下調明顯,在72 h、96 h有不明顯上調(圖4)。對棉鈴蟲喂食表達ace2基因dsRNA的細菌液后,棉鈴蟲ace2基因表達量在24 h、48 h下調明顯,在72 h出現上調,在96 h下調(圖5)。從整體趨勢上分析,在對棉鈴蟲進行ace基因dsRNA處理后,ace基因表達量變化下調。
2.4 喂食表達dsRNA的細菌液后棉鈴蟲的形態變化
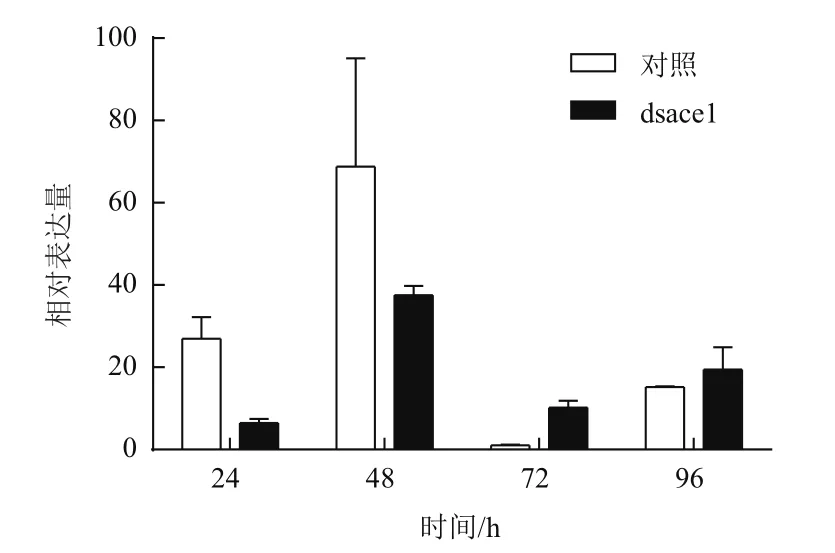
圖4 飼喂表達ace1基因dsRNA細菌液后,棉鈴蟲ace1基因的表達規律

圖5 飼喂表達ace2基因dsRNA細菌液后,棉鈴蟲ace2基因的表達規律
A組喂食空菌,B組喂食表達ace1基因dsRNA細菌液,C組喂食表達ace2基因dsRNA細菌液。喂食第2天后發現(圖6),與A組比較,B組和C組的棉鈴蟲在死亡的同時其成長也出現滯后現象。喂食第4天后發現,A組的棉鈴蟲大小與體重差別細微,而B組和C組的棉鈴蟲在死亡的同時其大小和體重有了很大的差別。
3 討論
本研究結果顯示,辛硫磷和滅多威進行誘導后,棉鈴蟲在12 h時,ace1和ace2皆顯著下調,這可能是棉鈴蟲幼蟲生理代謝水平被破壞導致的。辛硫磷誘導48 h時,ace1顯著下調;ace2顯著上調。滅多威誘導;24 h、48 h、60 h,ace1顯著下調;24 h、36 h、60 h,ace2顯著上調。總體來看,當農藥處理滿足一定的時間后,ace1表達量降低的時候ace2的表達量增加,推測棉鈴蟲的成活與ace2的過量表達有關。

圖6 飼喂表達ace基因dsRNA的細菌液后,棉鈴蟲的表型變化
大量研究結果表明,ace1是AchE的主要的編碼基因[16-19],而在有些昆蟲中ace2比ace1更豐富,AchE2是AchE的主要酶型[20-21]。經過辛硫磷與滅多威誘導后,從整體水平上分析,ace1基因表達量仍比ace2基因表達量多,從ace基因表達量的變化來說,與對照組相比,ace1基因表達量減少,ace2基因表達量增加。從上可推測,兩種農藥誘導棉鈴蟲后,AchE1仍是AchE的主要酶型,在AchE1的含量不足以支撐棉鈴蟲的正常生理活性后,AchE2的酶活力增加以滿足棉鈴蟲的生理需求。
對棉鈴蟲進行ace基因dsRNA處理后,棉鈴蟲在死亡的同時也出現了不同程度的生長滯后現象。通過RT-qPCR技術發現ace基因表達量受到抑制,這說明ace基因可以作為研究RNAi技術防治棉鈴蟲的靶基因。但是ace1基因和ace2基因在后面的時間點里出現了上調的現象,推測棉鈴蟲被喂食表達dsRNA菌液的飼料后,體內mRNA被降解,棉鈴蟲在生長過程中為適應環境,其體內的ace基因過量表達來彌補被降解的mRNA。因此,在使用ace基因作為RNAi技術靶基因的時候,要慎重考慮棉鈴蟲的抗性問題。鑒于植物介導的昆蟲RNAi已經成為害蟲防治基因過程的一個重要思路[22-23],本研究可為在基因水平上研究有機磷農藥、氨基甲酸酯類殺蟲劑對棉鈴蟲的ace基因的作用機制、以及以ace基因為靶標的抗蟲研究提供參考。
4 結論
通過辛硫磷、滅多威誘導、dsRNA表達菌處理棉鈴蟲幼蟲,可以造成ace1和ace2轉錄水平發生顯著變化。用滅多威、辛硫磷處理后,ace1和ace2表達水平先出現顯著下調,其后,ace1繼續下調而ace2上調;通過飼喂dsRNA表達菌進行RNAi處理,可使棉鈴蟲ace1、ace2基因表達量明顯下調(24 h、48 h),從而抑制靶標基因表達。

