防旋髓內釘與動力髖螺釘治療股骨轉子間骨折療效的對比研究
向 登,林炎水
髖關節在遭受外力的打擊下,其小粗隆至股骨頸基底部常易發生骨折,即股骨轉子間骨折[1]。資料顯示,股骨轉子間骨折不但導致股骨喪失承重、運動等功能,因骨折引發的血管損傷還易導致骨折不愈合或壞死[2]。在股骨轉子間骨折的治療上,除存在手術禁忌證患者,臨床多行內固定治療[3]。防旋髓內釘(PFNA)及動力髖螺釘(DHS)是臨床治療股骨轉子間骨折的重要術式,為研究兩種術式的臨床療效,筆者回顧性分析成都醫學院第一附屬醫院骨科2013年1月—2015年12月行PFNA和DHS治療的156例股骨轉子間骨折患者,報告如下。
臨床資料
1 一般資料
納入成都醫學院第一附屬醫院2013年1月—2015年12月收治的股骨轉子間骨折患者156例,依據治療方法分為PFNA組(n=78)與DHS組(n=78),其中男性88例, 女性68例;年齡41~72歲,平均54.63歲。致傷原因:跌倒傷73例,道路交通傷62例,墜落傷14例,打擊傷7例。納入標準:經影像學檢查確診為股骨轉子間骨折患者;美國麻醉醫師協會(ASA)分級I~III級患者;閉合性、新鮮股骨轉子間骨折患者;手術可耐受患者;知情同意患者。排除標準:病理性股骨轉子間骨折患者;髖關節既往病史患者;股骨頸骨折患者;凝血功能異常患者;依從性差患者;肝腎等功能異常患者。兩組患者一般資料差異無統計學意義(P<0.05)。見表1。本研究獲本院倫理委員會批準,所有患者簽署知情同意書。

表1 兩組患者一般資料
2 方法
2.1DHS組 患者硬膜外麻醉或全麻,于大轉子頂點外側作切口,骨折部位徹底暴露,先行骨折復位,然后行內固定,若患者為粉碎性骨折,則先以克氏針臨時固定。按角規方向于大轉子頂點下2cm置入導針,C型臂機下觀察復位及固定情況,并按照復位及固定情況對組合鉆長度進行調整,鉆入加壓螺釘,將DHS鋼板置入,放置引流管后將切口關閉,術后常規處理。
2.2PFNA組 患者硬膜外麻醉或全麻,C型臂機下于骨科牽引床牽引復位,于大轉子頂點位作切口,將導針于大轉子頂部插入,于C型臂機下觀察導針,確認其位于髓腔內恰當位置,轉子部擴髓后將髓釘緩緩插入,避免發生醫源性骨折或骨折移位。C型臂機下觀察髓釘插入位置,將導針鉆入股骨頭頸內,至其關節軟骨面之下約5mm,評價導針位置,將股骨外側皮質鉆開,經髓腔擊入拉力螺釘并鎖定,按照骨折類型選取遠端固定螺釘,將尾帽擰入后放置引流管將切口關閉,術后常規處理。
3 觀察指標
觀察兩組術中出血量、切口長度、手術時間、下床時間、引流量、骨折愈合時間等手術相關指標;術前及術后7d血清白細胞介素-6(IL-6)、白細胞介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)、白細胞介素-18(IL-18)等炎性因子水平;術前、術后7d 5-羥色胺(5-HT)、P物質(SP)、多巴胺(DA)、前列腺素E2(PGE2)、去甲腎上腺素(NE)等疼痛因子水平;術后1、6、12個月髖關節功能及術后并發癥。以ELISA法檢測IL-6、IL-1β、TNF-α、IL-18;以熒光分光光度法檢測5-HT、SP、DA、PGE2、NE;依據Harris髖關節功能評分量表[4]評價髖關節功能。
4 統計學分析
結 果
1 兩組手術相關指標比較
PFNA組術中出血量、切口長度、手術時間、下床時間均低于DHS組,引流量、骨折愈合時間高于DHS組,差異有統計學意義(P<0.05)。見表2。
2 兩組炎性因子及疼痛因子比較
術前,兩組IL-6、IL-1β、TNF-α、IL-18,5-HT、SP、DA、PGE2、NE差異無統計學意義(P>0.05);術后7d,兩組IL-6、IL-1β、TNF-α、IL-18,5-HT、SP、DA、PGE2、NE均較術前降低,差異有統計學意義(P<0.05);術后7d,PFNA組IL-6、IL-1β、TNF-α、IL-18,5-HT、SP、DA、PGE2、NE低于DHS組,差異有統計學意義(P<0.05)。見表3。
3 兩組術后1、6、12個月Harris評分比較
PFNA組術后1、6、12個月Harris評分均高于DHS組,差異有統計學意義(P<0.05)。見表4。
4 兩組術后并發癥比較
PFNA組術后發生畸形愈合1例(1.28%),深靜脈血栓1例(1.28%),并發癥發生率為2.56%;DHS組術后發生感染3例(3.85%),畸形愈合4例(5.13%),內固定斷裂1例(1.28%),深靜脈血栓2例(2.56%),并發癥發生率為12.82%。兩組并發癥發生率比較差異有統計學意義(χ2=5.9736,P=0.0145)。
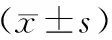
表2 兩組手術相關指標比較
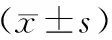
表3 兩組炎性因子及疼痛因子比較
與術后比較:*P<0.05

表4 兩組術后1、6、12個月Harris評分比較(分,
討 論
手術可促進股骨轉子間骨折患者早期功能康復,降低并發癥發生率[5]。DHS為髓外固定的重要術式,其特點主要是在套筒內可使拉力螺釘滑移至外下方,通過滑動加壓促進骨折斷端接觸、嵌插,從而促進骨折愈合。此外,DHS較符合人體髖部生物力學,有利于恢復股骨的承重、運動功能[6]。資料顯示[7],盡管DHS治療股骨轉子間骨折具有一定價值,但因附著在股骨負重線的外側面,若內側皮質骨出現缺失,可引發應力集中,從而導致螺釘松動、螺釘切割、髖內翻畸形,嚴重者甚至可導致鋼板斷裂等不良現象。研究發現[8],由于DHS的滑動致使其在旋轉、橫向、軸向的不穩定。此外,DHS抗旋轉作用相對較弱,故DHS適用于穩定型轉子間骨折,而不適用于不穩定型轉子間骨折[9]。PFNA是髓內固定的重要術式,股骨干中軸為其受力點,對內側皮質是否重建或缺失無嚴格要求[10]。PFNA內固定力臂相對較短,尤為符合髖部生物力學,抗拉、抗壓能力明顯提升[11]。PFNA的釘道具有較小的橫截面積,可有效降低骨損傷,遠端螺釘既能夠選擇動態固定,又能夠選擇靜態固定,還可以選擇動態、靜態聯合固定,較適合不同類型股骨轉子間骨折的固定[12]。此外,PFNA可有效降低骨折部位循環系統損傷,有利于術后關節功能恢復[13]。在本研究中,PFNA組各手術相關指標,術后1、6、12個月Harris評分及術后并發癥發生率均優于DHS組,提示與DHS相比較,PFNA治療股骨轉子間骨折具有創傷小、術后恢復快、并發癥少等優勢。
疼痛是股骨轉子間骨折術后較為強烈的應激反應,可刺激機體釋放大量炎性因子,炎性因子可促進分泌致痛因子,加劇患者疼痛,二者相互作用,導致惡性循環,不但給患者帶來較大的痛苦,且影響患者預后[14]。研究證明,骨折、手術創傷可導致疼痛因子及炎性因子生成,且骨折越嚴重,手術創傷越大,疼痛因子及炎性因子生成越多,患者疼痛程度越高[15]。5-HT、SP、DA、PGE2、NE均為機體重要的致痛因子,是引發疼痛并促進其加劇的重要因素。5-HT、DA、NE可直接引發疼痛。5-HT、DA、NE可經第二信使刺激感覺神經元產生痛覺[16]。SP為傷害性刺激肽,廣泛存在于外周神經與中樞,具有致痛及傳遞疼痛信息的作用[17]。PGE2可促進部分代謝活動,提高神經纖維的敏感性,降低感覺閾值,使局部神經纖維處于痛覺敏感狀態。PGE2還可延長、增強5-HT的致痛作用[18]。IL-1β、IL-6、TNF-α為常見炎性因子,IL-1β可提高磷脂酶A2活性,促進生成炎性遞質前列腺素E2,提高感受器敏感性,降低感覺閾值,導致組織痛敏,延長多種致痛因子的致痛作用,加劇疼痛并延長疼痛時間[19]。IL-6為炎性反應促進劑,能夠提高炎性因子活性,促進釋放炎性介質,引發局部炎性反應,導致疼痛。TNF-α不但可導致致痛因子生成,還可引發神經內膜水腫及神經元損傷,且具有神經毒性,可誘發并參與疼痛[20]。研究證明,多種炎性因子協同作用可促進生成致痛因子,導致并加劇疼痛反應[21]。本研究中,PFNA組術后炎性因子、致痛因子均低于DHS組,說明與DHS相比較,PFNA創傷相對較小,可減輕炎性反應,降低致痛因子水平,緩解患者疼痛。
總之,PFNA治療股骨轉子間骨折可減少患者創傷,降低炎性反應,減少患者疼痛,術后恢復快,并發癥發生率低,值得臨床應用。

