肝細胞親和色譜法體外篩選大黃降脂活性成分研究*
陳藝丹,周 律,王妮華,范 輝,2**,郭 姣
(1.廣東藥科大學中醫藥研究院,國家中醫藥管理局高脂血癥“調肝降脂”重點研究室/脂代謝三級實驗室,廣東省代謝性疾病中醫藥防治重點實驗室 廣州 510006;2.廣東藥科大學藥學院 廣州 510006)
大黃(Rheum officinale Baill.)為蓼科植物大黃的干燥根或者根莖,其歸脾、胃、大腸、肝、心包經,功能主治瀉下攻積,清熱瀉火,涼血解毒,逐瘀通經,利濕退黃[1]。現代研究表明,大黃有抗菌、抗腫瘤、抗高脂血癥、降低血壓、健胃、利膽、保肝、強心、消炎、調節免疫等作用[2]。
據研究[3],大黃中蒽醌類成分主要有蘆薈大黃素、大黃酚、大黃素、大黃素甲醚和大黃酸(圖1)。王志旺等[4]對不同產地大黃的降脂藥效進行研究,均可不同程度地改善高脂血癥大鼠血脂代謝、降低血液粘稠度
圖1 大黃中蒽醌類化合物Fig.1 rhubarb anthraquinones
并提高抗氧化作用。其中大黃酸具有抗氧化、保護肝細胞、調節糖脂代謝等多種藥理活性,并且在治療糖尿病腎病等疾病及協同抗腫瘤方面表現突出,成為研究的熱點[5,6]。研究發現[7],大黃酸改善脂肪肝疾病可以進行負能量平衡和肝脂肪生成的調節,這一發現拓展了大黃酸的藥理作用。本課題聯合體外肝細胞脂肪變性模型和親和色譜法,以大黃提取液為研究對象,篩選大黃蒽醌類調脂活性成分,尋找大黃酸降脂的科學證據。
1 材料
1.1 主要儀器
Waters Alliance2695高效液相色譜儀,Waters2998二極管陣列檢測器,Empower色譜數據處理系統,色譜柱:DIONEX Acclaim120(5 μm,4.6×250 mm);Agilent 1290 InfinityⅡ液相系統聯用Agilent 6545 QTOF-MS液質聯用儀,色譜柱:ACQUITY UPLC BEH C18色譜柱(2.1×150 mm,1.7 μm);SW-CF-1FD超凈臺(上海博迅實業有限公司醫療設備廠);CO2培養箱(美國Thermo Scientific公司);倒置顯微鏡(日本Olympus公司);Mithras LB 940酶聯免疫檢測儀(德國Berthold Technologies公司);5180R低溫高速離心機(德國Eppendorf公司);0.22 μm溶劑過濾器(北京津騰儀器廠);杯式超聲波細胞粉碎機(寧波新芝生物股份有限公司,Scientz98);HGC-24A氮吹儀(天津市恒奧科技發展有限公司);KQ5200E型臺式機械超聲波清洗器(東莞市科橋超聲波設備有限公司);PURELAB Ultra GE MK2純水儀(ELGA,High Wycombe,UK);BT224s型萬分之一電子天平(北京賽多利斯科學儀器有限公司)。
1.2 藥物與試劑
大黃(批號160101)購自于廣州市誠濟藥業有限公司;蘆薈大黃素對照品(批號X0550050)、大黃酸對照品(批號G1110010)、大黃素對照品(批號G1270010)、大黃酚對照品(批號F1390025)、大黃素甲醚對照品(批號H5310010)均購自于上海安譜科學儀器有限公司;DMSO購自于美國Sigma公司;色譜純甲醇(美國Honeywell公司&德國Merck公司);實驗用水為超純水;其余試劑為分析純,購自于天津市科密歐化學試劑有限公司。
高糖DMEM培養基購自于美國GIBCO公司(批號129007);胰酶購自于北京鼎國昌盛生物技術有限公司(批號89010440);血清購自于賽默飛世爾;油酸鈉、棕櫚酸鈉購自于美國Sigma公司;三酰甘油(TG)試劑盒購自于南京建成生物工程有限公司;BCA蛋白測定試劑盒購自于北京康為世紀生物科技有限公司。
2 實驗方法
2.1 對照品、供試品溶液的制備
2.1.1 對照品溶液配制
取蘆薈大黃素、大黃酸、大黃素、大黃酚、大黃素甲醚對照品適量,精密稱定,加DMSO溶解并用甲醇稀釋定容至1.0 mL,搖勻,作為對照品貯備液。
2.1.2 供試品溶液配制
稱取大黃粉末(過四號篩)適量,精密稱定,置具塞錐形瓶中,精密加入適量甲醇,稱定重量,加熱回流1 h,放冷,在稱定重量,用甲醇補足減失的重量,搖勻,濾過。精密量取續濾液,置燒瓶中,揮去溶劑,加8%鹽酸溶液適量,超聲處理2 min,再加適量三氯甲烷,加熱回流1 h,放冷,置分液漏斗中,分取三氯甲烷,酸液再用三氯甲烷提取3次,合并三氯甲烷液,減壓回收溶劑至干,殘渣加甲醇使溶解,轉移10 mL量瓶中,加甲醇至刻度,搖勻,濾過,取續濾液,即得[1]。
2.2 HepG2細胞培養
采用含10%FBS的DEME培養液,將HepG2人肝癌細胞株放置于37℃、5%CO2、飽和濕度培養箱內培養,待細胞生長至約80%,用0.25%胰酶消化細胞,進行傳代,每2-3天傳代一次。
2.3 大黃蒽醌類成分降脂活性試驗
調整HepG2細胞懸液濃度,以每孔2×105的細胞個數接種于6孔板,正常培養48 h,當細胞達到對數生長期,分組給藥:正常對照組給予含10%FBS的完全培養基、模型組給予0.5 mmol·L-1FFA培養基(油酸鈉/棕櫚酸鈉,2:1,0.5 mmol·L-1)、給藥組給予含不同濃度大黃(25.0,50.0,100.0 μg·mL-1)以及不同濃度蘆薈大黃素、大黃酸、大黃素、大黃酚、大黃素甲醚(1.0,5.0,25.0 μg·mL-1)的0.5 mmol·L-1FFA培養基,每組做6個平行孔。
24 h后,吸棄孔內培養液,PBS洗滌1-2遍,胰酶消化制成細胞懸液,將各孔細胞懸液平均分成兩份(細胞A和細胞B),4℃ PBS洗滌細胞兩次,4℃,1 000 r/min離心5 min,棄上清,細胞A管加入100 μL異丙醇,細胞B管中加入100 μLPBS,超聲波細胞粉碎機裂解細胞,再以4℃,1 3500 r/min離心10 min,收集A和B管上清液,用三酰甘油(TG)試劑盒測定細胞A管上清中TG含量,用BCA蛋白定量試劑盒測定細胞B管中蛋白含量,換算成TG/蛋白含量的比值。
2.4 高效液相色譜法
2.4.1 色譜條件
色譜柱:DIONEX Acclaim120(5 μm,4.6×250 mm)用十八烷基硅烷鍵合硅膠為填充劑;流動相:甲醇-0.1%磷酸溶液(85∶15),等度洗脫;流速:1.0 mL·min-1;檢測波長:254 nm;柱溫:30℃;進樣量:10 μL;理論塔板數按大黃素峰計算不低于3000;在此色譜條件下大黃蒽醌類中各成分可以完全分離。
2.5 液質聯用LC-Q-TOF-MS法
2.5.1 色譜條件
ACQUITY UPLC BEH C18色譜柱(2.1x150 mm,1.7 μm),流動相0.1%甲酸水(A)-甲醇(B),梯度洗脫(0 min,40%B;0~3 min,40%~100%B;3~5 min,100%B;5~5.1 min,100%~40%B;5.1~8 min,40%B),流速0.3 mL·min-1,柱溫30℃,進樣量2 μL。
2.5.2 質譜條件
Agilent 6545 LC-Q-TOF-MS液質分析系統,ESI離子源,負離子模式,全掃描一級和二級質譜,質譜掃描質量范圍為100-1500 m/z,霧化氣壓力35 psi,干燥氣流速8 L·min-1,干燥氣溫度320℃,毛細管電壓3 500 V。
2.6 大黃蒽醌類與HepG2肝癌細胞株特異性結合試驗
取對數生長期細胞(即將長滿)6皿,PBS液洗滌2遍,除去細胞代謝物;3皿加入不含藥DMEM培養液作為空白對照,另3皿加入100 μg·mL-1大黃蒽醌類溶液,8 mL/皿,37℃,CO2培養箱孵育24 h。24 h后,細胞形態良好,收集上清液,過0.22 μm濾膜,按2.4項下色譜條件進行HPLC分析,PBS液洗滌2遍,胰蛋白酶消化,收集細胞。
用5 mLPBS液/次洗滌細胞,離心1 000 r/min×5 min,共洗滌5次,留末次洗滌液,過0.22 μm濾膜,所得濾液按2.4項下色譜條件進行分析。
將收集得到的細胞轉移至1.5 mL離心管中,加入1 mL75%乙醇吹打均勻,超聲波細胞粉碎機裂解細胞,高速離心(10 000 r/min×l0 min),取上清液,氮氣吹干,0.5 mL甲醇復溶,高速離心(10 000 r/min×l0 min),取上清液,按2.4項下色譜條件進行HPLC分析。
2.7 大黃酸、大黃素對照品與HepG2肝癌細胞株特異性結合試驗
空白組、100 μM大黃酸組和100 μM大黃素組,各平行3份,按2.6項進行特異性結合試驗,按2.5項下條件進行液質分析。
3 實驗結果
3.1 大黃蒽醌類成分降脂活性驗證試驗
不同濃度的大黃提取液(12.5,25.0,50.0,100.0 μg·mL-1),不同濃度蘆薈大黃素、大黃酸、大黃素、大黃酚、大黃素甲醚(0.2,1.0,5.0,25.0 μg·mL-1)與FFA共同作用于HepG2細胞24 h。在不同濃度范圍內,細胞內TG含量隨濃度的增加呈劑量依賴性減少,與模型組比較,各給藥組均有顯著性差異(P<0.05)(圖2),且呈劑量依賴性,具有統計學意義。
3.1 大黃蒽醌類成分與HepG2細胞株的特異性結合的HPLC分析
采用HPLC法分別分析大黃原液、大黃加藥培養基、大黃作用后的HepG2細胞提取液、最后一次洗脫液和空白對照,在254 nm檢測波長處,通過比較大黃作用細胞提取液和大黃原液,發現細胞提取液中大黃與細胞特異性結合成分主要有4個,分別為蘆薈大黃素、大黃素、大黃酚、大黃素甲醚四個化合物,而大黃酸未檢測到。在254 nm檢測波長下,空白對照和最后一次洗脫液并無響應,證明方法專屬性較好,在最后一次洗滌細胞的洗脫液中已無任何可積分成分,說明已排除非特異性結合成分的影響(圖3)。
3.2 大黃酸和大黃素成分與HepG2細胞株的特異性結合的液質分析
采用液質聯用方法分析大黃酸和大黃素成分與HepG2細胞株的特異性結合,大黃酸和大黃素的檢測離子對分別是283.0/239.0,269.0/225.0 m/z(圖4B、圖4C)。通過LC-MS全掃描分析大黃酸和大黃素的對照品、細胞上清以及細胞提取液,發現大黃素細胞給藥后的細胞提取液中含有大黃素,而大黃酸細胞給藥后細胞提取液中沒有大黃酸,但發現含有269.0 m/z的碎片離子(圖4A),與標準品比較,發現不是大黃素,可能是蘆薈大黃素。
4 討論
本研究采用HepG2細胞系,以游離脂肪酸(油酸鈉/棕櫚酸鈉,2∶1,0.5 mmol·L-1)誘導肝細胞脂肪變性模型評價大黃五種蒽醌類成分的降脂效應[8]。模型組三酰甘油含量較正常組的高5倍,成功建立體外肝細胞脂肪變性模型。大黃及五種蒽醌類成分均具有顯著體外降脂活性,與文獻報道一致[9-11]。

圖2 大黃提取液(A)、蘆薈大黃素(B)、大黃酸(C)、大黃素(D)、大黃酚(E)和大黃素甲醚(F)對肝細胞三酰甘油蓄積的影響Fig.2 The effect of rhubarb(A),aloe-emodin(B),rhein(C),emodin(D),chrysophanol(E)and physcion(F)on TG accumulation in HepG2 cells
本實驗室已建立肝細胞親和色譜法用于篩選肝細胞為靶細胞的調脂中藥藥效物質基礎[8,12],利用該模型對大黃蒽醌類成分進行親和篩選。結果表明,與大黃原液、標準品保留時間和光譜特征比較,細胞親和液中檢測到四種肝細胞特異性親和成分,分別為蘆薈大黃素、大黃素、大黃酚、大黃素甲醚,未檢測出大黃酸。因大黃酸體外降脂活性顯著,分析大黃酸的降脂途徑可能與其他蒽醌類成分不同。
為了觀察大黃酸的體外細胞作用特點,采用高靈敏度和高分辨率的LC-Q-TOF-MS進行分析,以大黃酸和大黃素標準品細胞給藥后分別驗證,液質中檢測離子對分別是大黃酸283.0/239.0和大黃素的269.0/225.0 m/z,結果發現大黃素標準品細胞親和液中能檢測到大黃素(269.0/225.0 m/z),表明大黃素可能是原型形式與細胞親和。而大黃酸標準品細胞親和液中大黃酸(283.0/239.0 m/z)仍未檢出。但檢測到離子碎片(269.0 m/z),因為離子碎片(269.0 m/z)與大黃素和蘆薈大黃素一致,通過與大黃素標準品和蘆薈大黃素標準品保留時間比較,判斷不是大黃素,可能為蘆薈大黃素(圖4A)。另外,根據結構比對,大黃酸與蘆薈大黃素均為蒽醌母核上3位取代基分別為-COOH和-CH2OH,而大黃素為6位甲基取代,3位OH取代(圖1)。綜上化學結構推測和實驗結果分析,大黃酸可能存在體外細胞代謝,經Ⅰ相還原反應轉化成蘆薈大黃素。
圖3 大黃蒽醌類成分與HepG2細胞特異性結合HPLC圖Fig.3 Chromatograms of rhubarb anthraquinones treated with HepG2 cells
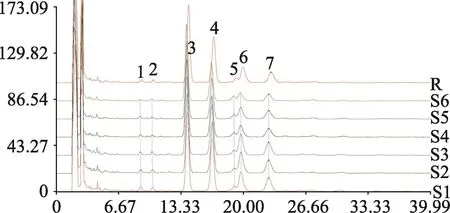
圖4 大黃素和大黃酸LC-MS圖Fig.4 Chromatograms of emodin and rhein
目前報道的大黃酸的代謝途徑及產物主要是葡萄糖醛酸化,硫酸酯化,甲基化。我們首次在細胞層面發現大黃酸可能具有細胞內轉化為蘆薈大黃素的細胞親和代謝行為。大黃酸單體細胞給藥24 h后肝細胞親和液中未檢測到大黃酸,但具有顯著體外降脂效應,可能的原因是大黃酸轉化為蘆薈大黃素繼續發揮著降脂效應。
總之,本研究通過肝細胞脂肪變性模型聯合肝細胞親和色譜法篩選和評價大黃蒽醌類肝細胞降脂活性成分,發現蘆薈大黃素、大黃素、大黃酚、大黃素甲醚以原型的形式體外肝細胞降脂,而大黃酸可能以體外細胞代謝為蘆薈大黃素形式降脂,本研究為中藥活性成分篩選提供思路,為大黃蒽醌類調脂藥物開發提供證據。

