CDCA8基因表達與膀胱癌患者臨床病理和預后的相關性
畢婭瓊,陳 松,蔣佳志,石宏杰,李 勝,4
膀胱癌是泌尿外科常見的惡性腫瘤之一,易復發且預后較差,臨床上患者的TNM分期不同,預后就有很大差別,在TNM分期中,T分期是衡量腫瘤體積大小的重要指標,而腫瘤的大小與腫瘤細胞的增殖分裂能力有密切聯系[1],若阻斷細胞生長合成的任一周期,細胞的增殖將被抑制,腫瘤的生長將受到阻滯[2]。腫瘤一般都具有過度生長增殖及突變的特點,而使多種癌基因激活和抑癌基因失活[3]。研究還發現,細胞周期相關基因及物質代謝相關基因的異常表達可能會導致腫瘤的發生[4]。染色體過客復合物(chromosomal passenger complex, CPC)是細胞增殖分裂中的重要結構,由四種成分構成:INCENP、Survivin、Aurora B、Borealin/DasraB。CPC組分蛋白的過表達可使CPC功能紊亂,引起細胞分裂異常、非整倍體形成,從而加速腫瘤的發生與發展[5,6]。人類細胞分裂周期相關基因8(cell division cycle associated 8, CDCA8)編碼的蛋白稱為Borealin/DasraB,CDCA8是一個細胞周期調節基因,它在定位CPC到著絲粒、糾正動粒結合錯誤、穩定雙極紡錘體等方面發揮重要作用[7]。對CDCA8基因的表達分析結果顯示,其在腫瘤細胞和未分化的人類胚胎干細胞(human embryonic stem cells, hESCs)中高表達,在正常細胞中無表達或有微弱表達[8-10]。CPC的組成成分Survivin和Aurora B在多種腫瘤中高表達,而CPC的另外兩個成分CDCA8和INCENP在腫瘤中的表達情況研究還相對較少[11]。本研究旨在探究CDCA8在膀胱癌中的表達情況和CDCA8與膀胱癌的臨床病理相關性及預后相關性,并使用基因集富集分析(gene set enrichment analysis, GSEA),預測CDCA8在膀胱癌中調控的信號通路,為進一步研究其在腫瘤發生發展中的作用機制及可否作為治療靶點提供線索和思路。
1 資料與方法
1.1 數據資料來源 從NCBI的GEO數據庫(http://www.ncbi.nlm.nih.gov/geo)中下載GSE13507(非配對樣本,膀胱癌組織165例)[12,13]基因表達矩陣。在GSE13507中,CDCA8基因對應的探針為ILMN_1709294。
1.2 臨床相關性研究方法 根據CDCA8在該數據集中表達水平的中位數,將膀胱癌患者分為CDCA8高表達組和低表達組,分析兩組中CDCA8與膀胱癌的臨床病理相關性。
1.3 基因集富集分析 首先將腫瘤組織樣本根據CDCA8表達水平分為高、低表達兩組,再通過GSEA富集分析研究CDCA8的表達水平影響的生物通路基因集。采用GSEA3.0版本進行分析。從GSEA網站MsigDB數據庫中獲得的基因集“h.all.v6.0.symbols.gmt”作為參照基因集,置換次數為1000次。通過GSEA,分析CDCA8表達水平影響的生物通路基因集,初步探究CDCA8對膀胱癌患者可能的作用機制。
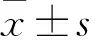
2 結 果
2.1 CDCA8的表達情況 正常膀胱組織中CDCA8的表達(7.47±0.07)明顯低于膀胱癌組織(8.87±0.08),差異有統計學意義(P<0.0001)。
2.2 CDA8與膀胱癌的臨床病理相關性 在膀胱癌樣本數據集GSE13507中,CDCA8高表達與膀胱癌患者的年齡、性別,膀胱癌的疾病進展、T分期、N分期、不同分級密切相關(表1)。

表1 CDCA8基因表達與膀胱癌患者的臨床病理相關性(GSE13507) (n;%)
注:*CDCA8基因高表達組有1例缺失數據
2.3 CDCA8與膀胱癌患者的預后相關性 在膀胱癌樣本數據集GSE13507中,CDCA8高表達組膀胱癌患者的腫瘤特異性生存期明顯短于CDCA8低表達組(HR=0.5177, 95%CI: 13.40~18.10,P<0.0001,圖1A),且CDCA8高表達組膀胱癌患者的總生存期亦低于CDCA8低表達組(HR=0.09906, 95%CI: 5.971~16.38,P<0.0001,圖1B)。

圖1 CDCA8表達水平與膀胱癌患者預后的關系
2.4 CDCA8高表達的基因集富集分析(GSEA) CDCA8高表達的腫瘤樣本富集了與精子形成、G2M檢查點、E2F信號通路、未折疊蛋白反應、MYC信號通路、MTORC1信號通路、有絲分裂紡錘體形成、PI3K/AKT/mTOR通路、膽固醇平衡、糖酵解有關的基因(表2),說明CDCA8可能通過調節膀胱癌患者的以上生物學過程或通路等方式,進而影響膀胱癌的發生及發展。

表2 CDCA8高表達的膀胱癌樣本富集的基因集(GSE13507)
注:MSigDB基因集“h.all.v6.0.symbols.gmt”被使用作為參照基因集
3 討 論
膀胱癌作為泌尿系統最常見的腫瘤之一,其復發率較高,這與腫瘤細胞的增殖能力密切相關。膀胱癌細胞的增殖能力越強,則手術后越容易復發,復發次數增多,膀胱癌的惡性程度也增高[14]。CPC在細胞分裂中的調控是基本的調控器,CPC在精確調控細胞及細胞核的正常分離和分裂起重要作用,因此重要的抗癌藥物開發工作集中在CPC上[15]。CDCA8是CPC的組成成分之一,是Walker[16]在分析與已知的細胞周期基因共表達的基因時首先發現的,在細胞增殖及調控中CDCA8均發揮重要作用。CDCA8編碼的蛋白為Borealin/DasraB,其在胚胎干細胞中高表達,可能與干細胞維持全能性相關。研究發現CDCA8在胚胎干細胞、腫瘤細胞中轉錄活性增強,當敲除CDCA8基因后可抑制人類胚胎干細胞、結腸癌及肺癌細胞的增殖[17-19]。在胃癌、結腸癌及肺癌中CDCA8的高表達提示腫瘤預后風險不佳[20-24]。但CDCA8在膀胱癌中的表達及其作用機制國內研究相對較少,本研究利用GEO公共數據庫,研究CDCA8在膀胱癌中的表達水平及其病理相關性、預后相關性和其可能調控的生物學通路,為進一步探討研究其在膀胱癌中作用機制提供依據及思路。
本研究結果提示,CDCA8在膀胱癌組織中的表達水平明顯高于正常組織中的表達水平,表明CDCA8的高表達與膀胱癌的發生發展有關;CDCA8高表達組與膀胱癌患者的年齡、性別、疾病進展、T分期、N分期及分級明顯相關,說明CDCA8與膀胱癌的惡性程度密切相關;生存分析提示CDCA8高表達膀胱癌患者的腫瘤特異性生存期和總生存期明顯低于CDCA8低表達組的膀胱癌患者,說明CDCA8高表達可影響膀胱癌患者的生存期,與患者的復發與術后早期死亡有關,有望成為評估患者預后的指標之一。
GSEA結果表明CDCA8可能通過影響多種與細胞分裂周期有關的生物學過程來調節腫瘤細胞的增殖,如:精子形成、G2M檢查點、未折疊蛋白反應、有絲分裂紡錘體形成,且CDCA8還富集了E2F信號通路、MYC信號通路、MTORC1信號通路、PI3K/AKT/mTOR通路,這些信號通路均與細胞增殖分裂相關。此外膽固醇平衡、糖酵解有關的生物學過程可影響腫瘤細胞的物質代謝過程,進而促進腫瘤細胞的生長。CDCA8在腫瘤細胞中的高表達,可能導致CPC組分蛋白過表達,進而使CPC功能紊亂,無法正常發揮其在有絲分裂中的修復及調節作用,從而促進腫瘤的生長,這與上述細胞周期相關基因及物質代謝相關基因的異常表達可能會導致腫瘤的發生結論一致[4]。
以上結果提示,CDCA8表達水平可能是膀胱癌患者獨立預后因素,且CDCA8與膀胱癌患者的發生發展及惡化密切相關,CDCA8可促進膀胱癌的發生發展過程。可通過檢測患者的CDCA8水平評估患者的病程進展,且CDCA8有望作為膀胱癌患者靶向治療的作用靶點。但CDCA8是如何影響以上生物學通路的機制還需要進一步的研究,能否作為患者的獨立預后因素尚需大量臨床研究。

