絲素/海藻酸鈉復合薄膜的制備與性能
柳有財 柯梅芳 張俊華 楊新河 周毅 汪宜宇
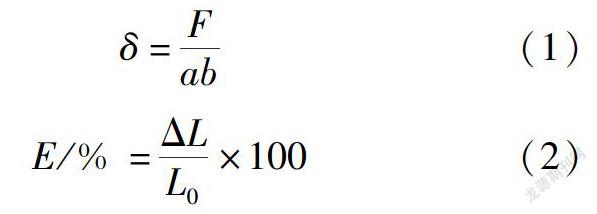
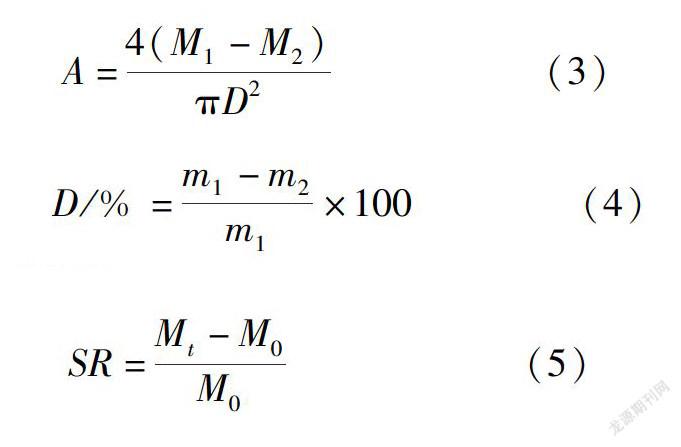
摘要: 絲素與海藻酸鈉共混溶液經過碳二亞胺交聯后,采用流延法制備的復合薄膜具有良好的相容性,改進了單一膜材的力學性能、吸濕性及其穩定性。通過對復合薄膜進行紅外光譜和掃描電鏡分析不同共混比例復合薄膜的微觀結構和聚集態結構;通過拉伸斷裂測試、熱水溶失率、溶脹率及水蒸氣傳遞速率的測試,研究了復合薄膜的基本性能。結果表明:經過碳二亞胺交聯后,復合薄膜兩相相容性提高,無明顯的相分離現象,并在絲素和海藻酸鈉之間形成了穩定的共價鍵交聯點,薄膜穩定性明顯提高,與單一成分薄膜相比,復合薄膜的柔韌性明顯增加。海藻酸鈉加入有效提高了薄膜的吸濕性能。
關鍵詞: 絲素;海藻酸鈉;復合薄膜;化學交聯;性能
中圖分類號: TS102.54
文獻標志碼: A
文章編號: 1001-7003(2018)06-0001-07
引用頁碼: 061101
Abstract: After mixtures of silk fibroin solution and sodium alginate solution were crosslinked by carbodiimide, the composite films prepared by flow casting method from the mixtures. The composite films exhibited good compatibility, and improved mechanical properties, hygroscopicity and stability of single film. The microstructure and aggregation structure of the composite films with different blending ratio were analyzed by Fourier Transformed Infrared Spectroscopy (FTIR) and Scanning Electron Microscope (SEM), and its basic properties were characterized by tensile failure test, hot water loss rate, swelling rate and vapor transfer rate. The results showed that the two-phase compatibility of the composite films was improved without obvious phase separation after carbodiimide cross-linking, and the stable covalent bonds between SF and SA formed. The stability of the film was obviously improved, and the tensile strength and elongation of the composite film was obviously enhanced compared with the single component film. The addition of SA effectively improved the swelling property of the film.
Key words: silk fibroin; sodium alginate; composite films; chemical crosslinking; property
絲素(silk fibroin,SF)用作外科縫合線已有多年歷史,其生物安全性毋庸置疑。它是一種從桑蠶絲中提取的天然高分子蛋白質,由丙氨酸和絲氨酸等18種氨基酸組成,具有低免疫原性,良好的生物相容性、可控降解性和透氧透氣性[1]。目前,國內外研究者廣泛開展了SF生物材料的研究,其中研究SF薄膜的報道已有許多,單純SF膜易溶于水,且脆性大、力學性能差,很大程度限制了它的應用,因此需要采用不同的方法進行改性,進一步提高膜材的性能,擴大應用范圍[2-4]。黃溪等[5]以溶液澆注法制備絲素蛋白/聚乙二醇(PEG)混合薄膜,PEG的添加可調節絲素膜的穩定性和力學性能。方潔羽等[6]采用澆鑄法在絲素—甘油復合膜中添加氧化石墨烯,補強增韌功能的納米顆粒改善了薄膜的機械性能。陳佳林等[7]以SF蛋白為原料,海藻酸鈉與甘油作為添加劑,得到了一種柔韌性較好的薄膜,這種薄膜可滿足食用性包裝材料的需求,然而作為生物材料,其在生理條件下的穩定性需要進一步改善。因此,本研究在絲素和海藻酸鈉共混溶液的基礎上,加入少量生物相容性良好的交聯劑1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC),增加材料內大分子網絡的交聯點,可得到一種穩定性好且柔韌的薄膜材料。
海藻酸鈉(sodium alginate,SA)是從藻類中提取的一種多糖碳水化合物,是一種理想的天然生物醫用材料[8]。SA由直鏈甘露糖醛酸(M單位)和古洛糖醛酸(G單位)通過α-1,4糖苷鍵隨機組成MG、MM、GG這三種形式[9-10]。M和G糖醛酸單元上都含有羧基,這使得它在中性或者堿性溶液中能聚合陰離子,表現出一定的黏附性,SA良好的親水性有助于提高材料的吸濕性和延展性[11]。EDC廣泛用于蛋白質化學,在氨基和羧基存在的條件下可發生化學交聯反應,形成新的酰胺鍵[12]。
本研究將SF與SA按照不同比例進行共混,EDC共價交聯混合體系,流延法制備得到SF/SA復合薄膜,考察不同配比復合薄膜的結構和性能。并研究交聯前后各復合膜的拉伸強度、斷裂伸長率,以及熱水溶失率。本研究結果將為SF/SA復合薄膜作為生物材料的應用提供一定的實驗依據。
1 實 驗
1.1 材 料
桑蠶絲(蘇州蘇豪生物材料有限公司),透析袋(上海西巴斯生物技術開發有限公司產品,截留相對分子質量10000以上)。海藻酸鈉、碳酸鈉、氯化鈣、乙醇(國藥集團化學試劑有限公司),N-羥基琥珀酸亞胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)(Sigma-aldrich),2-(N-嗎啉)乙磺酸-水合物(MES)(上海阿拉丁生化科技股份有限公司)。所用試劑均為市售分析純。
1.2 過 程
1.2.1 SF溶液的制備
將蠶絲浸入質量濃度為0.6g/L的碳酸鈉溶液中煮沸脫膠2次,第3次脫膠使用質量濃度為1g/L的碳酸鈉溶液,浴比為1︰100,然后置于60℃烘箱中烘干得到絲素纖維。將干燥的脫膠絲以浴比1︰10溶解于三元溶液中(物質的量之比1︰2︰8的CaCl2—C2H5OH—H2O三元混合溶液),溫度為72℃,時間為1h。待蠶絲完全溶解后,將冷卻的溶液倒入透析袋中,置于去離子水中透析72h脫鹽,然后將脫鹽得到的溶液在3000r/min下離心10min,去除雜質,即得到SF溶液。
1.2.2 SF/SA復合薄膜的制備
用蒸餾水配制質量分數2%的SA溶液,靜置脫泡后與質量分數2%的SF溶液按一定比例(SF/SA=100/0、85/15、75/25、60/40、50/50、25/75、0/100)進行混合,并攪拌均勻。交聯組依次加入相對溶質質量分數10%的NHS、20%的MES和20%的EDC,待混勻后真空脫泡,采用流延法將混合溶液緩慢倒入聚四氟乙烯模具中,置于60℃的烘箱中干燥成膜。將復合膜從模具小心剝離,置于干燥器中保存。按上述比例順序將交聯薄膜分別標記為SF100、SF85、SF75、SF60、SF50、SF25、SA。作為對照組,采用了三種比例(SF/SA=100/0、50/50、0/100)的溶液不加任何試劑,按照同樣的方法制成薄膜,分別標記為pSF100、pSF50和pSA。
1.3 測 試
1.3.1 SF/SA復合薄膜紅外光譜
將薄膜制成能通過300目篩子的微粒以用于紅外測試。用Nicolet 6700傅立葉變換紅外光譜儀(美國賽默飛世爾科技公司)測試,KBr壓片制樣,得到共混膜的紅外吸收光譜。
1.3.2 形態結構
用數碼相機拍出各復合膜的照片,進行宏觀觀察。將材料用導電膠固定在樣品臺上,噴金處理,然后用Hitachi S-4800掃描電子顯微鏡(日本日立公司)對薄膜材料表面進行觀察。
1.3.3 SF/SA復合薄膜的力學性能
將復合薄膜裁剪成1.5cm×8cm的細條,每組樣品先用螺旋測微器測量膜的厚度,然后用島津AG-IC型拉伸試驗機(日本島津公司)測量拉伸強度和斷裂伸長率,溫度29℃,相對濕度92%,夾持長度5cm,拉伸速度10mm/min,每種樣品平行測定5次,結果取其平均值[13]。計算公式如下:
1.3.4 SF/SA復合薄膜的水蒸氣傳遞速率
將復合薄膜裁剪成2cm×2cm的方塊,取內徑D為0.9cm的玻璃瓶,加入生理鹽水,然后將裁剪后的膜固定在瓶口處,每種樣品平行測定3次。用電子天平稱量其質量記為M1,然后放入37℃烘箱中24h后稱量其質量記為M2,通過質量差就可以監測出水蒸氣傳遞速率[14]。記水蒸氣傳遞速率為A,計算公式如下:
1.3.5 熱水溶失率測試
將復合膜裁剪成2cm×2cm的方塊,將材料放在60℃烘箱中烘至恒重,然后在相同條件下稱取各種不同的復合膜的質量m1(g),離心管中按浴比為1︰100加入去離子水,在37℃的水浴恒溫振蕩器中預熱30min。按順序放入各復合膜后振蕩24h,過濾,將殘留的復合膜在60℃烘箱中烘至恒重,稱取質量m2(g)。依下式計算得到熱水溶失率D:
1.3.6 溶脹率測試
將樣品在烘箱中干燥至恒重后,稱取其質量M0,放入指定浸泡溶液當中,37℃條件下浸泡并振蕩,在一定的時間間隔點(10min,0.5、1、2、4、8、12、24h)稱取浸潤水凝膠的質量Mt,稱取質量時用濾紙擦去表面多余的水分。為了測定pH值和溶劑中離子對溶脹性能的影響,設定了4種浸泡液,分別為pH4.01鄰苯二甲酸氫鉀緩沖液、pH7.4PBS、pH9.18硼酸鹽緩沖液、水(pH7.0)。SR(swelling ratio)溶脹率的計算公式如下:
2 結果與分析
2.1 復合膜的力學性能
圖1為交聯后不同共混比例的復合薄膜的拉伸強度和斷裂伸長率的變化曲線。pSF100、pSF50、pSA的拉伸強度分別為(2.12±0.5)、(7.9±1.3)、(6.8±1.2)MPa,斷裂伸長率分別為(3.7±0.4)%、(37.1±2.7)%、(42.5±4.5)%。由圖1(a)可知,隨著SA含量的增加,薄膜的拉伸強度不斷增大,最大值為樣品SF25,其應力值為(11.8±1.2)MPa;斷裂伸長率先增大后減少,其最大值為(109.1±7.7)%,所對應的樣品為SF50。與未交聯的薄膜相比,交聯薄膜的應力略有上升,而其斷裂伸長率大幅度提高。這是因為交聯劑加強了SF與SA之間的連接作用,生成了新的酰胺鍵[15],形成了牢固的網狀結構,且SA的親水性能結合環境中的游離水分子,水分子也起到了一定的增塑作用。另外,SA與SF分子間氫鍵作用在一定程度上也增加了復合膜的延展性[16],使其斷裂伸長率隨著SA的增加而大幅度上升。
2.2 復合膜的紅外光譜分析
為了解交聯前后復合薄膜材料聚集態結構變化,測定了不同共混比例的SF/SA復合膜經EDC交聯前后的紅外光譜,結果如圖2所示。SF酰胺基團的特征吸收分別在1700~1600cm-1(酰胺Ⅰ帶)、1600~1500cm-1(酰胺Ⅱ帶)、1350~1200cm-1(酰胺Ⅲ帶)處出現[17]。純SA的主要特征峰位于1645cm-1和1407cm-1,分別對應羧基對稱伸縮振動和不稱伸縮振動峰。在共混材料中3420cm-1左右波峰變寬,主要是海藻酸鈉中的O—H的強吸收峰出現在高波數,共混之后,兩者的氫鍵作用增強,致使此波段的峰形狀變寬。交聯前后材料中的特征峰位置沒有發生明顯的變化,說明EDC交聯并沒有帶來新的基團,只是增加了新的酰胺鍵,而絲素的特征峰位置基本出現在1645、1531cm-1和1232cm-1處,說明絲素的聚集態結構以無規卷曲和Silk I為主,由于SA大分子的加入致使絲素在成膜過程中無法形成規整的β-折疊結構,故薄膜的聚集態結構也沒有發生明顯的變化。隨著SA的加入,在1407cm-1處出現了SA的特征吸收峰,同時說明復合膜中確實含有以上兩種物質。
2.3 復合膜的表面形貌分析
由圖3可知,通過宏觀大體觀察,SF/SA的復合膜為透明的薄膜,且未見顆粒物的析出,共混物分布均勻,厚度均勻。從SEM圖可以看出,交聯后的復合薄膜表面光滑,結構均勻,無明顯的相分離現象,說明經EDC交聯后SF與SA兩相結合良好,有助于提高材料的機械性能。圖4為SF/SA復合薄膜內部大分子交聯結構的示意圖,在EDC交聯作用下,SF大分子與SA大分子之間形成的牢固的交聯點酰胺鍵,有助于提高材料的穩定性及改善材料的力學性能。從圖5可知,薄膜的厚度在0.054~0.066mm,復合薄膜的厚度略高于單純薄膜,每種薄膜的厚度均勻。
2.4 復合膜的熱水溶失率變化
本研究共選取了五種比例的膜進行熱水溶失率的測試,其中未交聯組pSF100、pSF50、pSA這三種膜材易溶于水,其熱水溶失率幾乎為100%,交聯組薄膜SF100、SF75、SF50、SF25、SA的熱水溶失率結果見圖6。從圖6可知,交聯后SF100、SF75和SF50的熱水溶失率較低,在20%左右,但超過50/50這個比例時,熱水溶失率上升,SA薄膜的穩定性最差。說明EDC交聯反應在SA含量低于50%時進行得較為徹底,形成的共價鍵交聯點多,在水中比較穩定;而當SA含量超過50%時,由于體系中缺乏參與反應的氨基,其反應進行程度明顯降低,故表現出很高的溶失率。
2.5 復合膜的水蒸氣傳遞速率
由圖7可知,SF50薄膜的水蒸氣傳遞速率最低,大約為空白對照組的0.475。SF100的膜水蒸氣傳遞速率為(3112±15)g/m2·24h,SA膜水蒸氣傳遞速率為(2987±87)g/m2·24h,而SF50的復合膜則表現得最低,為(2793±89)g/m2·24h,這說明體積比為1︰1時,SF與SA共混交聯形成的網絡體系在一定程度上阻礙了水分子的進出。人皮膚水蒸氣傳遞速率在240~1920g/m2·24h,而未處理的傷口的水蒸氣傳遞速率是4800g/m2·24h,醫用敷料的理想水蒸氣傳遞速率為2500g/m2·24h[14,18]。本研究所制備的復合薄膜的水蒸氣傳遞速率高于皮膚組織,接近理想的水蒸氣傳遞速率,具有良好的透氣性,可作為人工敷料。
2.6 復合膜的溶脹率
圖8、圖9顯示了不同復合薄膜在PBS中的溶脹行為和在不同浸泡液中的平衡溶脹率。由圖8可知,當浸泡液為PBS(pH7.4)時,SF100很快就達到了溶脹平衡,且溶脹率最低,在10min時的溶脹率為(0.22±0.05);而復合薄膜的溶脹率隨著SA含量的增加而上升,特別是當SA的含量超過50%時,可以看出其薄膜的溶脹率隨著時間的延長而逐漸升高,緩慢達到溶脹平衡,這是由于SA的引入使薄膜的吸水性能增加。從圖9可知,復合薄膜的平衡溶脹率隨著SA含量的增加而上升,其在酸性環境中平衡溶脹率最低,在水中和堿性溶液中的平衡溶脹率較大。
3 結 論
本研究通過控制SF和SA的比例,以及EDC化學交聯作用后制備得到SF/SA復合薄膜材料,并評價了復合薄膜材料的理化性能,得出如下結論:
1)SF50的機械性能表現最佳,其拉伸強度為(11.01±0.24)MPa,斷裂伸長率為(109.07±7.68)%,表現出較好的柔韌性。
2)交聯復合薄膜中的SF和SA大分子之間相容性良好,材料的大分子間出現了新的酰胺鍵,交聯后SF100、SF75和SF50的熱水溶失率低至20%,材料的穩定性得到了有效提高。
3)SF50復合膜水蒸氣傳遞速率為(2793±89)g/m2·24h,透氣性良好,復合薄膜的溶脹率隨著SA的增加而提高,改善了薄膜的吸水性能。
參考文獻:
[1]朱良均, 孔祥東, 閔思佳. 絲素蛋白在生物材料上的研究和應用[J]. 功能材料, 2001, 32(6): 583-585.
ZHU Liangjun, KONG Xiangdong, MIN Sijia. Research and utilization of fibroin protein on biomaterials [J]. Journal of Functional Materials, 2001, 32(6): 583-585.
[2]SERBAN M A, PANILAITIS B, KAPLAN D L. Silk fibroin and polyethylene glycol-based biocompatible tissue adhesives [J]. Journal of Biomedical Materials Research: Part A, 2011, 98(4): 567-575.
[3]LI R, ZHANG Y, ZHU L, et al. Fabrication and characterization of silk fibroin/poly(ethylene glycol)/cellulose nanowhisker composite films [J]. Journal of Applied Polymer Science, 2012, 124: 2080-2086.
[4]盧神州, 李明忠, 白倫. 聚乙二醇丙三醇對絲素蛋白膜的改性[J]. 高分子材料科學與工程, 2006, 22(1): 246-249.
LU Shenzhou, LI Mingzhong, BAI Lun. Modification of silk fibroin film by poly(ethylene glycol-glycerin)[J]. Polymer Materials Science and Engineering, 2006, 22(1): 246-249.
[5]黃溪, 王芋曉, 董燕, 等. 絲素蛋白/聚乙二醇薄膜結構性質和藥物釋放研究[J]. 廣西大學學報(自然科學報), 2013, 38(3): 576-583.
HUANG Xi, WANG Yuxiao, DONG Yan, et al. Structural regulation of silk fibroin/PEG blend films for controlled drug release [J]. Journal of Guangxi University (Natural Science Edition), 2013, 38(3): 576-583.
[6]方潔羽, 李延報, 李懷棟. 絲素-氧化石墨烯-甘油復合膜的制備及性能[J]. 功能高分子學報, 2015, 28(1): 73-78.
FANG Jieyu, LI Yanbao, LI Huaidong. Preparation and properties of silk fibroin-graphene oxide-glycerin composite films [J]. Journal of Functional Polymers, 2015, 28(1): 73-78.
[7]陳佳林, 黃晨, 許云輝. 絲素-海藻酸鈉-甘油共混膜的制備及性能研究[J]. 安徽農業大學學報, 2013, 40(2): 321-325.
CHEN Jialin, HUANG Chen, XU Yunhui. Preparation of silk fibroin-sodium alginate-glycerol blend films and its properties [J]. Journal of Anhui Agricultural University, 2013, 40(2): 321-325.
[8]林曉華, 黃宗海, 俞金龍. 海藻酸纖維的研究發展及生物醫學應用[J]. 中國組織工程研究, 2013, 17(12): 2218-2224.
LIN Xiaohua, HUANG Zonghai, YU Jinlong. Alginate fiber: development and biomedical application [J]. Chinese Journal of Tissue Engineering Research, 2013, 17(12): 2218-2224.
[9]張琨, 馬珊珊, 孟楠, 等. 海藻酸鈉濃度對新型神經組織工程支架結構與性能的影響[J]. 鄭州大學學報(理學版), 2015, 47(4): 169-173.
ZHANG Kun, MA Shanshan, MENG Nan, et al. Effect of sodium alginate concentration on the structure and properties of a new scaffold for nerve tissue engineering[J]. Journal of Zhengzhou University(Natural Science Edition), 2015, 47(4): 169-173.
[10]劉雷艮, 顧偉, 左保齊. 蠶絲生物材料[J]. 絲綢, 2006(2): 38-40.
LIU Leigen, GU Wei, ZUO Baoqi. Silk biomaterials [J]. Journal of Silk, 2006(2): 38-40.
[11]高春梅, 柳明珠, 呂少瑜, 等. 海藻酸鈉水凝膠的制備及其在藥物釋放中的應用[J]. 化學進展, 2013, 25(6): 169-173.
GAO Chunmei, LIU Mingzhu, L Shaoyu, et al. Preparation of sodium alginate hydrogel and its application in drug release [J]. Progress in Chemistry, 2013, 25(6): 169-173.
[12]CAMMARATA C R, HUGHES M E, OFNER III C M. Carbodiimide induced cross-linking, ligand addition, and degradation in gelatin [J]. Molecular Pharmaceutics, 2015, 12(3): 783-793.
[13]張君賢, 隋淑英, 朱平, 等. 海藻酸鈣/明膠共混膜的制備及性能研究[J]. 膜科學與技術, 2013, 33(2): 37-40.
ZHANG Junxian, SUI Shuying, ZHU Ping, et al. Study on the preparation and performance of calcium alginate/gelatin composite membranes [J]. Membrane Science and Technology, 2013, 33(2): 37-40.
[14]GU Z P, XIE H X, HUANG C C, et al. Preparation of chitosan/silk fibroin blending membrane fixed with alginate dialdehyde for wound dressing [J]. International Journal of Biological Macromolecules, 2013(58): 121-126.
[15]WANG Y Y, WANG X Y, SHI J, et al. A biomimetic silk fibroin/sodium alginate composite scaffold for soft tissue engineering [J]. Scientific Reports, 2016(6):39477.
[16]LIANG C X, HIRABAYASHI K. Improvements of the physical properties of fibroin membranes with sodium alginate [J]. Journal of Applied Polymer Science, 1992, 45(11): 1937-1943.
[17]LI M, TAO W, LU S, et al. Compliant film of regenerated antheraea pernyi silk fibroin by chemical crosslinking [J]. International Journal of Biological Macromolecules, 2003, 32(3): 159-163.
[18]陳鐘敏, 高層層, 梁敏, 等. 一種傷口抑菌促愈合敷料及其制備方法:CN201610745185.8 [P]. 2016-12-14.
CHEN Zhongmin, GAO Cengceng, LIANG Min, et al. Preparation of a bacteriostatic wound dressing for promoting the healing of injuries: CN201610745185.8 [P]. 2016-12-14.

