改良CTAB方法提取果樹不同組織的RNA
關 玲, 趙密珍, 王慶蓮, 吳偉民, 錢亞明, 巫建華
(1.江蘇省農業科學院果樹研究所/江蘇省高效園藝作物遺傳改良重點實驗室,江蘇南京 210014;2.江蘇現代園藝工程技術中心,江蘇句容 212400)
果樹作為重要的園藝作物,在國民生產中占有重要地位。分子生物學研究作為有效的試驗工具,被廣泛應用于果樹研究中[1-3]。同時,隨著果樹基因組數據的逐漸豐富,越來越多的果樹物種基因組信息得到了注釋,因此,開展果樹分子生物學研究,對于挖掘功能基因以及通過基因工程等手段實現為果樹育種服務的目標被越來越多的果樹育種工作者接受[4-6]。
RNA的提取作為分子生物學研究的基礎步驟,其成熟度較為重要。果樹作為多年生木本或草本植物,因其多年生的特點,多富含多糖、多酚等次生代謝物質,使其RNA的提取及純化工作較為困難[7]。生物試劑盒對于分子生物學研究具有快速、簡便的優點,但當今市場上尚沒有針對果樹物種RNA提取的試劑盒,并且利用廣譜的植物RNA提取試劑盒提取果樹物種RNA具有不穩定的特點。常用的傳統RNA提取方法有TRIzol方法、苯酚法、氯化鋰沉淀法、異硫氰酸胍法及十二烷基硫酸鈉(sodium dodecyl sulfate,簡稱SDS)/酚抽提方法[8-11],以上方法具有價格昂貴、費時費力的特點,且得到的果樹RNA產量較少[12]。此外,筆者通過試驗對比發現,TRIzol方法多適用于草本植物,不適用于木本植物材料的RNA提取。本試驗通過對十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,簡稱CTAB)法的進一步改良,得到通用于提取果樹不同代表物種如草莓(草本)、蘋果(木本)以及葡萄(藤本)不同組織RNA的方法。本研究以期通過對比不同RNA提取方法和進一步改進已有的CTAB提取方法,為果樹分子生物學研究提供基礎、準確的RNA提取方法,從而方便果樹研究者進行后續研究。
1 材料與方法
1.1 試驗材料
本試驗所用材料草莓、葡萄均取自江蘇省農業科學院園藝研究所試驗田,草莓(Fragaria×ananassaDuch.)品種為寧玉[13],定植時期為2014年9月初;葡萄(VitisL.)的組培苗、大田苗品種皆為紅寶石無核,其中組培苗為胚挽救后代種苗,大田苗為5年生植株;蘋果材料采自山東省臨沂市平邑縣一年生蘋果(Malusdomestica)砧木M9。用于RNA提取的草莓、蘋果和葡萄的組培苗材料均采集根、莖、葉(圖1-A、圖1-B、圖1-C)3種組織;于葡萄大田苗上采集根、莖、葉、果皮和果肉(圖1-D)5種組織,所采集的樣品應盡量呈幼嫩狀態并立即置于液氮中帶回實驗室,放置于-70 ℃冰箱中待用。
1.2 試劑與儀器
1.2.1 改進后的CTAB裂解液母液的配制成分 (1)5 mol/L NaCl(使用濃度為1.4 mol/L)。(2)0.5 mol/L EDTA·2Na(pH值為8.0,使用濃度為20 mmol/L)。用磁力攪拌器劇烈攪拌,加入NaOH調節pH值到8.0時,EDTA·2Na方可溶解。(3)1 mol/L Tris-HCl(pH值為8.0,使用濃度為 0.1 mol/L),用HCl調節pH值至8.0。(4)2%(質量濃度)CTAB。(5)2%(質量濃度)聚乙烯吡咯烷酮K-30(polyvinylpyrrolidone K-30,簡稱PVP K-30)。以100 mL為例,用適量體積的上述各組分母液配制CTAB裂解液:28 mL NaCl,4 mL EDTA·2Na,1 mL Tris-HCl,2 g CTAB,2 g PVP,用RNase free ddH2O定容。
1.2.2 其他組分及試劑 (1)10 mol/L LiCl(LiCl易吸潮,需快速操作,注意溶解放熱燙);(2)3 mol/L NaAc(pH值5.2);(3)β-巰基乙醇,使用濃度為1%;(4)70%(體積分數)乙醇;(5)三氯甲烷+異戊醇(體積比24 ∶1);(6)水飽和酚(pH值4.5);(7)無水乙醇;(8)ddH2O(RNase free)。
配制各組分試劑均使用ddH2O,配制完畢后加入外源RNA酶清除劑處理24 h后待用。
1.3 試驗方法
1.3.1 果樹RNA提取的操作步驟 (1)取待提取RNA試材(除果實外的組織取材質量約為0.5~1.0 g,果實質量為 1.5~2.0 g),置于液氮中迅速研磨成粉末,將1 000 μL CTAB裂解液和20 μLβ-巰基乙醇依次加入2 mL離心管中,于 65 ℃ 水浴30 min(水浴過程中每隔10 min將離心管上下顛倒約30次,以保證待提取試材與CTAB裂解液充分接觸);(2)加入等體積的三氯甲烷+異戊醇(體積比24 ∶1),旋渦混勻,8 000g、4 ℃離心10 min;(3)取800 μL上清,加入1/2體積的水飽和酚(pH值4.5),混勻,靜置5 min,再加入1/2體積的三氯甲烷+異戊醇(體積比24 ∶1),旋渦混勻;8 000g、4 ℃ 離心10 min;(4)取600 μL上清(在1.5 mL離心管中操作),加入1/30體積的NaAc(3 mol/L,pH值5.2)和1/10體積的無水乙醇,混勻后靜置5 min,8 000g、4 ℃離心10 min;(5)取450 μL上清,加入1/3體積的LiCl(10 mol/L),-20 ℃ 靜置2~3 h;8 000g、4 ℃離心15 min;(6)棄上清,用70%乙醇洗滌沉淀2次,再用無水乙醇洗滌沉淀1次,室溫干燥,將清洗后的沉淀溶于ddH2O(RNase free)中,于-70 ℃保存備用;(7)取2 μL總RNA,用1%瓊脂糖凝膠電泳進行檢測(電泳儀電壓不宜設置過大,否則會因產熱引起RNA樣品降解導致檢測結果不準確);(8)將RNA樣品上Biophotometer核酸儀檢測,體系為1 μL RNA樣品加入49 μL ddH2O(RNase free),RNA濃度、D280 nm/D260 nm值和D260 nm/D230 nm值直接從儀器上讀取。
1.3.2 基因組DNA的消化及反轉錄 利用上述方法提取的RNA樣品中,存在少許基因組DNA,其消化及cDNA的合成按照TaKaRa公司的PrimerScriptTMRT reagent Kit(TaKaRa,貨號:RR047A)說明書進行。為確保試驗結果的可靠性,消化及反轉錄試驗需在冰上進行。
2 結果與分析
2.1 RNA瓊脂糖電泳檢測
RNA產物使用1.0%瓊脂糖凝膠電泳檢測,圖2結果顯示,經過改進的CTAB法提取多年生草本、木本及藤本果樹材料均可獲得清晰的3條RNA條帶,如圖2分別是28.0S rRNA、18.0S rRNA、5.8S rRNA及少量gDNA(基因組DNA)。凝膠結果顯示點樣孔清晰、無污染。
2.2 RNA純度檢測
利用Biophotometer核酸儀對所提取樣品RNA的吸光度及產量進行檢測。 結果表明, RNA樣品的D260 nm/D230 nm值均高于2.0,具體為2.03~2.27(表1)。說明利用改進后的CTAB法抽提獲得的RNA所含多糖、酚類及其他小分子物質較少。草莓、蘋果大田苗及葡萄組培苗的根、莖、葉片RNA的D260 nm/D280 nm值范圍為1.80~1.93,葡萄大田苗各組織RNA的D260 nm/D280 nm值為1.80~1.91,表明利用本方法抽提獲得的果樹RNA中雜質蛋白質污染較少。不同組織的RNA產量情況如下:根器官RNA產量為600.15~712.75 ng/μL;莖RNA產量為530.61~694.54 ng/μL;葉片RNA產量為617.54~777.53 ng/μL;果皮RNA產量為561.23 ng/μL;果肉RNA產量為40.23 ng/μL。
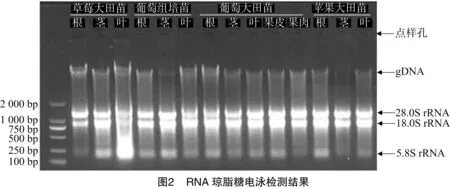
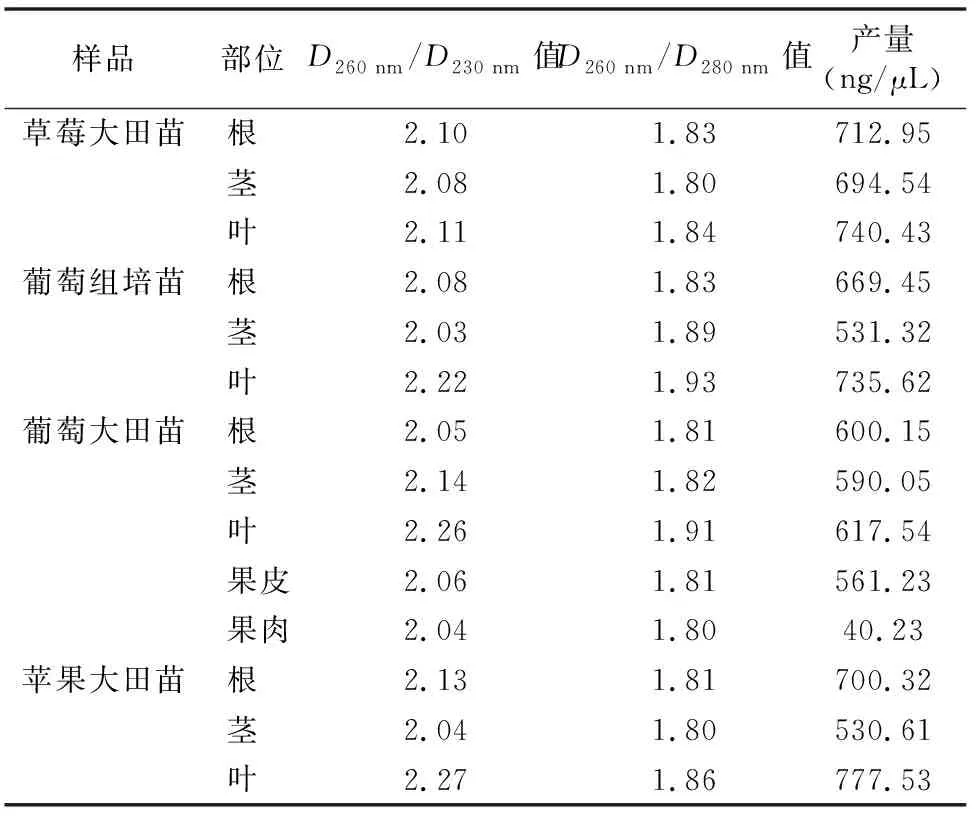
表1 分光光度法檢測RNA質量及產量
注:吸光度比值為3個樣品重復的平均值。
綜合上述4種試材不同組織的D260 nm/D230 nm值及所得RNA產量情況,可以得出草莓、蘋果以及葡萄RNA的提取在根、莖、葉3種營養器官中出現一致的難易度趨勢,即葉片較根容易提取,兩者皆較莖容易提取得到RNA;葡萄大田苗生殖器官的RNA提取難易程度表現為果皮較果肉容易。
2.3 RNA提取后的質量檢測
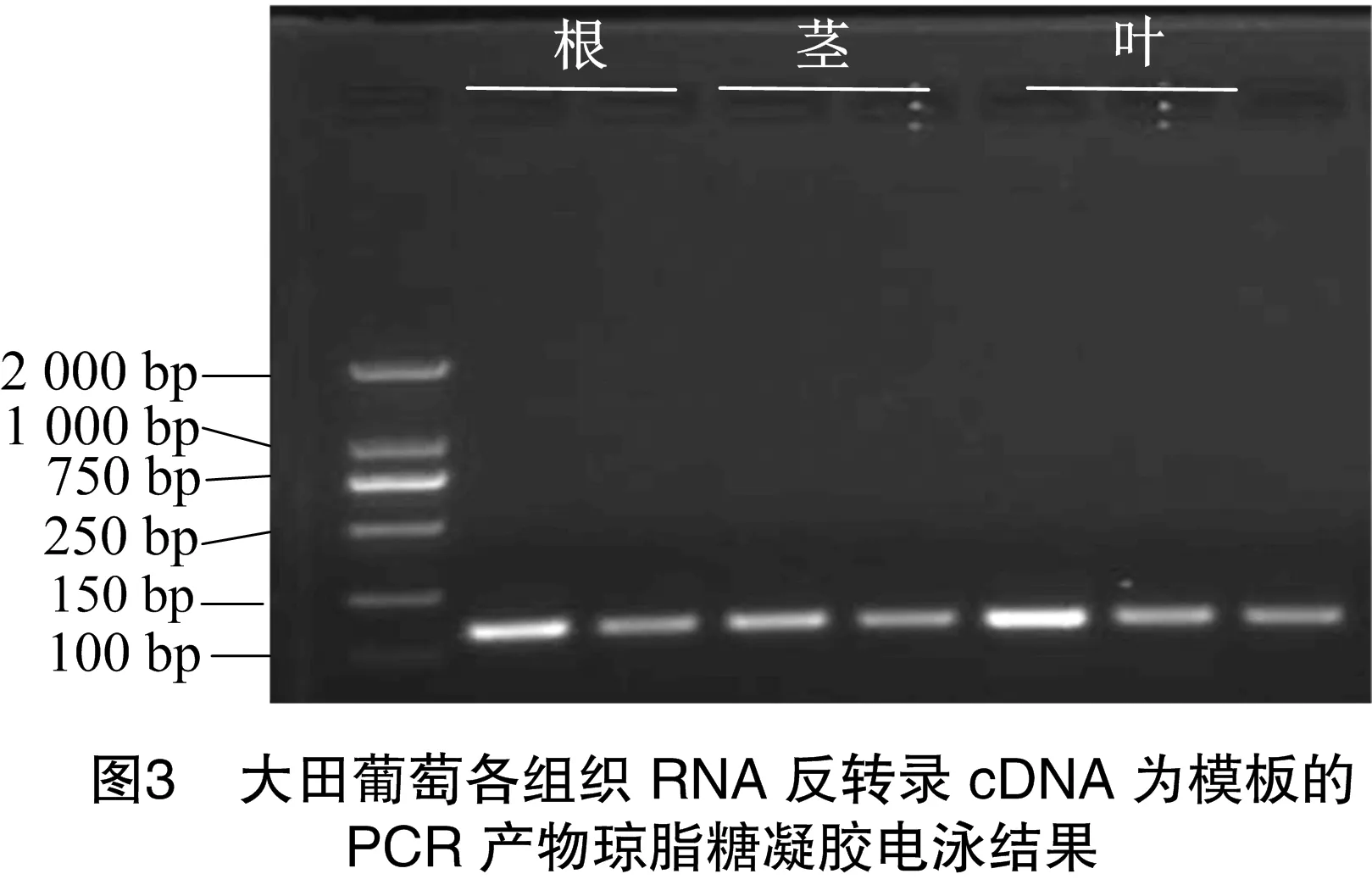
為檢測RNA質量是否滿足RT-PCR試驗,設計草莓的內參基因FvMSI1的引物如下:F,5′-TCCCCACACCTTTGATT GCCA-3′;R,5′-ACACCATCAGTCTCCTGCCAAG-3′。蘋果內參基因18S rRNA引物如下:F,5′-GTTACTTTTAGGACT CCGC C-3′;R,5′-TTCCTTTAAGTTTCAGCCTTG-3′。葡萄內參基因為UBI,F:5′-GCTCGCTGTTTTGCAGTTCTAC-3′;R:5′-AACATAGGTGAGGCCGCACTT-3′。使用所提取的果樹RNA進行反轉錄得到cDNA,利用上述引物經PCR擴增后,將產物進行瓊脂糖電泳檢測(圖3),分析結果可知,利用該方法獲得的RNA均可用于后續的RT-PCR試驗。
3 討論與結論
3.1 RNA提取前的準備工作
RNA提取的關鍵是抑制細胞中的RNA分解和防止操作環境中的RNA酶污染。因此在試驗中應采取以下措施:(1)使用70%乙醇清潔試驗操作臺;(2)使用RNA操作專用試驗臺,或者利用外源RNA酶清除劑處理臺面及操作用到的所有器具(研缽、鑷子、藥匙等);(3)水浴鍋提前預熱、離心機提前預冷。通過上述方法主要防止外界環境、空氣或者試驗者唾液中RNA酶的污染。
3.2 改良CTAB法的優點
3.2.1 提取液改進PVP用量 本試驗在RNA的提取過程中改進了PVP的用量,不僅能去除果樹各組織中的酚類物質和多糖,還能去除一些其他色素和脂類物質,同時可以消除泡沫,保護膠體,可以提取得到更完整和純度更高的RNA產物。同時與傳統的CTAB法相比[12,14],本方法改進了各組分的用量,如CTAB提取液的用量(1 mL)、β-巰基乙醇的使用濃度(1%,體積分數)和NaAc濃度(3 mol/L),一方面可以節約成本,另一方面可以減少如β-巰基乙醇等物質在操作過程中的毒害作用。進一步分析可知,所提取的RNA與傳統方法相比,擁有高純度(D260nm/D230 nm值>2.0,D260 nm/D280 nm值>1.8)的特點,同時RNA產量較高(除果肉RNA產量為 40.23 ng/μL 外,其余材料的產量范圍為530.61~777.53 ng/μL),其質量及產量均滿足后續的RT-PCR試驗要求。
3.2.2 高效穩定 相對于生物公司銷售的成品RNA提取試劑盒,本方法具有操作簡便、試驗結果可靠性高及節本的特點。筆者所在課題組曾嘗試使用多種成品試劑盒提取果樹不同組織中的RNA,發現效果均不理想。尤其是提取木質化程度較高的果樹材料及次生代謝物質含量較高的果樹生殖器官RNA,如葡萄的果皮和果肉組織。分析其原因可能是在成品試劑盒中,針對木本果樹特有的多酚、多糖的去除技術尚未成熟。同時考慮到果樹物種的季節性較強,樣品采集的重復性較差,應用高效穩定的RNA提取方法對于果樹分子生物學研究十分重要。筆者通過多次試驗,發現經本研究改進的CTAB法具有重復性好、可靠性高的特點,尤其適用于木本果樹的RNA提取。本研究分別選取草本、木本及藤本果樹的不同營養器官及生殖器官開展研究,進一步驗證了改進后的CTAB法可用于不同類型果樹各組織RNA的提取,從而為果樹分子生物學研究提供了高效穩定的RNA提取方法。
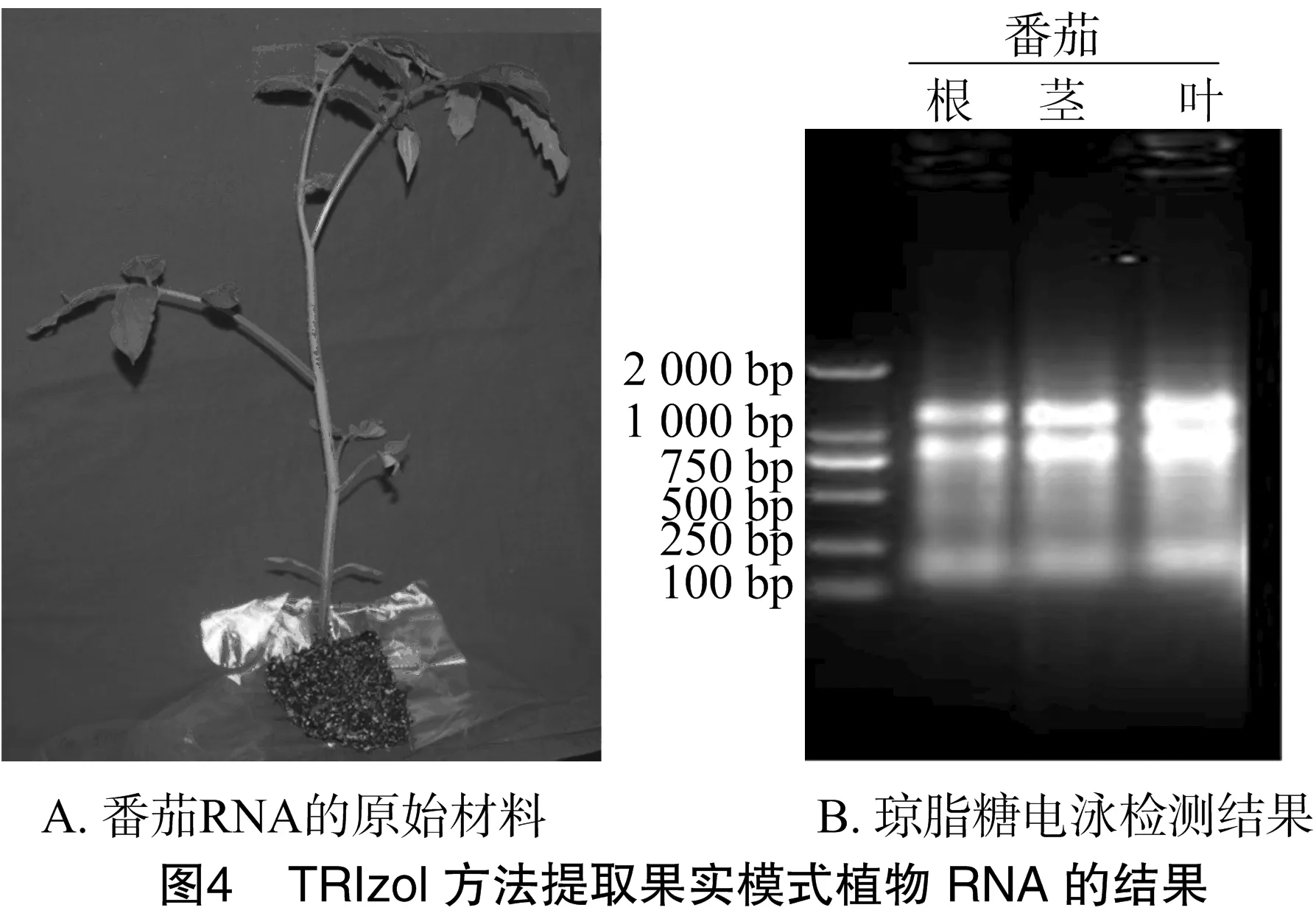
3.2.3 CTAB法與TRIzol方法的比較 筆者曾利用靈敏且快捷的TRIzol方法對蘋果材料不同組織的RNA進行提取,結果均不理想(只有幼嫩的葉片材料可獲得少量的RNA,其他木質化程度較高的材料均無法獲得RNA)。利用TRIzol方法提取擬南芥以及果樹研究中的果實模式植物——番茄卻可以得到理想結果(圖4),但成品TRIzol試劑價格昂貴。筆者分析其原因,可能是木本果樹中的多酚等次生代謝物質阻礙了TRIzol試劑對果樹組織內RNA的分離,但是應用TRIzol方法提取其他草本植物RNA仍不失為一種優良方法。基于此,筆者提出,本研究中改進的CTAB法適用于木本果樹材料,同時對于珍稀材料或者采集重復性較差的試驗樣品使用該方法可提高穩定性,減少材料損失。
3.2.4 外源RNA酶清除劑替代焦碳酸二乙酯(diethy pyrocarbonate,簡稱DEPC)處理 利用上述外源RNA酶清除劑可以較快速地去除所用試劑、器具及RNA提取環境中的RNA酶,與傳統的DEPC處理方法[15]相比,可以省去繁瑣的高溫滅菌步驟,且外源RNA酶清除劑的使用,具有快速、操作簡便及無毒的特點。
3.3 果樹RNA提取過程中可能出現的問題及對策
3.3.1 瓊脂糖凝膠點樣孔模糊或D260 nm/D230 nm值非正常范圍 正常提取所得RNA的D260 nm/D230 nm值≥2,若該值偏小或瓊脂糖凝膠點樣孔模糊,說明所提取的RNA樣品中有雜質多糖、多酚或其他鹽類小分子物質。本試驗材料的D260 nm/D230 nm值范圍為2.03~2.27。可見利用該方法在提取液中加入較高質量濃度的PVP,能夠有效地去除果樹組織中的酚類、多糖等次生代謝物質,同時提高RNA的完整性和純度。
3.3.2 提取樣品RNA呈現褐色 本研究提取的試材不新鮮,存在褐化,或由于研磨過程中未能保持樣品處于液氮中,抑或由于研磨所得的樣品在裝入離心管之前未在管中及時添加β-巰基乙醇,導致研磨樣品與空氣中的氧氣接觸,從而使試材中的酚類物質氧化成醌類物質而呈現褐色。解決對策有以下2個:一是保證提取試材新鮮并處于超低溫環境;二是保證研磨所得樣品在裝入離心管前加入β-巰基乙醇,以防止樣品褐化。此外,整個研磨及裝管過程需要操作迅速。
3.3.3D260 nm/D280 nm值及產量D260 nm/D280 nm值正常范圍為1.8~2.0,其值偏小說明RNA樣品中有雜質蛋白質污染;其值偏大說明RNA降解嚴重。苯酚在低pH值的情況下可促進水相中的蛋白質和DNA向有機相分配,從而最大限度地去除總RNA中的蛋白質和DNA,因此在抽提過程中需要加入水飽和酚(pH值4.5)。本試驗中葡萄大田苗生殖器官的RNA提取難易程度為果肉遠難于果皮,分析其原因,可能是果肉中的水分含量較高。操作者在研磨時為降低雜質出現的概率,會加入較少量的葡萄果肉材料,導致最終RNA產量較少。因此,對于葡萄果實的提取,可以適當增加試材的研磨量(1.5~2.0 g),以提高果實的RNA產量,從而滿足后續試驗要求。
3.3.4 LiCl選擇性地沉淀RNA 利用該法可以充分去除RNA中的DNA污染。若樣品量允許,可以進行2次LiCl沉淀。注意使用70%(體積分數)乙醇至少洗滌2次,避免RNA中因含有LiCl(金屬Li+)而影響反轉錄的效果。本研究通過反復試驗,比較經典草本植物RNA提取的TRIzol方法以及改進的CTAB方法,摸索出更加成熟的可通用于草本、木本果樹不同組織RNA提取的新方法,經檢測,所提取得到的RNA可以直接用于后續研究。

