UPLC-MS/MS法測定雞肉中阿維菌素類藥物殘留檢測方法的建立
冒玉娟, 邢曉玲, 沈小艮, 何晉瑤
(江蘇農牧科技職業(yè)學院,江蘇泰州 225300)
隨著我國社會經濟和生活水平的提高,食品安全問題引起了全社會的廣泛重視,采取有效的檢測手段對動物源食品中藥物殘留問題進行風險預警及監(jiān)督控制是保障人們“舌尖上”安全的重要舉措。阿維菌素類藥物(avermectins,AVMs)是由鏈霉素產生的一組類似于大環(huán)內酯類藥物的物質,由于有殺蟲活性強[1-2]、殺蟲譜廣的特點,成為現代農牧業(yè)上用量最大的抗寄生蟲藥物[3]。目前,已商品化的主要品種有阿維菌素(avermectin,AVM)、伊維菌素(ivermectin,IVM)、多拉菌素(dommectin,DOR)、埃普菌素(eprinomectin,EPR)、莫西丁克(mox-idectin,MOX)和塞拉菌素(selamectin,SEM)[4]。雖然,阿維菌素類藥物的作用劑量較小(ng/kg級),但是此類藥物的脂溶性較高,而且具有神經毒性和發(fā)育毒素,在體內殘留時間較長,因此按照世界衛(wèi)生組織(WHO)5級分類標準,仍將其列為高毒化合物[5]。幾乎每個國家都有食品中AVMs殘留限量(MRL)的規(guī)定,歐盟(EU)、美國(US)、聯合國食品法典委員會(CAC)和我國都制定了阿維菌素類藥品在哺乳動物體內的農藥最高殘留限量(MRL),歐盟為15 μg/kg、美國為20 μg/kg、聯合國食品法典委員會和許多國家對該類化合物的殘留限量為 10 μg/kg[6-7]。
阿維菌素類藥物相對分子量較大,氣化困難,且尚無可行的氣相色譜分析方法。目前,檢測方法主要有免疫親和色譜技術(IAC)、酶聯免疫吸附法(ELISA)、液相色譜法(HPLC)等。免疫親和色譜技術需要選擇合適的抗體固定方式,在洗脫待測抗原時應保證固定的抗體不被解離下來,試驗成本較昂貴;酶聯免疫吸附法的最低檢測限較低,可以滿足阿維菌素類藥物殘留的檢測,但是免疫分析檢測具有一定的盲目性,以及抗體依賴于國外進口等因素的影響,使酶聯免疫法的廣泛應用受到限制;HPLC技術是阿維菌素類較為常用的藥物分析技術,其中HPLC-DAD檢測法靈敏度低,無法精確檢測殘留量;HPLC-FLD光檢測法是國內目前使用最廣泛的阿維菌素類藥物殘留的檢測方法[7],但是樣品前處理復雜,需要進行衍生化,花費較高。近年來,UPLC-MS/MS法在國內外屢見報道,此法將超高效液相色譜的高速、高分離度與質譜的高選擇性、高靈敏度相結合,無需對樣品進行衍生化處理,可同時測定多個目標物,具有高選擇性、高靈敏度、高通量的優(yōu)勢。本試驗樣品采用蛋白沉淀法前處理,建立UPLC-MS/MS法同時測定雞肉中伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素多殘留的檢測方法,方法簡單、操作性強,可滿足國內外對動物源食品中阿維菌素類藥物殘留的定性、定量檢測要求。
1 材料與方法
1.1 藥物與試劑
伊維菌素對照品(批號:k0191406)、阿維菌素對照品(批號:k0361505)、多拉菌素對照品(批號:k0461411)、乙酰氨基阿維菌素對照品(批號:k0471411)均購自中國獸醫(yī)藥品監(jiān)察所;伊維菌素原料藥、乙酰氨基阿維菌素原料藥,河北威遠動物藥業(yè)有限公司;阿維菌素粉(2%),江蘇中牧倍康藥業(yè)有限公司;多拉菌素原料藥,江蘇凌云藥業(yè)有限公司;乙腈,色譜純,Fisher Scientific公司;二甲基亞砜(DMSO),色譜純,國藥集團化學試劑有限公司;甲酸,色譜純,Sigma-Aldrich公司。
1.2 儀器與設備
超高液相色譜儀(日本島津超高液相LC-30AD系列);API 4000 Q-trap三重四級桿/離子阱質譜儀包含電噴霧電離源(ESI源)(美國Applied Biosystem公司);CTC PAL自動進樣器(CTC Analytics,AG,瑞士);FA25型高速勻漿機(Fluko公司)。
1.3 試驗動物及處理
雛雞,購自江蘇泰州某孵化場,選擇無抗飼料飼養(yǎng)至30日齡。分為2組,一組給以伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素粉,均按照說明書劑量拌料給藥,連用3 d;另一組為對照組,不給以任何藥物。分別在給藥后3 d,剖殺,取各組肌肉,-20 ℃保存,備用。
1.4 方法
1.4.1 系列標準工作溶液的配制 精確稱取伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素對照品適量,分別置于 20 mL 的容量瓶中,用DMSO溶解并定容,超聲促溶,并充分搖勻,配制成1 mg/mL標準儲備液。用移液槍各取100 μL于600 μL乙腈中,配制成100 μg/mL的混合工作液。用乙腈梯度稀釋至10.00、5.00、2.00、0.50、0.20、0.08、0.04 μg/mL的混合系列標準工作溶液。
1.4.2 空白肌肉勻漿液 稱取一定量的雞空白肌肉樣品,剪碎,加入5倍體積的50%乙腈,樣品置于冰浴上,用高速勻漿機進行勻漿處理,得均一的勻漿液。
1.4.3 標準工作曲線的前處理 取5 μL系列標準工作液(10.00、5.00、2.00、0.50、0.20、0.08、0.04 μg/mL)加入 50 μL 的空白肌肉勻漿液中,渦旋30 s,加入150 μL乙腈溶液,渦旋振蕩3 min,使蛋白充分沉淀,于4 ℃的離心機中 14 000 r/min 離心10 min,取150 μL上清加入150 μL超純水中,混合均勻后,待進樣。
標準曲線的系列濃度為4、8、20、50、200、500、1 000 ng/mL;肌肉勻漿為5倍體積勻漿液,故在肌肉中的定量范圍為20、40、100、250、1 000、2 500、5 000 ng/g。
1.4.4 給藥雞肌肉樣品前處理 取給藥肌肉勻漿液50 μL,加入5 μL乙腈,以與空白添加樣品(即標準曲線)的基質保持一致,加入150 μL乙腈溶液,渦旋振蕩3 min,于4 ℃的離心機中14 000 r/min離心10 min,取150 μL上清加入150 μL超純水中,混合均勻后,待進樣。
1.4.5 液相色譜串聯質譜條件 UPLC色譜條件:色譜柱為waters XTerra C18(150 mm×2.1 mm,ID 5 μm);流動相A:0.1%甲酸的超純水;流動相B:0.1%甲酸的乙腈;流速:0.5 mL/min;進樣體積:10 μL;梯度洗脫條件見表1。
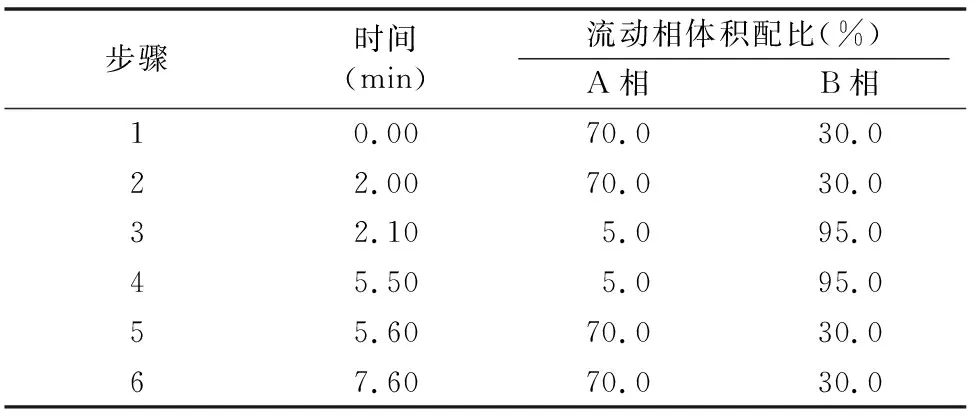
表1 梯度洗脫條件
質譜條件:電噴霧離子源(ESI),正離子模式,掃描方式:多反應監(jiān)測(MRM)。質譜離子源參數:CUR:20.00,CAD:6、IS:5 500.00,TEM:500.00,GS1:50.00,GS2:60.00,ihe:ON。4種化合物質譜參數見表2。質譜采集與分析軟件:Analyst 1.4.2。
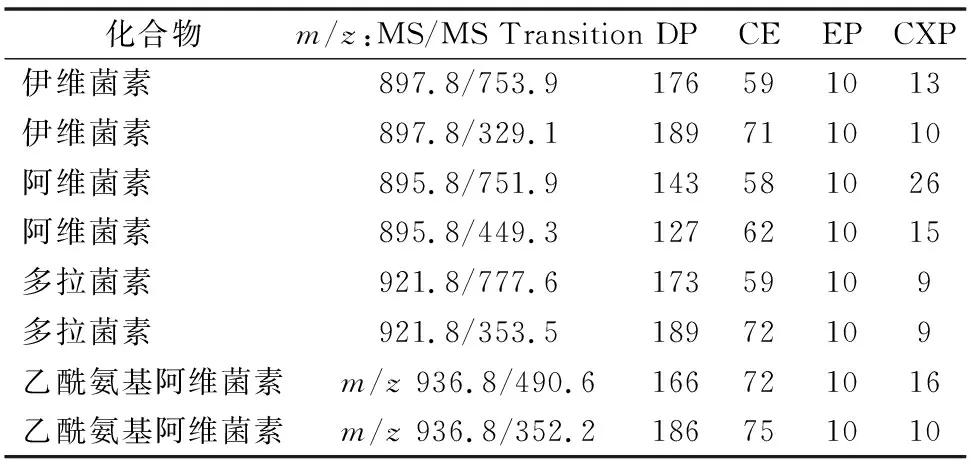
表2 4種化合物質譜參數
1.4.6 添加回收率 在空白雞肉中,分別添加50、500、4 000 ng/g 3個質量分數水平的伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素對照品,每個質量濃度水平做3個平行試驗,計算4種物質的加標回收率和相對標準偏差(RSD)。
2 結果與分析
2.1 質譜條件的優(yōu)化
伊維菌素中B1a含量高,其準確分子量為874.5;阿維菌素中B1a含量高其準確分子量為872.5;多拉菌素中B1b含量高,其準確分子量為898.5;乙酰氨基阿維菌素中的B1a的含量高,其準確分子量為913.5。
預先配制100、500、1 000 ng/mL的3個質量濃度的伊維菌素、阿維菌素、多拉菌素以及乙酰氨基阿維菌素的標準溶液以流動注射的方式在正離子模式下進行一級質譜母離子全掃描,分子離子m/z分別為897.8、895.8、921.8、936.8,均為[+Na+]的分子離子峰,其中500 ng/mL的分子離子響應在106計數/s附近,即為最佳優(yōu)化濃度,故以500 ng/mL的濃度在正離子模式下進行自動優(yōu)化確定最高以及次高響應的二級離子m/z以及相應DP、CE、CXP 3個參數,具體見表2。最終優(yōu)化ESI源的碰撞電壓、離子化溫度、氣簾氣等參數。本研究中為保證4個化合物在同樣的分析條件下,信號接近,在最終定量分析時伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素選用的離子對分別為897.8/753.9、895.8/751.9、921.8/777.6、936.8/490.6。
2.2 色譜條件的優(yōu)化
伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素屬于弱極性化合物,極易溶解于甲醇、乙腈,故此方法的建立選用反相色譜柱。本研究以含0.1%甲酸的超純水作為水相,0.1% 甲酸能促進分子的電離,大大增強檢測信號的強度;以乙腈作為有機相,隨著有機相比例的提高,目標物保留時間縮短,但色譜峰比較寬,靈敏度會隨之降低,若提高流速則保留時間太短分離效果比較差,故最終選擇梯度洗脫,以相對高的流速低比例的有機相作為起始流動相,既能在合適的時間內將4個化合物很好地分離,同時又提高了分析效率以及檢測的靈敏度。
2.3 樣品的提取
在動物組織樣品中,阿維菌素類藥物提取的常用溶劑為乙腈、甲醇、丙酮、甲苯和乙酸乙酯等。本試驗使用較為簡單的乙腈蛋白沉淀法,過程提取回收率約95%,符合要求,且步驟簡單,能大大提高樣品前處理的效率。
2.4 方法的線性范圍、定量限和檢測限
按“1.4.3”方法處理標準工作曲線,進樣10 μL,在本方法所確定的試驗條件下,利用Analyst 1.4.2軟件進行數據的采集與分析。以質量分數為橫坐標x、峰面積為縱坐標y進行線性回歸,權重因子為1/x2,測定20 ng/g加標空白樣品4種藥物定量離子信噪比,并用外推法計算最低檢出限,結果表明4種阿維菌素類藥物殘留在20~5 000 ng/g的范圍內呈較好的線性關系(圖1至圖4),得到4種藥品的線性方程、相關系數、線性范圍、檢出限、定量限(表3)。定量下限的信噪比分別為15.5、26.0、18.5、19.0,參見圖5至圖8,符合信噪比(RS/N)>10作為定量下限的要求。

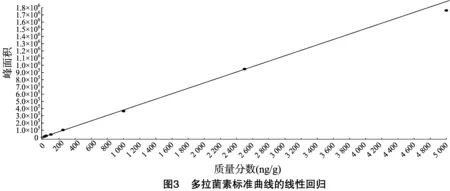
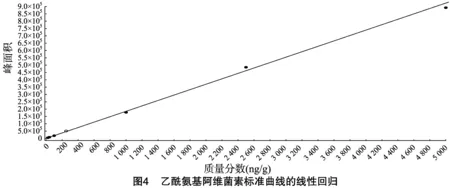
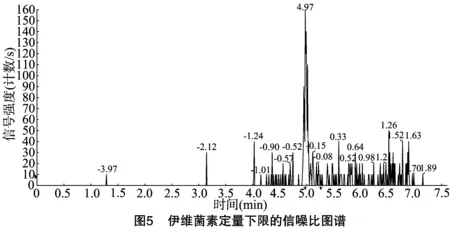
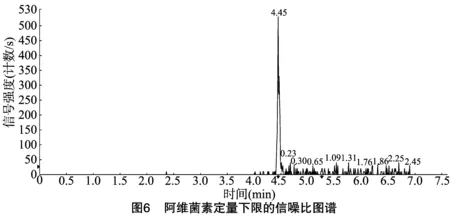
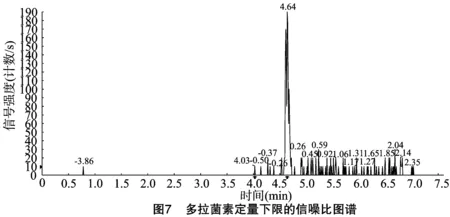
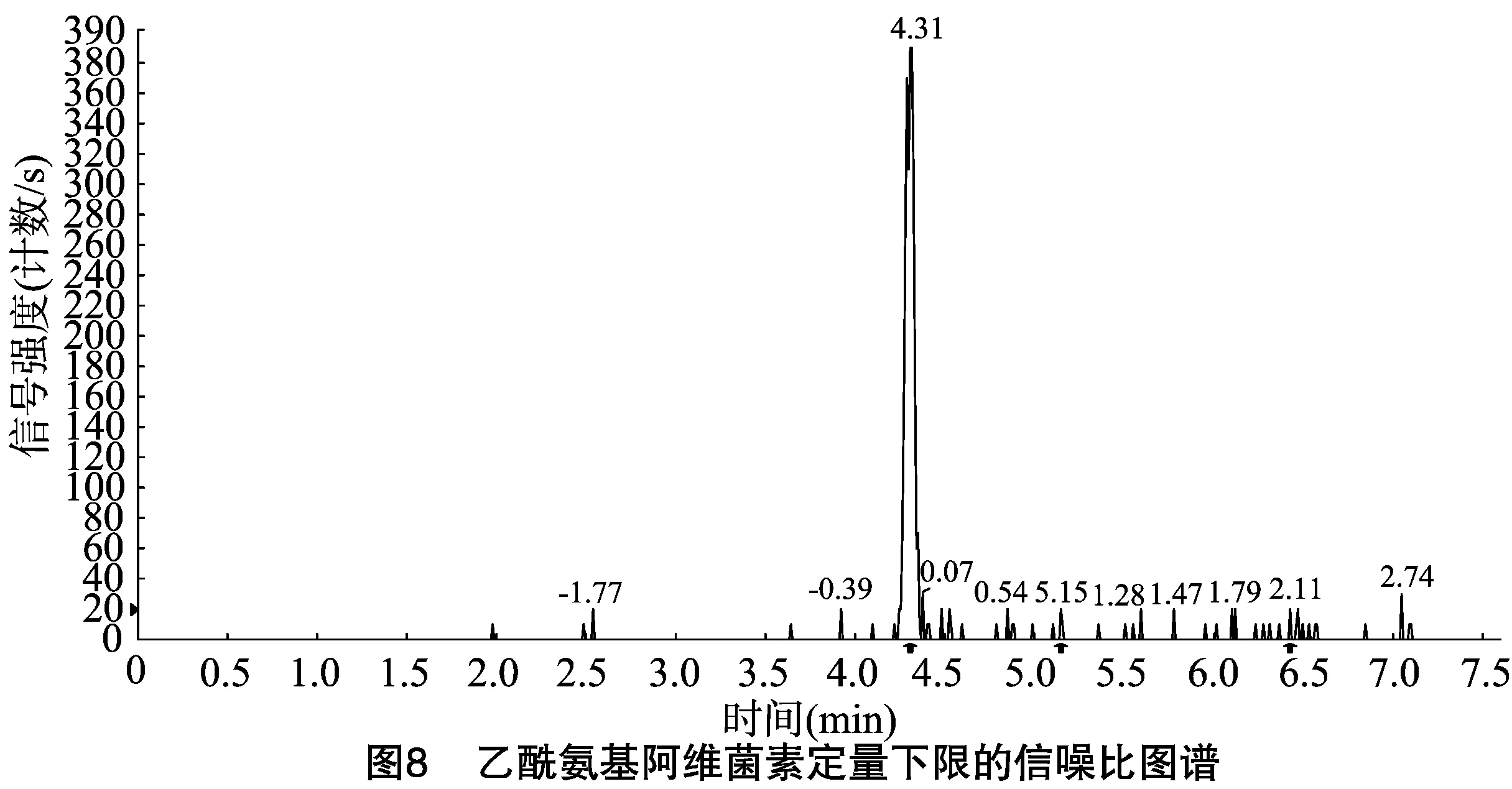
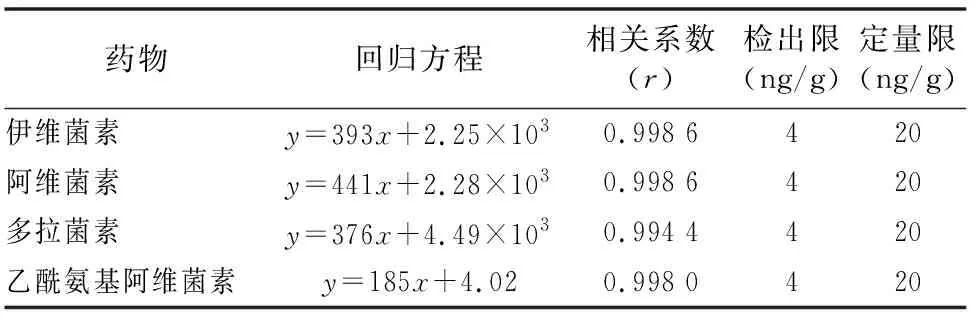
表3 4種阿維菌素類藥物的標準曲線回歸方程、相關系數、檢出限及定量限
2.5 添加回收率
4種藥物在50、500、4 000 μg/g添加水平下,平均回收率在92.89%~94.68%之間,RSD在1.26%~1.94%之間,說明本方法可以滿足雞肉中同時檢測伊維菌素、阿維菌素、多拉菌素和乙酰氨基阿維菌素的要求,方法回收率和相對標準偏差見表4。
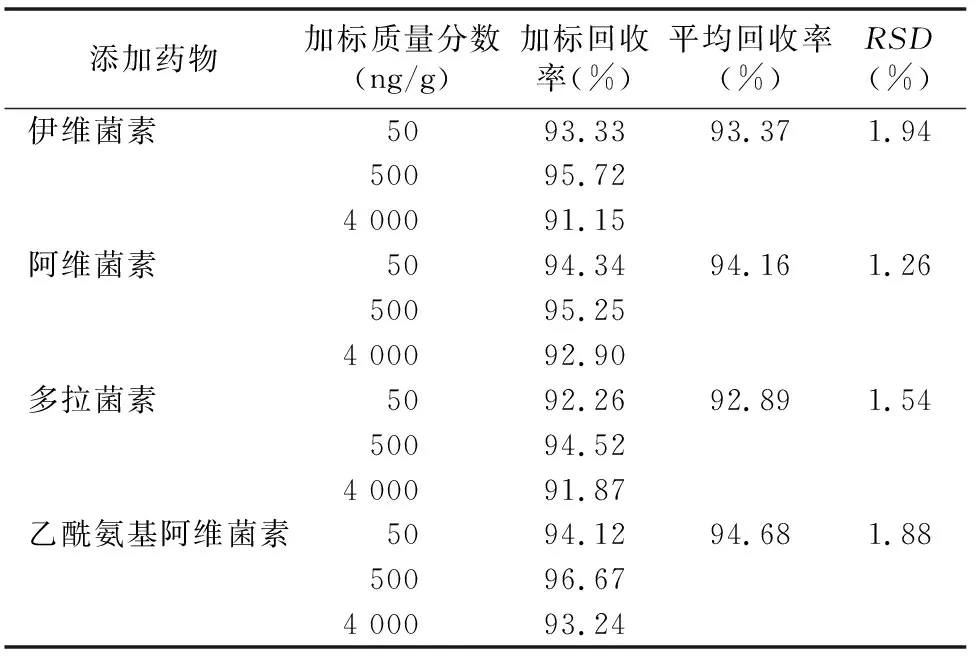
表4 伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素的加標回收率
2.6 給藥動物肌肉中藥物濃度的測定
給藥樣品經處理后進樣,利用Analyst 1.4.2軟件計算得到雞肉樣品中伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素的平均質量分數分別為126、105、134、141 ng/g(圖9)。
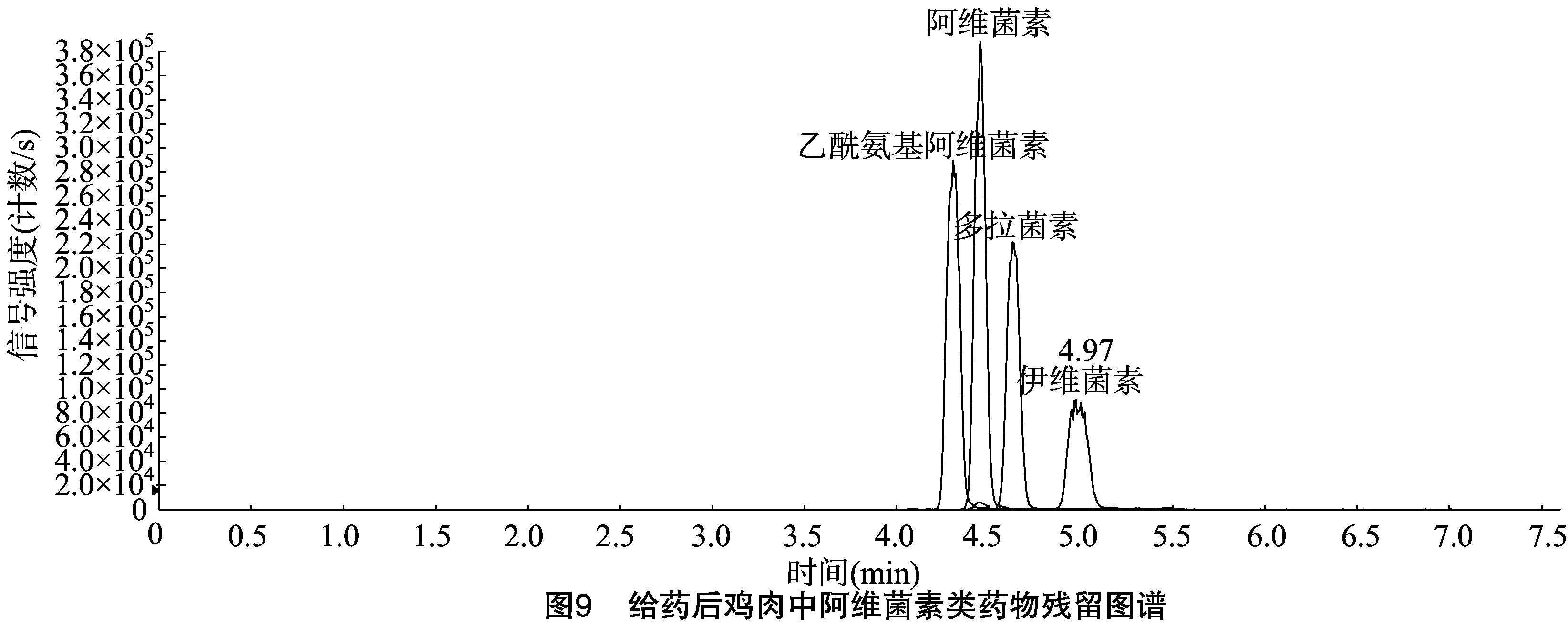
3 結論
有關雞肉中阿維菌素類藥物殘留檢測報道很少, 但在其他有關動物組織中阿維菌素類藥物殘留檢測方法報道很多,如李欣等采用UPLC-MS/MS建立牛肝中阿維菌素類藥物的多殘留檢測方法,以乙腈提取、氮氣吹干、疏水的甲基丙烯酸丁酯-乙二醇二甲基丙烯酸酯整體柱作為固相萃取介質,其平均回收率在77.4%~98.4%[8],而本法僅取0.2~0.5 g樣品,經50%乙腈高速勻漿后,取50 μL勻漿樣品,加入5 μL乙腈離心去蛋白,無需脫脂和固相萃取等操作,且無需氮吹濃縮。本方法操作簡單,出峰時間在4~5 min,分析快速,且方法的最低檢測限低于聯合國食品法典委員會(CAC)和我國對該類化合物的殘留限量10 ng/g。本研究建立的UPLC-MS/MS檢測禽肉中伊維菌素、阿維菌素、多拉菌素、乙酰氨基阿維菌素殘留檢測方法回收率、準確率高,能完全滿足禽肉中阿維菌素類藥物的殘留檢測與確證的需要。

