3種作物初期生長(zhǎng)對(duì)全氟辛烷磺酸鹽和全氟辛酸的響應(yīng)及富集特征
楊鴻波, 廖朝選, 趙亞洲, 謝 勛, 譚 紅
(1.北京化工大學(xué),北京 100029; 2.貴州省分析測(cè)試研究院,貴州貴陽(yáng) 550002)
全氟化合物具有極高的化學(xué)穩(wěn)定性和良好的疏水疏油性,在民用和工業(yè)產(chǎn)品生產(chǎn)中被廣泛應(yīng)用[1-2]。隨著經(jīng)濟(jì)的快速發(fā)展,大量的全氟化合物被暴露于環(huán)境中,通過(guò)呼吸和攝食被生物體吸收,在生物體內(nèi)蓄積,由于其持久性強(qiáng),已成為當(dāng)前環(huán)境中最難降解的污染物之一[3-4]。全氟辛烷磺酸鹽(perfluorooctane sulphonate,簡(jiǎn)稱PFOS)和全氟辛酸(perfluorooctanoic acid,簡(jiǎn)稱PFOA)是被普遍檢出的全氟化合物[5-6],具有高生物蓄積性,同時(shí)對(duì)生物體具有生殖毒性、免疫毒性、神經(jīng)內(nèi)分泌毒性、肝臟毒性、發(fā)育神經(jīng)毒性等[7-8],且由其引起的神經(jīng)毒性具有潛伏性,往往在個(gè)體成熟后才顯現(xiàn)出來(lái)[9];其中PFOA還可影響胚胎發(fā)育、生物行為,并可造成DNA損傷[10]。PFOS和PFOA的大量生產(chǎn)與廣泛利用,使得在動(dòng)、植物體內(nèi)被廣泛檢出,其對(duì)環(huán)境產(chǎn)生了嚴(yán)重危害[11];PFOS或PFOA通過(guò)人類攝食蔬菜、禽蛋、肉類等食物而間接進(jìn)入人體,正威脅著人類的健康。了解PFOS和PFOA對(duì)植物的生長(zhǎng)影響以及在體內(nèi)的分布,可為植物中全氟化合物的污染阻控提供數(shù)據(jù)支持。
針對(duì)PFOS和PFOA對(duì)植物生長(zhǎng)發(fā)育的影響,Stahl等在2009年率先系統(tǒng)研究春小麥、燕麥、馬鈴薯、玉米、多年生黑麥草等5種植物對(duì)土壤中PFOA和PFOS的生物利用性,結(jié)果發(fā)現(xiàn),0.25~50.00 mg/kg范圍內(nèi)高濃度的PFOA和PFOS對(duì)植物的生長(zhǎng)會(huì)產(chǎn)生影響,特別是對(duì)馬鈴薯而言,土壤中的PFOA和PFOS濃度就越高,植物中全氟化合物(perfluorinated compounds,簡(jiǎn)稱PFCs)濃度就越高,且營(yíng)養(yǎng)器官比儲(chǔ)能器官更敏感[12]。呂振娥等通過(guò)研究小麥、大麥、白菜、白車軸草、綠豆等5種植物在短期內(nèi)受PFOS的抑制作用發(fā)現(xiàn),小麥根伸長(zhǎng)的半效應(yīng)濃度(median effect concentration,簡(jiǎn)稱EC50)為352 mg/kg,最為敏感[13]。Qu等發(fā)現(xiàn),低濃度的PFOS可以輕微刺激小麥幼苗的生長(zhǎng),誘導(dǎo)小麥幼苗中葉綠素和可溶性蛋白質(zhì)的合成,而當(dāng)PFOS濃度超過(guò)10 mg/L時(shí)可抑制根生長(zhǎng),影響根、葉生物量,并阻礙葉綠素的累積和可溶性蛋白質(zhì)的合成[14]。由此可知,PFOA和PFOS可以被植物從土壤中吸收并對(duì)植物產(chǎn)生影響,但影響程度不同。
植物可以從土壤中吸收富集PFOS和PFOA,并由根部向莖葉部分遷移,且主要富集在植物的營(yíng)養(yǎng)器官中[15]。通過(guò)研究小麥對(duì)PFCs的吸收動(dòng)力學(xué)特性發(fā)現(xiàn),小麥根部對(duì)PFOA的吸收速度遠(yuǎn)大于PFOS,在暴露100 h時(shí),趨近于穩(wěn)定,且根部的吸收大于莖的吸收,溫度、鹽度、pH值、受試物濃度對(duì)根部吸收2種全氟化合物均具有一定程度的影響[16-17],總體來(lái)看,PFOS主要被根部吸收。Krippner等通過(guò)水培法研究3種全氟羧酸(perfluorocarboxylic acids,簡(jiǎn)稱PFCAs)和7種全氟烷基磺酸(perfluoroalkylsulfonic acids,簡(jiǎn)稱PFSAs)全氟化合物的碳鏈以及pH值對(duì)玉米富集全氟化合物的影響,結(jié)果發(fā)現(xiàn),玉米對(duì)PFSAs類化合物吸收速率最快的是長(zhǎng)鏈PFOS,短鏈PFCAs容易在莖葉中富集,長(zhǎng)鏈PFCAs和PFOS主要富集在根部[18]。在真實(shí)環(huán)境中,Zhang等通過(guò)分析遼寧省大連市闊葉和針葉植物中10種PFCAs和4種PFSAs的分布發(fā)現(xiàn),針葉對(duì)PFCAs和PFSAs的吸收均大于闊葉,葉片中PFCAs含量大于PFSAs,短鏈PFSAs含量高于長(zhǎng)鏈等[19]。
當(dāng)前,眾多專家學(xué)者使用小麥進(jìn)行了大量的吸收動(dòng)力學(xué)研究,并對(duì)比研究了植物對(duì)不同碳鏈及不同基團(tuán)全氟化合物的吸收作用,而對(duì)于相同碳鏈不同基團(tuán)的PFOA、PFOS在單獨(dú)和聯(lián)合作用的研究較少;不同作物對(duì)PFOA、PFOS的吸收利用情況不同,目前針對(duì)油類作物大豆、油菜以及糧食作物水稻對(duì)全氟化合物富集作用的研究較少。我國(guó)土壤中的PFOS、PFOA含量大多在5 ng/g以內(nèi),最高值為62.45 ng/g[20-22]。低濃度的PFOS會(huì)輕微刺激根的生長(zhǎng)和酶活性的提高,而當(dāng)濃度增至 200 mg/kg 時(shí),會(huì)抑制根的生長(zhǎng)和酶活性的提高,且會(huì)提高滲透性。研究PFOS和PFOA對(duì)水稻、大豆、油菜的生長(zhǎng)發(fā)育影響及在3種作物體內(nèi)的分布特征,以期為全面評(píng)價(jià)全氟化合物對(duì)人類的潛在危害提供理論數(shù)據(jù)支持。
1 材料與方法
1.1 試驗(yàn)材料
1.1.1 供試種子 禾本科單子葉植物水稻(Oryzasativa)種子由四川省綠丹種業(yè)有限責(zé)任公司生產(chǎn)(批次:201512);豆科雙子葉植物大豆(Glycinemax)種子由江西省豐城市航城種業(yè)有限公司生產(chǎn)(批次:20160303);十字花科雙子葉植物油菜(BrassicacampestrisL.)種子由貴州農(nóng)業(yè)科學(xué)研究院研制(批次:201609)。
試驗(yàn)前將作物種子在10%次氯酸鈉消毒液中浸泡 10 min,然后把種子轉(zhuǎn)移到培養(yǎng)皿中并用去離子水漂洗后浸泡,大豆種子浸泡20 min,油菜種子浸泡30 min,水稻種子浸泡1 h。
1.1.2 試驗(yàn)土壤 試驗(yàn)土壤為黃壤土,采集于貴州省植物園天然林內(nèi),未使用化肥并遠(yuǎn)離化學(xué)污染源,風(fēng)干后過(guò)2 mm篩備用。土壤的pH值為5.90,有機(jī)質(zhì)含量為2.92%,陽(yáng)離子交換量為18.1 cmol/kg。
1.1.3 儀器與設(shè)備 人工氣候培養(yǎng)箱(北京科偉永興儀器有限公司制造),箱內(nèi)密布LED燈。
試驗(yàn)用花盆為一次性花盆,直徑為18 cm,有效播種面積約為250 cm2,帶儲(chǔ)水盤。
液相色譜-質(zhì)譜聯(lián)用儀:Agilent LC-MS/MS,1290-6460 Agilent 1290 Infinity二元泵(G4220A),Agilent 1290 Infinity高效自動(dòng)進(jìn)樣器(G4226A),Agilent 1290 Infinity系列柱溫箱(G1316C),Agilent6460三重四級(jí)桿電噴霧離子源(electron spray ionization,簡(jiǎn)稱ESI),MassHunter (B.08.00)工作站。N-EVAP-24氮吹儀(美國(guó)Organomation Associates,Inc.制造)。梅特勒-托利多電子天平,測(cè)量精度為0.000 1 g;Milli-Q超純水儀(默克密理博公司制造)。
1.1.4 試劑與固相萃取柱 全氟辛烷磺酸鉀鹽(PFOS-K,CAS:2795-39-3,百靈威科技有限公司,純度>98%);全氟辛酸(PFOA,CAS:335-67-1,百靈威科技有限公司,純度>98%);甲醇(液相色譜-質(zhì)譜聯(lián)用級(jí),Merck Drugs & Biotechnology);丙酮[分析純,重慶川東化工(集團(tuán))有限公司];甲醇、氨水、甲酸、乙酸銨、異丙醇均為分析純,均購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司。
CNWBOND WAX弱陰離子交換固相萃取柱(solid-phase extraction,簡(jiǎn)稱SPE)(上海安普實(shí)驗(yàn)科技股份有限公司),500 mg×6 mL。
1.2 試驗(yàn)方法
1.2.1 濃度設(shè)置 分別設(shè)置1.0、5.0、25.0 mg/kg PFOS組和PFOA組,2.0、10.0、50.0 mg/kg聯(lián)和試驗(yàn)組(CPFOS∶CPFOA=1 ∶1)。
1.2.2 暴露試驗(yàn)土壤制備 準(zhǔn)確稱取0.287 0 g PFOS、0.287 1 g PFOA,分別置于25 mL容量瓶中,用丙酮溶解并稀釋得到濃度均為11.25 mg/mL的PFOS、PFOA儲(chǔ)備液。(1)PFOS試驗(yàn)組:分別取0.4、2.0、10.0 mL PFOS儲(chǔ)備液加入到3份質(zhì)量均為100 g的試驗(yàn)土壤中,攪拌混勻并揮干溶劑備用。另稱取4.4 kg試驗(yàn)土壤,將制備的100 g加藥土壤加入其中,趁干攪拌混勻,然后加入800 mL去離子水繼續(xù)攪拌混勻,得到1.0、5.0、25.0 mg/kg PFOS暴露試驗(yàn)土壤,然后將各濃度土壤平均分為3份置于花盆中備用。(2)PFOA試驗(yàn)組:取樣量與操作方法同PFOS試驗(yàn)組,且同樣將制備得到的1.0、5.0、25.0 mg/kg的PFOA暴露試驗(yàn)土壤平均分為3份置于花盆中備用。(3)聯(lián)和試驗(yàn)組(CPFOS∶CPFOA=1 ∶1):分別依次取PFOS、PFOA儲(chǔ)備液各0.4、2.0、10.0 mL 加入到3份質(zhì)量均為100 g的試驗(yàn)土壤中,攪拌混勻并揮干溶劑備用。另稱取4.4 kg試驗(yàn)土壤,將制備的100 g加藥土壤加入其中,趁干攪拌混勻,然后加入800 mL去離子水繼續(xù)攪拌混勻,得到2.0、10.0、50.0 mg/kg混合暴露試驗(yàn)土壤,然后將各濃度土壤平均分為3份置于花盆中備用。(4)對(duì)照組:取100 g試驗(yàn)土壤,加入20.0 mL丙酮,攪拌混勻并揮干溶劑備用。另稱取4.4 kg試驗(yàn)土壤,將制備的100 g加丙酮的土壤加入其中,趁干攪拌混勻,然后加入800 mL去離子水繼續(xù)攪拌混勻,得到對(duì)照組試驗(yàn)土壤,然后將該土壤平均分為3份置于花盆中備用。
1.2.3 暴露試驗(yàn) 參照GB/T 31270.19—2014《化學(xué)農(nóng)藥環(huán)境安全評(píng)價(jià)試驗(yàn)準(zhǔn)則》“第19部分:非靶標(biāo)植物影響試驗(yàn)”中300~1 000粒/m2的播種密度要求,結(jié)合種子大小與分析測(cè)試要求,每盆播種的種子數(shù)量為水稻20粒、大豆10粒、油菜25粒,種植密度分別約為800、400、1 000粒/m2。試驗(yàn)時(shí)將預(yù)處理后的水稻、大豆、油菜種子分別播種于各濃度系列及對(duì)照組的花盆中,然后置于培養(yǎng)箱中準(zhǔn)備試驗(yàn),并將儲(chǔ)水盤蓄水以保證試驗(yàn)所需水分供應(yīng)。培養(yǎng)箱的光—暗周期設(shè)置為16 h—8 h;光照時(shí)溫度為(25±2) ℃,黑暗時(shí)溫度為(22±2) ℃;在種子萌芽前,濕度保持在80%以上,種子萌芽后控制濕度在70%~85%之間。
試驗(yàn)開始后,記錄種子的出苗情況,并在對(duì)照組種子半數(shù)萌芽后第14天,取出各盆試驗(yàn)植物,進(jìn)行株高、生物量測(cè)定。
1.2.4 全氟化合物在植物體內(nèi)的分布特征分析 將各植物根、莖、葉分離并分別剪碎制得的根、莖、葉樣品。稱取1.0 g樣品,加20 mL甲醇振蕩提取,經(jīng)渦旋、離心處理使其上部澄清;然后取1 mL上清液,加入5 mL 2%甲酸水溶液,經(jīng)渦旋處理后制備得試樣初提取液。
取wax-SPE小柱,使用2 mL甲醇和1 mL去離子水分別活化,再使用2%甲酸水溶液平衡。然后將試樣初提取液加入柱中,使用2 mL 2%甲酸水溶液淋洗,再用4 mL 3%氨化甲醇洗脫,經(jīng)氮?dú)獯蹈珊螅眉状己退?體積比為1 ∶1)混合液定容至1 mL,制備得試樣提取液,然后用液相色譜-質(zhì)譜聯(lián)用儀測(cè)定。試驗(yàn)時(shí)分別使用莖、葉、根進(jìn)行基質(zhì)加標(biāo)回收率試驗(yàn),其回收率在88.9%~98.4%之間,樣品的測(cè)定不進(jìn)行回收率校正。
儀器及條件為色譜柱:Agilent ZORBAX Eclipse Plus C18,2.1 mm×50 mm,1.8 μm;柱溫為40 ℃;進(jìn)樣體積為2 μL;進(jìn)樣針沖洗 ∶端口清洗(異丙醇 ∶水體積比為1 ∶1),2 s;流動(dòng)相:A=5 mmol/L 乙酸銨水溶液,B=甲醇,流速為 0.20 mL/min。梯度洗脫程序:0~0.50 min,70.00% A+30.00% B;0.51 min,50.00% A+50.00% B;4.50 min,20.00% A+80.00% B;5.00 min,70.00% A+30.00% B,總運(yùn)行時(shí)間6 min(平衡時(shí)間1 min)。質(zhì)譜(mass spectrometry,簡(jiǎn)稱MS)配置和條件:負(fù)離子模式;掃描模式:多反應(yīng)監(jiān)測(cè)(multiple reaction monitoring,簡(jiǎn)稱MRM),毛細(xì)管電壓為 -3 500 V,噴嘴電壓為-500 V,霧化器壓力為0.31 MPa,干燥器溫度為300 ℃,干燥器流速為6 L/min,鞘氣溫度為300 ℃,鞘氣流速為10 L/min,電子倍增器電壓為400 V,質(zhì)譜MRM參數(shù)見表1。
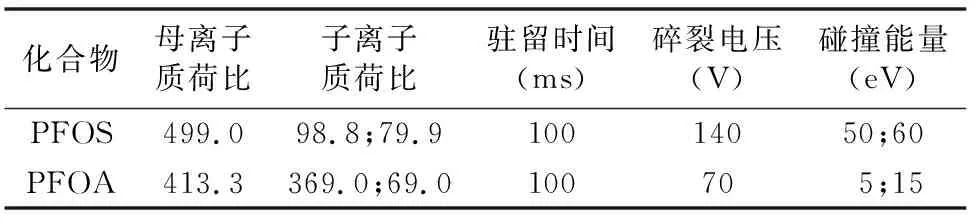
表1 質(zhì)譜儀參數(shù)
1.2.5 數(shù)據(jù)分析 PFOS和PFOA對(duì)作物出苗率、株高、生物量的影響采用SPSS 11.5軟件進(jìn)行統(tǒng)計(jì)和分析,以P<0.05作為顯著性差異水平。
采用莖、葉、根對(duì)PFOS和PFOA的富集因子(root concentration factor,簡(jiǎn)稱RCF)、傳輸因子(transfer factor,簡(jiǎn)稱TF)進(jìn)行作物體內(nèi)的富集體征分析,并評(píng)價(jià)其對(duì)植物的潛在影響。采用色譜工作站MussHunter對(duì)數(shù)據(jù)進(jìn)行采集和定量分析,采用Origin Pro 8.0對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)和繪圖。根富集因子[9]的計(jì)算公式為
(1)
式中:C根為作物根中PFOS或PFOA濃度,mg/kg干基;C土壤為有機(jī)質(zhì)歸一化后土壤中PFOS或PFOA濃度,mg/kgoc干基。
傳輸因子可指示供試植物自根向莖、葉傳輸化合物的能力,其計(jì)算公式為
(2)
式中:C莖葉為作物莖、葉中PFOS、PFOA濃度,mg/kg干基;C根為作物根中PFOS、PFOA濃度,mg/kg干基。
2 結(jié)果與分析
2.1 PFOS、PFOA對(duì)3種植物出苗率、株高、生物量的影響
在各濃度的PFOS、PFOA暴露試驗(yàn)土壤以及PFOS和PFOA混合暴露試驗(yàn)土壤中,所有種子全部發(fā)芽;水稻株高約30 cm,生物量約0.055 g/株;大豆株高約21 cm,生物量約 0.53 g/株;油菜株高約3.4 cm,生物量約0.007 g/株,對(duì)照組與各處理組出苗率、株高、生物量差異較小。
2.2 PFOS、PFOA在3種植物植株根內(nèi)的富集情況
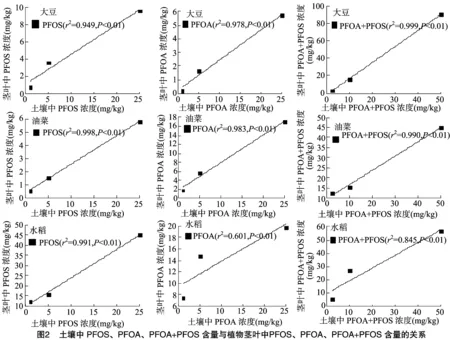
由圖1可知,水稻、大豆、油菜根中PFOS、PFOA濃度與土壤中供試物濃度均呈極顯著的線性相關(guān)關(guān)系,且隨土壤中供試物濃度的增大而增加。與Stahl等的結(jié)論[12]相似,即隨著土壤中PFOS、PFOA濃度的增加,PFOS、PFOA向植物中轉(zhuǎn)移的量也增加。
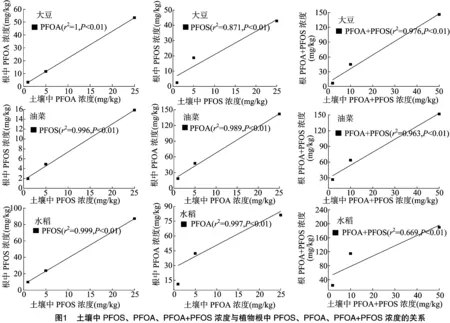
由表2、表3可知,PFOS在水稻、大豆、油菜根中的富集濃度分別為9.9~87.0、2.4~42.8、1.9~15.9 mg/kg,經(jīng)有機(jī)質(zhì)歸一化后其富集因子分別為0.103~0.292、0.051~0.111、0.019~0.058,表明3種作物對(duì)PFOS的富集能力表現(xiàn)為水稻>大豆>油菜;水稻、大豆、油菜對(duì)PFOS的傳輸因子分別為 0.220~0.262、0.193~0.345、0.316~0.368,均小于1,表明3種植物均可自根向莖葉傳輸PFOS,根中濃度大于莖葉[11]。
PFOA在水稻、大豆、油菜根中的富集濃度分別為11.0~81.1,3.3~53.4,18.6~141.7 mg/kg,經(jīng)有機(jī)質(zhì)歸一化后其富集因子分別為0.096~0.368、0.063~0.097、0.168~0.549,表明3種作物對(duì)PFOA的富集能力表現(xiàn)為油菜>水稻>大豆;水稻、大豆、油菜對(duì)PFOA的傳輸因子分別為 0.236~0.675、0.056~0.143、0.099~0.120,均小于1,表明3種植物均可自根向莖葉傳輸PFOA,根中濃度大于莖葉。
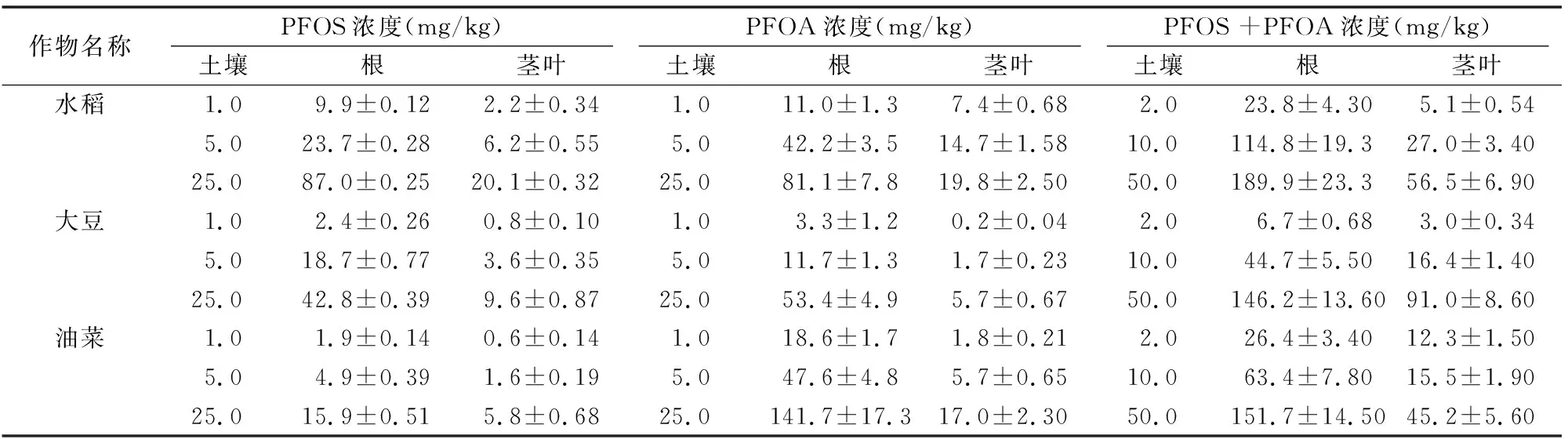
表2 3種植物對(duì)PFOS和PFOA的富集情況
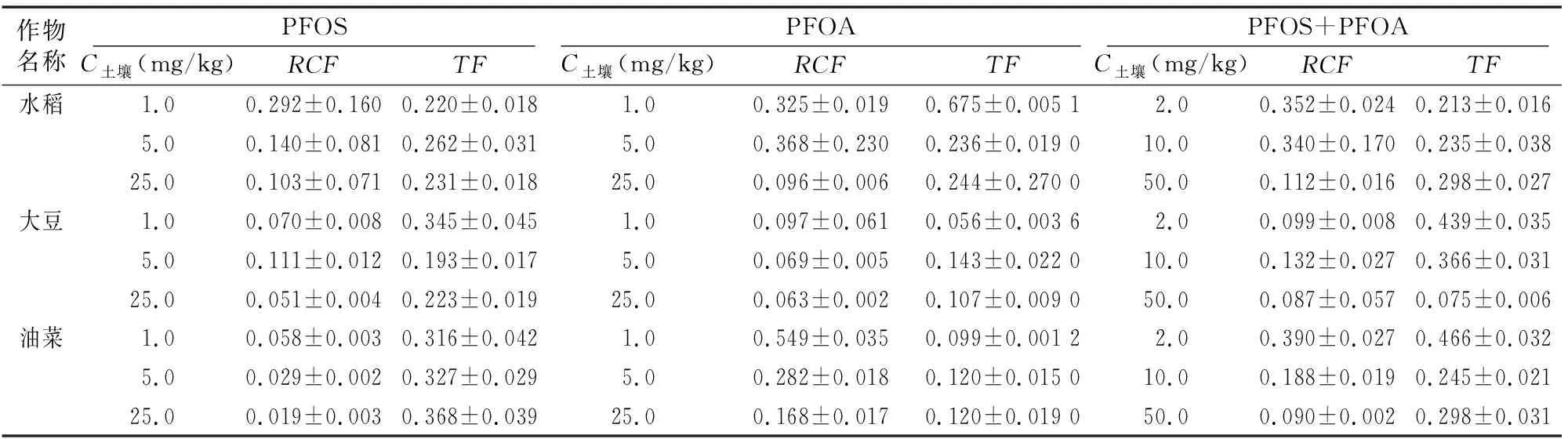
表3 3種植物對(duì)PFOA、PFOS的RCF和TF
由圖2可以看出,在PFOS、PFOA聯(lián)和試驗(yàn)中,3種作物對(duì)PFOS、PFOA的富集量隨供試物濃度增大而增加,與單獨(dú)試驗(yàn)一致;由表2可知,水稻、大豆、油菜根中的富集濃度分別為23.8~189.9、6.7~146.2、26.4~151.7 mg/kg,莖葉中的富集濃度分別為5.1~56.5、3.0~91.0、12.3~45.2 mg/kg,PFOS、PFOA聯(lián)合試驗(yàn)與單獨(dú)試驗(yàn)的總富集量無(wú)明顯差異。
3 討論
當(dāng)土壤中PFOS、PFOA濃度為1.0~25.0 mg/kg時(shí),PFOS、PFOA對(duì)水稻、大豆、油菜的出苗率、株高、生物量均無(wú)明顯影響,這與趙淑艷研究中PFAs對(duì)小麥的生物量無(wú)明顯影響[15]一致。水稻和小麥、大豆、油菜分別所屬的禾本科、豆科、十字花科農(nóng)作物在我國(guó)種植范圍最廣、生產(chǎn)量最多,表明在當(dāng)前土壤背景下,PFOS和PFOA不足以影響作物的生產(chǎn)。但在Zhou等的研究中,當(dāng)PFOS的濃度升高至200 mg/L時(shí),超氧化物歧化酶(superoxide dismutase,簡(jiǎn)稱SOD)和過(guò)氧化物酶(peroxidase,簡(jiǎn)稱POD)活性明顯降低[23],表明在高濃度PFOS條件下,小麥幼苗抗氧化防御系統(tǒng)可能會(huì)受到損害,PFOS和PFOA對(duì)作物的影響仍不可忽視。
植物中的PFOS、PFOA濃度與土壤中的PFOS、PFOA濃度呈線性相關(guān)關(guān)系,且隨土壤中供試物濃度的增大而增加。在3種植物中,不管PFOS、PFOA是單獨(dú)存在,還是等比例存在于土壤中時(shí),在植物根部的富集量均高于在莖葉中的富集量。Wen等研究發(fā)現(xiàn),較短鏈全氟磺酸(perfluorosulfonic acids,簡(jiǎn)稱PFSAs)主要通過(guò)轉(zhuǎn)移集中在莖葉中,而長(zhǎng)鏈PFCAs如全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟癸酸(PFDA)、全氟辛烷磺酸己烷磺酸(PFHxS)、全氟辛烷磺酸(PFOS),主要通過(guò)吸收集中在根部[24],由于二者具有相同的碳鏈結(jié)構(gòu)(C>4),說(shuō)明在由土壤轉(zhuǎn)移到根部時(shí),由土壤轉(zhuǎn)移到根部時(shí),土壤孔隙中的化合物經(jīng)被動(dòng)擴(kuò)散被植物根吸收,再經(jīng)過(guò)木質(zhì)部的水相或韌皮部汁液的蒸騰作用轉(zhuǎn)移到植物體內(nèi),起主要作用的是親脂性結(jié)構(gòu)端;從韌皮部汁液到莖葉的傳輸過(guò)程中,水溶性更強(qiáng)的有機(jī)物能更多地從根部傳輸?shù)角o葉,PFOS和PFOA的親水端不同,所以二者的TF不同。同時(shí)也有研究發(fā)現(xiàn),植物根系中PFOS、PFOA的累積量與根系蛋白質(zhì)含量呈顯著正相關(guān)關(guān)系(P<0.05),而與根系脂肪含量呈顯著負(fù)相關(guān)關(guān)系(P<0.05),表明蛋白質(zhì)對(duì)根吸收PFOS、PFOA具有促進(jìn)作用,脂質(zhì)具有抑制作用;傳輸因子與莖葉和根中蛋白質(zhì)含量比例呈正相關(guān)關(guān)系[25],說(shuō)明蛋白質(zhì)和脂質(zhì)對(duì)PFOS的積累和分布作用不同; 而在PFOA和PFOS聯(lián)合作用時(shí),未體現(xiàn)協(xié)同作用,只是濃度加和作用,即PFSAs在植物中的傳輸和富集作用機(jī)制會(huì)因?yàn)橹参锏牟煌煌瑫r(shí)受土壤中有機(jī)碳影響。進(jìn)一步的機(jī)制還須要更深入的研究。