低能離子注入對叢枝菌根真菌及其與蒺藜苜蓿共生的影響
陳 浩,石 磊,解繼紅,宋智青
(1.內蒙古工業大學,內蒙古呼和浩特010051;2.內蒙古醫科大學,內蒙古呼和浩特 010110;3.中國農業科學院草原研究所,內蒙古呼和浩特 010010)
20世紀80年代中期,余增亮研究員帶領的研究組首先將低能離子注入技術應用于農作物的誘變育種,發現低能離子注入作為一種新的生物誘變源具有損傷輕、突變率高、突變譜廣的特點。該技術關聯度高、影響面廣,用于農作物和微生物育種取得一系列成果,是一種行之有效的誘變方法[1-4]。與此同時,低能離子注入的當代刺激效應也能夠促進微生物和植物生長,這些作用對于物種的改良都十分重要。然而,關于低能離子注入對植物根部微生物影響的研究很少,限制它的應用。
叢枝菌根真菌(ArbuscularMycorrhizalfungi,AMF)是一種專性共生真菌,而叢枝菌根(ArbuscularMycorrhiza,AM)是由叢枝菌根真菌與植物形成的共生聯合體,是地球上分布最廣泛的共生體。叢枝菌根真菌能夠侵染包括豆科牧草在內的80%的陸生植物,它能夠從土壤中吸收礦質元素,如N、P等,并傳輸給植物促進其生長,同時也從植物體中吸收碳水化合物和脂類[5-8]。但是,當叢枝菌根共生體暴露在土壤中時,土壤環境中的負面因素(如鹽堿、干旱、低溫、污染物等)對其孢子的萌發、菌群落的變化、繁殖也有一定的影響,必然會影響叢枝菌根的形成及功能,進而影響叢枝菌根的接種效果。如果能將低能離子束生物技術應用于叢枝菌根真菌的品質改良,則可望提高叢枝菌根真菌利用的效果。蒺藜苜蓿(Medicagotruncatula)因與其他重要作物如大豆、紫花苜蓿親緣關系很近,而且具有其他豆科植物所不具有的遺傳特性而被人們選擇為研究豆科的模式植物[9]。同時,蒺藜苜蓿可以和叢枝菌根真菌形成良好的共生關系。因此,蒺藜苜蓿是用來研究叢枝菌根共生的優良材料。
選定豆科模式植物——蒺藜苜蓿為宿主,以光自養培養體系共生培養,研究低能離子注入對叢枝菌根真菌生長及其與蒺藜苜蓿共生的影響,探討提高蒺藜苜蓿-叢枝菌根共生體系在逆境生存力的方法,為提高豆科牧草抗逆性的研究提供新思路和新方法。
1 材料與方法
1.1供試菌種GlomusetunicatumBecker&Gerdemann由美國康奈爾大學Teresa E.Pawlowska 博士饋贈。
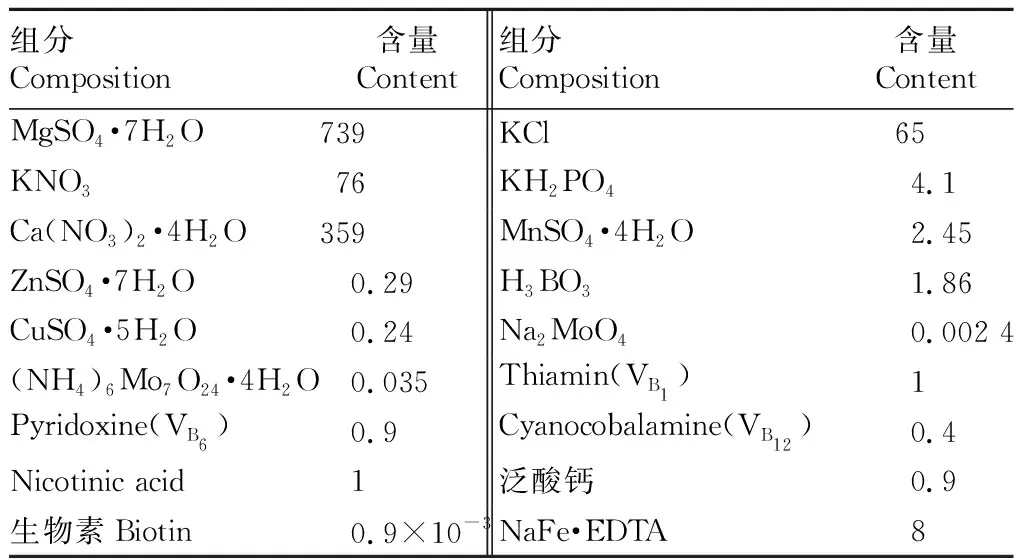
1.2寄主及培養基蒺藜苜蓿(Medicagotruncatula,ecotype Jemalong A17)由美國明尼蘇達大學N.D.Young博士饋贈。蒺藜苜蓿和叢枝菌根真菌都是在MSR培養基上生長(modified Strullu-Romand medium)[10]。MSR培養基成分見表1。
1.3叢枝菌根真菌孢子的無菌提取當AMF新生孢子成熟后,將含有孢子的培養基放入無菌錐形瓶中,加入10倍體積無菌的10 mmol/L檸檬酸鈉,并充分攪拌至孢子和菌絲分離。用200目尼龍網過濾得到孢子,以去除殘留的檸檬酸鈉,再用無菌水將孢子洗下,在解剖鏡下將孢子用20 μL移液器收集到無菌的1.5 mL離心管中待用[11]。
表1MSR培養基組分
Table1ThecompositionofmodifiedStrullu-Romand(MSR)mediamg/L
組分Composition含量Content組分Composition含量ContentMgSO4·7H2O739 KCl65 KNO376KH2PO44.1Ca(NO3)2·4H2O359MnSO4·4H2O2.45ZnSO4·7H2O0.29H3BO31.86CuSO4·5H2O0.24Na2Mo O40.002 4(NH4)6Mo7O24·4H2O0.035Thiamin(VB1)1Pyridoxine(VB6)0.9Cyanocobalamine(VB12)0.4Nicotinic acid1泛酸鈣0.9生物素Biotin0.9×10-3NaFe·EDTA8
注:調節pH,121℃高壓蒸汽滅菌15 min
Note:Regulating pH,high pressure steam sterilization for 15 min at 121 ℃
1.4低能離子注入注入裝置為低能離子注入機(IBBe-Device)。注入離子為Ar離子,劑量為0(CK1),1.25×1015,2.50×1015,3.75×1015,5.00×1015,6.25×1015,7.50×1015ions/cm2,以真空作對照組(CK2)。能量為30 keV,脈沖注入,每個脈沖注入1.25×1015ions/cm2,脈沖之間間隔30 s,真空度為0.05 Pa。真空對照置于注入托盤上,除了沒有接受離子注入外,其他條件及后續處理均與處理組一致。
1.5孢子萌發率和菌絲長度檢測每個平皿中接入 80~100 個提取的Glomusetunicatum無菌孢子。用Parafilm膜封口后,于 28 ℃黑暗倒置培養 10 d。取出置于解剖鏡(Motic K-700 L)下統計孢子萌發率,于顯微鏡(Olympus X51)下統計菌絲長度,每組處理重復3次。 相對菌絲長度計算公式如下:
相對菌絲長度(%)= 處理組孢子菌絲長度/對照組孢子菌絲長度×100%
(1)
1.6光自養培養體系和侵染率的檢測光自養培養體系裝置分2個部分:苗室和菌根室。菌根室中加入約40 mL MSR培養基(用0.3%Phytogel固定,不含蔗糖和維生素)。將萌發3 d的幼苗移入菌根室,并將幼苗頂端插入苗室底部與菌根室相連的孔中,然后將約20粒上述方法得到的孢子加入到幼苗根旁,用封口膜將培養皿封住。將裝置放入光照培養箱中25 ℃培養,光照周期為16 h白天/8 h夜晚。
培養8周后,將根從菌根室中取出后,FAA固定液固定1 d,然后用10%KOH(W/V)溶液90 ℃消化1~2 h,除去根中的細胞質,以便于觀察。將根浸入1%HCl中酸化3~5 min后用臺盼藍染色[11],進行侵染率檢測。
1.7后代孢子產量和根外菌絲長度的統計后代孢子數量在解剖鏡下鏡檢;于顯微鏡(Olympus X51)下統計根外菌絲長度。相對孢子產量、相對根外菌絲長度計算公式如下:
相對孢子產量(%)= 處理組孢子產量/對照組孢子產量×100%
(2)
相對根外菌絲長度(%)=處理組根外菌絲長度/對照組根外菌絲長度×100%
(3)
1.8數據分析利用t檢驗進行統計學意義分析,當P<0.05 時,視作差異顯著。
2 結果與分析
2.1離子注入對叢枝菌根真菌孢子萌發的影響試驗結果表明,1.25×1015、2.50×1015、3.75×1015、5.00×1015、6.25×1015、7.50×1015ions/cm2劑量組孢子萌發率分別為76.7%、78.9%、70.3%、57.9%、34.3%、21.5%,CK1孢子萌發率為70.4%,CK2孢子萌發率為71.7%,各劑量組孢子萌發率與CK1差異顯著。
可以看出,不同劑量的低能離子注入對叢枝菌根真菌孢子萌發率產生不同的影響。1.25×1015、2.50×1015ions/cm2劑量組顯著提高孢子萌發率;5.00×1015ions/cm2及以上劑量組抑制孢子萌發,其中6.25×1015ions/cm2劑量組可將孢子萌發率降至對照組的50%左右。出于當代刺激效應和誘變效應兩方面的考慮,選取2.50×1015、6.25×1015ions/cm2兩劑組量進行后續研究。
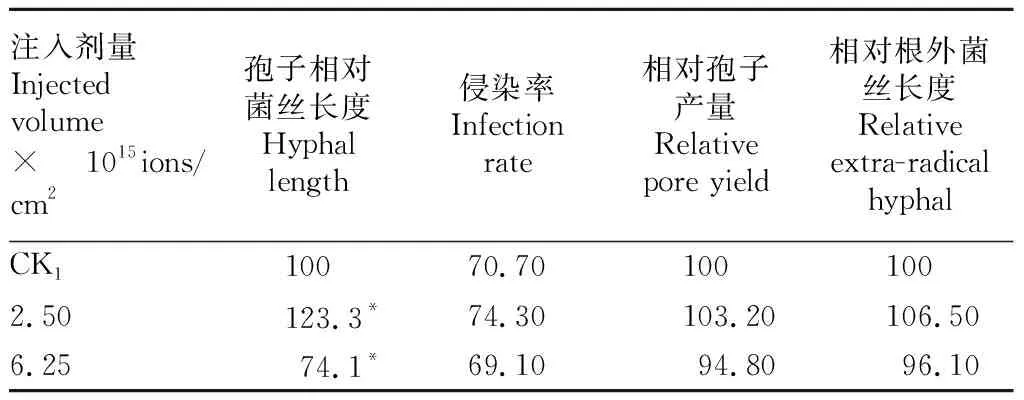
2.2離子注入對叢枝菌根真菌早期菌絲生長的影響由表2可知,2.50×1015ions/cm2劑量組孢子相對菌絲長度為123.3%,顯著促進了菌絲的生長,而6.25×1015ions/cm2劑量組孢子相對菌絲長度為74.1%,抑制菌絲的生長。說明不同劑量的低能離子注入會對叢枝菌根真菌早期的菌絲生長造成不同程度的影響。
表2離子注入對叢枝菌根真菌菌絲長度、真菌侵染率、相對孢子產量、相對根外菌絲長度的影響
Table2Effectofionirradiationonhyphallength,colonizationrate,relativeporeyieldandrelativeextra-radicalhyphalofArbuscularMycorrhizalfungi%
注入劑量Injected volume×1015ions/cm2孢子相對菌絲長度Hyphallength侵染率Infection rate相對孢子產量Relativepore yield相對根外菌絲長度Relativeextra-radicalhyphalCK110070.701001002.50123.3*74.30103.20106.506.2574.1*69.1094.8096.10
注:*表示與CK1差異顯著
Note:* stands for significant differences with CK1
2.3離子注入對叢枝菌根真菌與蒺藜苜蓿共生的影響
2.3.1離子注入對叢枝菌根真菌侵染率的影響。叢枝菌根真菌的侵染效果是共生建立的關鍵因素。由表2可知,各處理組對侵染率影響均不顯著。說明低能離子注入雖然影響了叢枝菌根真菌早期生長,但其與蒺藜苜蓿的共生關系仍可正常建立。
2.3.2離子注入對叢枝菌根真菌后代孢子和根外菌絲生長的影響。由表2可知,各處理組對后代孢子產量和根外菌絲的生長無顯著影響。說明離子注入的叢枝菌根真菌與蒺藜苜蓿建立共生關系后,仍可正常的完成其生命周期。
3 結論與討論
目前,低能離子注入對叢枝菌根真菌影響的研究極少。該研究結果表明,不同劑量的Ar離子注入對叢枝菌根真菌孢子萌發率產生不同的影響:1.25×1015、2.50×1015ions/cm2劑量組顯著提高孢子萌發率;5.00×1015ions/cm2及以上劑量組抑制孢子萌發,其中6.25×1015ions/cm2劑量處理可將孢子萌發率降至對照組的50%左右。出于利用當代刺激效應和誘變效應兩方面的考慮,選取2.50×1015、6.25×1015ions/cm2兩劑量組進行后續研究。2.50×1015ions/cm2劑量組顯著促進菌絲的生長,而6.25×1015ions/cm2劑量組抑制菌絲的生長。孢子萌發率和菌絲的生長是叢枝菌根真菌初期生命活力的表征,低劑量的離子注入促進這些指標上升,對于在逆境中提高叢枝菌根真菌的活力有重要意義。而高劑量的離子注入抑制叢枝菌根真菌的存活和初期的生長,說明離子注入可能會對其產生誘變效應。
由于專性共生的特點,菌根真菌對宿主植物根系的侵染是其生長發育的先決條件,而侵染率是直接反映AM真菌對宿主植物親和性的指標。侵染率的高低會影響菌根真菌從宿主植物獲取碳水化合物的能力,進而影響菌根真菌的生長發育如根外孢子萌發以及菌絲生長等。AM 真菌的根外真菌生物量直接反映后代根外真菌的生長狀況,其中包括孢子和菌絲的數量。在該試驗中,各處理組對后代侵染率、孢子產量和根外菌絲的生長均無顯著影響。說明離子注入雖然會對AM真菌早期生長產生影響,但叢枝菌根真菌仍可完成其生命周期,菌與根的共生仍然能夠建立。這種結果意味著可以在高劑量離子注入后,對叢枝菌根真菌的生長進行長期的觀測和篩選,這對于叢枝菌根真菌的離子束誘變育種工作具有重大意義。

