OSAHS致血管痙攣性心絞痛
康晚秋 張愛東
血管痙攣性心絞痛(vasospastic angina, VSA)的典型特征是靜息型心絞痛能被硝酸酯類藥物及鈣通道阻滯劑緩解, 但臨床上仍存在部分患者對上述兩種藥物治療無效, 日本厚生勞動省(Ministry of Health, Labour, and Welfare, MHLW)的相關研究將其定義為難治性VSA[1]。尚無針對難治性VSA危險因素的相關研究, 且VSA的危險因素尚未完全明確。目前認為, 吸煙是VSA確切的危險因素, 糖尿病、高血壓與其無明顯關系, 血脂異常與其關系尚未明確[2], 鮮有報告指出阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea hypopnea syndrome, OSAHS)與難治性VSA的發病有關。本院收治1例重度OSAHS致難治性VSA的患者, 現報告如下。
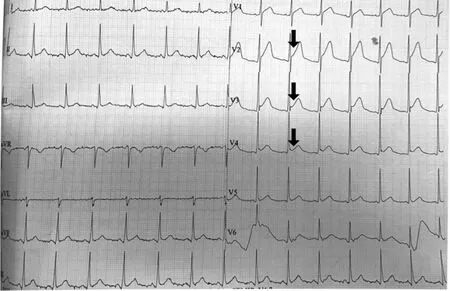
圖1 患者夜間心絞痛發作時的心電圖
1 臨床資料
患者, 男, 46歲, 因“反復胸悶2月余, 加重1周”入院,2月余前于夜間臥床休息時出現胸痛, 主要為心前區刺痛感,伴胸悶、氣促、呼吸困難, 端坐位深呼吸后癥狀逐漸緩解,持續約4 min, 之后上述癥狀反復, 多于夜間睡眠時發作, 發作約2~3次/周。曾多次至本院呼吸內科、心血管內科門診就診,肺功能檢查未見異常, 診斷未明確, 給予“單硝酸異山梨酯片(欣康)、酒石酸美托洛爾片(倍他樂克)、培哚普利吲達帕胺片(百普樂)、孟魯司特鈉(順爾寧)”等藥物治療后未見好轉。入院1周前自覺胸痛癥狀加重, 持續時間>1 h, 端坐位深呼吸未見明顯緩解, 遂至本院門診就診, 擬診“胸痛查因”收入心血管內科。既往有高血壓病史, 家族史無特殊。吸煙20余年, 1包/2 d。查體:體溫:36.8℃, 脈搏:113次/min,呼吸:18次/min, 血壓:103/79 mm Hg(1 mm Hg=0.133 kPa),體質量指數:21.2 kg/m2, 心、肺、腹部及神經系統查體未見異常。實驗室及輔助檢查:總膽固醇:4.32 mmol/L、低密度脂蛋白膽固醇:2.90 mmol/L;心肌損傷標志物正常。入院時心電圖提示:竇性心動過速。心臟彩超:心內結構未見異常,左室射血分數(LVEF):68%, A/E:1.21, 左室舒張功能降低。肺動脈電子計算機斷層掃描血管造影(CTA)、胸片未見異常。入院當晚約22:30患者平臥睡眠時再次發作胸痛, 床邊心電圖提示:V2~V4導聯ST段抬高(見圖1)。給予“硝酸甘油0.5 mg 舌下含服”后癥狀緩解, 約10 min后再次行床邊心電圖檢查提示ST段明顯回落(見圖2)。次日冠狀動脈造影提示:左前降支(LAD)中段斑塊形成, 前向血流心肌梗死溶栓治療(TIMI)3級, 冠狀動脈左旋支(LCX)及右冠狀動脈(RCA)無狹窄。考慮患者胸痛癥狀為冠狀動脈痙攣所致, 囑患者戒煙, 并予“欣康、鹽酸地爾硫卓緩釋膠囊(合貝爽)、富馬酸比索洛爾片(康忻)、阿托伐他汀鈣片(立普妥)、鹽酸曲美他嗪片(萬爽力)”等藥物治療后好轉出院。出院后胸痛仍反復于夜間發作, 約1個月后再次返院, 追問病史, 其愛人介紹患者有長期夜間打鼾史, 行多導睡眠檢測結果提示:暫停低通氣指數(AHI)=41.0, OSAHS重度。在原有治療的基礎上試用持續正壓通氣(cotinuous positive airway pressure, CPAP)治療, 1周后患者胸痛發作頻率明顯減少;6個月后門診隨訪,將CPAP使用頻率改為2次/周, 癥狀未再次發作。

圖2 患者含服硝酸甘油約10 min后的心電圖
2 討論
VSA的流行病學資料比較缺乏。在歐洲和日本進行的多中心藥物激發試驗提示日本患者的血管反應性更高[3], 這是否意味著日本人VSA的發病率高于高加索人尚不確定。我國可能也是VSA的高發地區, 2005年向定成等[4]報告在靜息型胸痛且冠狀動脈造影狹窄<50%的小樣本人群中行乙酰膽堿激發試驗, 陽性率高達75%。長期以來日本較重視VSA的研究, 大多數VSA的臨床研究來自日本, 但僅有一項日本的研究對難治性VSA進行了簡單的概述[1], 來自15個醫療中心因胸痛入院的2251例日本患者中, 921例(40.9%)被診斷為VSA, 而其中有126例難治性VSA患者, 高達13.7%, 難治性VSA好發于中青年人, 且發病人群中吸煙率較高。
2017年冠狀動脈血管舒縮障礙國際研究組發布了《血管痙攣性心絞痛國際標準化診斷標準》[2], 指出“確診的VSA”診斷應符合以下特征:硝酸酯類藥物對心絞痛癥狀具有明顯的緩解作用, 并可見短暫的缺血性心電圖變化或者滿足冠狀動脈痙攣標準。短暫的缺血性心電圖變化是指發病時至少在相鄰的兩個導聯出現以下任意改變:①ST段抬高≥0.1 mV;②ST段壓低≥0.1 mV;③新的負向U波。難治性VSA的定義在日本《血管痙攣性心絞痛(冠脈痙攣性心絞痛)診斷和治療指南》中有所提及, 即為對硝酸酯類和鈣通道阻滯劑治療無效的VSA[5], 但其并未提出對難治性VSA的治療方案。
該患者在首次入院當晚發作心絞痛時V2~V4導聯ST段抬高≥0.1 mV, 含服硝酸甘油后癥狀可緩解, 且ST段明顯回落, 隨后的冠狀動脈造影血管未見狹窄, 診斷為VSA較為明確。隨后給予欣康、合貝爽等藥物治療后癥狀仍反復發作, 可考慮診斷為難治性VSA。在對患者行CPAP治療后胸痛發作頻率明顯減少, 因此OSAHS可能參與該患者難治性VSA的發生。尚無OSAHS致難治性VSA機制的相關研究, 但可能與Tamura等[6]闡述的阻塞性睡眠呼吸暫停(obstructive sleep apnea, OSA)致冠脈痙攣性心絞痛的機制相似:①OSAHS導致反復的缺氧、復氧, 增加了活性氧成分,降低了血管內皮細胞對一氧化氮的獲取, 導致血管內皮的損傷;②反復的缺氧/復氧產生過氧亞硝酸鹽, 過氧亞硝酸鹽滅活前列腺素I2合成酶, 抑制前列腺素H2轉化成前列腺素I2, 從而誘導心絞痛的發生;③反復的缺氧/復氧激活核因子-κb依賴的炎癥通路, 導致各種促炎細胞因子的產生, 這些促炎細胞因子通過激活RhoA/Rho激酶途徑增加血管平滑肌細胞內Ca2+的敏感性從而導致血管收縮;④OSAHS患者因呼吸暫停引起的反復發作的低氧和高碳酸血癥可通過刺激化學感受器導致交感神經張力明顯增強。這種以副交感神經張力為主轉變為交感神經張力為主的過程是OSAHS對自主神經影響的典型特征, 該過程可增強具有內皮損傷的心外膜冠狀動脈血管的緊張性。
VSA在我國并非少見, 但我國在該領域的研究極少,2015年發布的《冠狀動脈痙攣綜合征診斷和治療中國專家共識》[7]中并未提及難治性VSA這一概念, 且國內外尚無文獻介紹治療難治性VSA的有效措施[8-10]。本文介紹1例與OSAHS有關的難治性VSA, 以提高對難治性VSA的認識,并為類似患者的診療提供一定的指導作用。

