基于焓變計算的幾種考查方式
鐘舜方
(福建省沙縣第一中學 365050 )
焓變計算是對化學反應及能量變化知識考查的重要題型之一,本文就幾種常見的考查方式例析如下.
一、利用蓋斯定律求焓變
首先根據所求反應的方程式中各物質的系數,將已知熱化學方程式整體乘以相應的系數,然后進行加減合并.若合并后出現負號則移項,使各物質的系數與所求的方程式完全相同即可.
例1 已知:①甲醇脫水反應

ΔH1=-23.9kJ·mol-1
②甲醇制烯烴反應

ΔH2=-29.1kJ·mol-1
③乙醇異構化反應

ΔH3=+50.7 kJ·mol-1
則乙烯氣相直接水合反應
C2H4(g)+H2O(g)=C2H5OH(g)
的ΔH= kJ·mol-1.
解析通過觀察已知熱化學方程式與所求熱化學方程式,再由蓋斯定律可知:①-②-③可得到此熱化學方程式

所以ΔH=①-②-③=-23.9 kJ/mol-
(-29.1 kJ/mol)-50.7 kJ/mol=-45.5kJ/mol.
二、利用化學鍵鍵能求焓變
由于化學反應的實質是反應物舊化學鍵斷裂要吸收能量,生成物新化學鍵形成要釋放能量,所以反應的焓變ΔH=反應物各物質的總鍵能-生成物各物質的總鍵能.
例2 SF6是一種優良的絕緣氣體,分子結構中只存在S—F鍵.已知:1 mol S(s)轉化為氣態硫原子吸收能量280 kJ,斷裂1mol F—F 、S—F鍵需吸收的能量分別為160 kJ、330 kJ.則S(s) + 3F2(g)=SF6(g)的反應熱ΔH為( ).
A.-1780kJ/mol B. -1220 kJ/mol
C.-450 kJ/mol D. + 430 kJ/mol
解析由題意的1mol S(s)和3 mol F2(g)形成硫原子和氟原子共需要吸收能量是280 kJ+3×160 kJ=760 kJ.而生成1mol SF6(g)時需形成6 mol S—F鍵,共放出6×330 kJ=1980 kJ,因此該反應熱ΔH=760 kJ/mol-1980kJ/mol=-1220kJ/mol,故選項B正確.
三、利用能量變化圖像求焓變
根據反應物具有的總能量與生成物具有的總能量之前的關系判斷:反應物具有的總能量高于生成物具有的總能量,該反應為放熱反應.反應物具有的總能量低于生成物具有的總能量,該反應為吸熱反應.
例3 氮氣與氫氣化學反應的能量變化圖如圖所示,寫出N2(g)和H2(g)反應生成NH3(l)的熱化學方程式 .
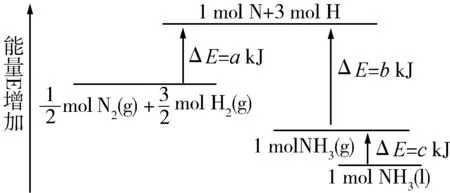

變式1 P和Cl2發生反應生成PCl3和PCl5,反應過程和能量關系如圖所示(圖中的ΔH表示生成1 mol產物的數據)根據圖回答下列問題.
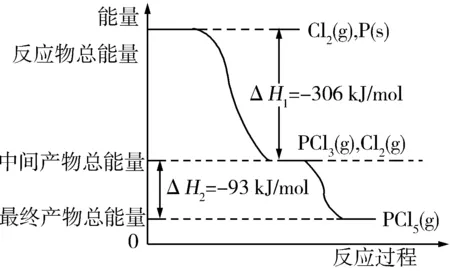
(1)P和Cl2反應生成PCl3的熱化學方程式 ;
(2)PCl5分解生成PCl3和Cl2的熱化學方程式 ;
解析(1)根據圖可知:

反應物的總能量大于生成物的總能量,該反應是放熱反應,反應熱為ΔH=-306 kJ/mol,則熱化學方程式為:


PCl5(g)=PCl3(g)+Cl2(g)
是吸熱反應;熱化學方程式為
PCl5(g)=PCl3(g)+Cl2(g) ΔH=+93 kJ/mol
四、利用燃燒熱求焓變
燃燒熱是在101kPa時,1mol物質完全燃燒生成穩定的氧化物時所放出的熱量.
例4 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇,并開發出直接以甲醇為燃料的燃料電池.已知H2(g)、CO(g)和CH3OH的燃燒熱ΔH分別為-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1,則甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為____;
解析由題可知,先寫出燃燒熱的熱化學方程式如下:

ΔH=-283.0kJ·mol-1①
CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)
ΔH=-726.5kJ·mol-1②
用②-①得到

五、利用中和熱求焓變
中和熱是指在稀溶液中,強酸跟強堿發生中和反應生成1mol液態H2O時的反應熱.
例5 分別取100 mL 0.50 mol/L鹽酸與100 mL 0.55 mol/L NaOH溶液進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.假設鹽酸和氫氧化鈉溶液的密度都是1 g/cm3,中和后生成溶液的比熱容c=4.18 J/(g·℃).實驗時,測得反應前鹽酸與NaOH溶液的平均溫度為21.5℃,反應后混合溶液的溫度為24.9℃.則實驗測得的中和熱ΔH= (保留1位小數).
解析先根據Q=m·c·ΔT計算反應放出的熱量,然后根據ΔH=Q/nkJ·mol-1計算出反應熱.
n(H2O)=0.1 L×0.5 mol=0.05 mol
m(aq)=200 mL×1g/mL=200 g
ΔT=24.9℃-21.5℃=3.4℃,
Q=m·c·ΔT=200 g×4.18J/(g·℃)×3.4℃=2842.4 J=2.842kJ
ΔH=Q/n=-2.842 kJ/0.05 mol=-56.8 kJ·mol-1
六、利用多種能量綜合求焓變
例6 室溫下,將1mol的CuSO4·5H2O(s)溶于水會使溶液溫度降低,熱效應為ΔH1,將1 mol的CuSO4(s)溶于水會使溶液溫度升高,熱效應為ΔH2,CuSO4·5H2O受熱分解的化學方程式為:

熱效應為ΔH3,寫出ΔH1、ΔH2、ΔH3之間的關系.
解析先分別寫出ΔH1、ΔH2、ΔH3對應的熱化學方程式:



由蓋斯定律可得:①-② =③,即ΔH1-ΔH2=ΔH3.
因此,同學們要熟練掌握以上幾種焓變計算的考查方式,這對解題會起到事半功倍效果.

