微小核糖核酸:家族性高膽固醇血癥的新治療靶點
江龍綜述,王綠婭、程曉曙審校
家族性高膽固醇血癥(FH)是常染色體單基因顯性遺傳病,主要致病基因為低密度脂蛋白受體(LDLR)基因,其主要臨床特征是低密度脂蛋白膽固醇(LDL-C)水平極度升高,引起全身嚴重動脈粥樣硬化(AS)和早發冠狀動脈粥樣硬化性心臟病[1,2]。FH分為純合(HoFH)與雜合兩種類型,雜合FH患病率約為1/200,HoFH患病率僅為1/16萬~30萬[3,4]。但FH的早期診斷率及治療率僅為10%~15%[1],作為冠心病的高危人群,目前仍未引起人們足夠重視。FH與其他高脂血癥不同,2013年歐洲動脈粥樣硬化學會(EAS)共識強調了“累積LDL-C負擔”的概念,正常人55 歲時累積LDL-C 負擔為160 mmol/L即可發生冠心病(CHD),由于患者從出生就沉浸在高LDL-C水平下,若不治療,HoFH患者12歲LDL-C就可累積到160 mmol/L而發生CHD,雜合FH患者35歲時即可發生CHD[1]。近年來,國際動脈粥樣硬化學會、EAS等國際組織頒布多項FH防治指南和共識,強調需強化FH管理[3-5]。按照FH全球發病率1/200計算,我國有超過300萬潛在FH患者,遺傳負擔相當沉重。2013年EAS制定的FH診治共識認為我國大陸FH診斷率和治療率非常低,甚至低于中國臺灣和中國香港[1]。此外,我國FH研究現狀系統評價顯示,截止2014-12底,大陸報道FH總例數約100例,大多為病例報道和綜述類研究[6]。中國作為世界上人口最多的國家,承受FH 遺傳負擔可能比其他國家更為嚴重。除開展必要的防治宣傳外,對FH治療方法的探索也是分子生物學重要的課題之一。
1 家族性高膽固醇血癥基因治療的探索
目前的藥物治療很難使FH患者的LDL-C水平達到指南建議的目標值,特別是HoFH患者,即使他汀聯合依折麥布僅能降低LDL-C水平30%~40%[4];新近報道的在他汀基礎上加用前蛋白轉化酶枯草溶菌素9(PCSK9)抑制劑可降低LDL-C水平約50%[7];脂蛋白血漿置換術通過體外脂蛋白分離能夠有效降低HoFH患者血液中LDL-C水平55%~70%,但需要每2周1次,和PCSK9抑制劑一樣存在花費巨大的問題[8];肝臟移植可改善HoFH患者的LDL代謝,但由于缺乏供體及免疫排斥反應而難以推廣。因此,探索一種安全有效的新型療法勢在必行。
肝臟是調整膽固醇代謝的主要器官,人體約70%的LDL-C由肝臟上的LDLR基因代謝。因此,目前的FH基因治療策略主要圍繞肝臟上補充正常的人LDLR。最早在1995年,有學者通過逆轉錄病毒將表達人LDLR基因輸入5例HoFH患者肝臟,令人失望的是僅有3例患者有輕度的LDL-C降低(6%~25%)[9];有學者在動物模型中證實以腺相關病毒8(AAV8)為載體,攜帶重組LDLR基因至LdLr-/-/載脂蛋白B信使核糖核酸(mRNA)編輯的催化多肽-1(Apobec1)-/-小鼠模型肝臟,可有效改善AS進展[10]。基于此,在2016年開展了一項以AAV8為載體的對FH基因治療臨床試驗(NCT02651675),目前效果尚未公布。但是病毒載體具有潛在的免疫源性以及細胞毒性作用,安全性方面還有待深入研究。此外,一些非病毒載體的基因療法已在FH動物模型中驗證了其有效性和安全性,如我國團隊最近采用體積更小的微循環DNA載體裝載正常的LDLR基因,導入到高脂飲食的C57BL/6 LdLr-/-小鼠體內,在15周左右小鼠LDL-C水平維持在2.3~3.9 mmol/L之間,且未檢測到顯著的毒性反應[11]。總之,FH的基因治療策略的探索已經嶄露頭角,具有廣闊的前景,但其臨床療效和安全性還有待深入的探索。
2 微小核糖核酸(miRNAs)或為治療的新靶點
近年發現的miRNAs揭開了真核生物基因表達新的調控方式,極大地豐富了人們對基因表達調控新的認識。miRNAs是長度為18~22核苷酸的內源性非編碼單鏈RNA,通過堿基互補配對的方式與靶基因3’端非翻譯區結合,抑制靶基因mRNA轉錄、降解及抑制蛋白翻譯[12]。以下將主要圍繞miRNAs與LDL-C代謝以及目前與FH的臨床研究進展逐一進行闡述(圖1)。
2.1 miRNAs與LDL-C代謝
FH主要致病基因為LDLR,占75%以上;其他致病基因還包括載脂蛋白B100(ApoB100)和PCSK9等。以上任何一個基因有害突變,均可引起LDLR的表達和功能異常,導致循環LDL清除障礙,引發LDL-C水平升高,最終導致CHD發生。現圍繞影響以上三個主要基因的miRNAs進行闡述。
LDLR基因相關的miRNAs:LDLR是體內LDL-C清除的關鍵受體,如能通過miRNAs提高自身LDLR的表達,將是一個潛在的治療策略。目前體外細胞實驗證實直接或間接影響LDLR基因表 達 的 miRNAs 包 括:miR-27a/b[13]、miR-128-1[14]、miR-148a[14]、miR-130b[14]、miR-301b[14]、miR-185[15]、miR-195[16]及 miR-199a/b[17];而經過動物體內驗證最終能有效影響LDL-C代謝的僅有以下三個:miR-128-1[14]、miR-148a[14]、miR-185[15];在ApoE-/-的小鼠模型中抑制miR-128-1可顯著升高LDLR的表達,降低循環極低密度脂蛋白膽固醇(VLDL-C)和LDL-C水平;在ApoE-/-的小鼠模型中抑制miR-148a可顯著升高LDLR和腺苷三磷酸(ATP)結合盒轉運體A1(ABCA1)的表達,從而減少循環中的LDL-C水平和升高高密度脂蛋白膽固醇(HDL-C)水平;在ApoE-/-的小鼠模型中抑制miR-185可明顯降低循環LDL-C水平,并且延緩動脈粥樣硬化的進展。
ApoB基因相關的miRNAs:載脂蛋白B(ApoB)的組裝和分泌對于飲食和內源性來源的脂質運輸至關重要,因此抑制ApoB的表達和活性,可有效的控制循環中膽固醇水平。目前體內實驗證實主要有三個miRNAs與ApoB基因相關:miR-30c[18]、miR-34a[19]和 miR-122[20];體內在 C57BL/6 小鼠模型中,通過慢病毒過表達miR-30c可顯著降低ApoB的表達和活性,還可降低血漿膽固醇和VLDL水平;在ApoE-/-的小鼠模型中過表達miR-30c的結果與上述模型的結果一致,并且觀察到可以縮減AS斑塊;在LdLr-/-小鼠模型中過表達miR-34a可顯著降低循環膽固醇,甘油三酯(TG)以及ApoB水平,并且可縮減AS斑塊負荷;對普通飼料喂養的小鼠體內抑制miR-122,4周后的顯著降低體內LDL-C、ApoB及TG水平。
PCSK9相關的miRNAs:PCSK9作為一個水解酶,在生理情況下可降解細胞膜上過多的LDLR表達,而有效抑制PCSK9的表達和活性,將提升LDLR的表達,從而達到降低循環LDL-C的目的。體外細胞實驗已證實miR-224直接靶向PCSK9的mRNA,從而降低PCSK9表達[21];而miR-195和 miR-27a均可上調 PCSK9 的表達[16,22];miR-132 和 miR-499可間接下調PCSK9轉錄調節因子固醇調節元件結合蛋白1c(SREBP-1c)的表達[23]。此外,來自巴西的學者預測了一些與PCSK9的mRNA3‘UTR區域結合的miRNAs[24]。可能由于PCSK9研究起步較晚,因此miRNAs與其相關的研究不多,鑒于其抑制劑在臨床使用中非常有效,期待今后更多體內的研究探討miRNAs與PCSK9的關系。
2.2 miRNAs與HDL-C
研究表明,HDL 對動脈血管壁有直接的保護作用,并能促進AS斑塊的消退,因此探索與HDL-C相關的miRNAs,可為將來基因治療提供一定的思路。ABCA1和ATP結合盒轉運體G1(ABCG1)是ATP結合盒轉運體超家族中的一員。ABCA1主要負責促進細胞內游離膽固醇和磷脂的流出,ABCG1主要負責促進膽固醇流出到成熟HDL上,兩者在維持細胞內膽固醇的動態平衡中起到非常重要的作用。研究證實影響ABCA1和ABCG1的miRNAs主要有:miR-10b、miR-19b、miR-26、miR-27a/b、miR-33a/b、miR-128-1、miR-144、miR-148a、miR-302a、miR-758[25,26]。此外,B 類 I型清道夫受體(SR-B1)既介導細胞選擇性攝取HDL和LDL-C,同時也可以通過與HDL的相互作用,介導膽固醇的逆轉運。與SR-B1相關的miRNAs主要有:miR-96、miR-125a/b、miR-185、miR-223、miR-455[27,28]。
2.3 miRNAs與家族性高膽固醇血癥的研究進展
miRNAs與FH的研究起步較晚,到目前為止直接來源于FH患者的證據的文章僅有4篇。最早的miRNAs和FH相關的研究是2011年美國馬里蘭大學的團隊采取FH患者的血液提取HDL,檢測其中的miRNAs并與正常人的進行比較后發現,表達明顯上升的是miR-223、miR-105和miR-106a,隨后在高脂喂養的LdLr-/-小鼠中證實了miR-223顯著升高[29];2014年上海交通大學團隊發表論文顯示,他們采用U133 2.0芯片對6例雜合FH患者和12例正常人進行檢測,最后圍繞五個主要的轉錄因子和相關的miRNAs繪制了交叉反應圖譜,里面有很多和LDL-C代謝相關的miRNAs, 如:miR-27a/b,miR-130b,miR-185 等[30];隨 后2015年來自意大利團隊為探討miR-33a和miR-33b與FH兒童的相關性,收集了28例FH兒童和25例正常兒童進行檢測,結果發現這兩個miRNAs在FH兒童中顯著升高,并與總膽固醇(TC)、LDL-C、ApoB及C反應蛋白正相關,揭示了miR-33a和miR-33b可作為FH兒童時期的早期生物標志物[31];2017年西班牙團隊采用含30個與血管平滑肌細胞生理和病理生理相關的miRNAs芯片,分別對心臟移植患者的動脈平滑肌細胞,血管平滑肌細胞系等進行篩選,再到FH患者中進行驗證,最后發現miR-24-3p和miR-130a-3p在FH患者中明顯降低,隨后作者又在50例CHD患者中進行驗證,發現循環中miR-130a-3p和CHD顯著負相關,提示miR-130a-3p可作為FH發生CHD的早期生物標志物[32]。
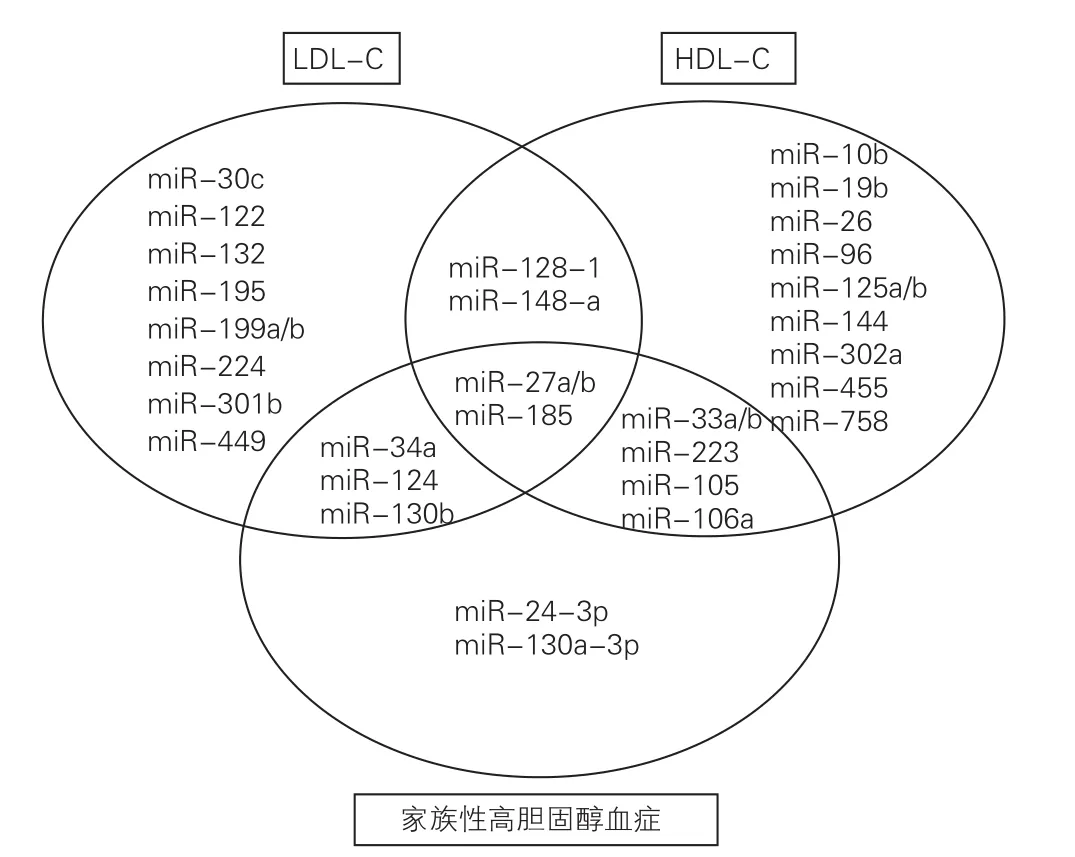
圖1 可能與家族性高膽固醇血癥相關的miRNAs匯總圖
在動物實驗中,Martins等[33]采用聯合miRNA沉默的三羥基三甲基戊二酰輔酶A還原酶以及轉基因LDLR質粒的方法,構建pLDLR-LDLR-miR82融合質粒,采用水流動力學注射到LdLr-/-小鼠的肝臟,不僅可降低39%的LDL-C水平,還可有效延緩AS的進展,治療12周后也無明顯肝功能異常及肝臟膽固醇聚積等不良反應。
3 miRNA治療新進展
近來,美國食品藥品管理局審批了ApoB的反義寡核苷酸——米泊美生(mipomersen)用于治療HoFH[34];新型長效PCSK9靶向RNAi治療性抑制劑(inclisiran, ALN-PCSsc)也完成了510例心血管疾病高危患者的Ⅱ期多中心臨床試驗,結果顯示在第1天和第90天分別使用300 mg的劑量,48%的患者在6個月后的LDL-C水平低于50 mg/dl,并且LDL-C水平可持續降低至8個月[35];以上研究對于FH的新型治療提供了新思路。然而反義寡核苷酸與miRNA相關的治療存在如下問題:(1)與內源性miRNAs的生物合成相互競爭;(2)晚期干擾素應答反應等;(3)脫靶效應[36]。而miRNAs可有效避免上述問題,因此miRNAs有望成為新的治療手段。目前正在進行臨床研究的有兩個miRNAs:miR-122和miR-34。第一個藥名是miravirsen,是專門抑制miR-122的鎖核酸修飾的硫代反義寡核苷酸,來自加拿大的研究者在7個國際中心對miravirsen用于36例慢性丙肝感染的有效性和安全性進行了評估,隨機分組后隨訪18周發現miravirsen用于慢性丙肝1型感染患者表現出長期劑量依賴性地減少丙肝病毒RNA水平,且未出現病毒抵抗性[37];另一個臨床試驗的是MRX34——miR-34的雙鏈miRNA模擬物,可通過抑制多個抑癌基因的通路以及刺激抗腫瘤免疫反應從而達到抑制腫瘤的作用。研究者對47例晚期實體腫瘤的患者進行每周兩次的靜脈注射MRX34,證實在這些患者中可安全耐受,且對于非原發性肝癌的患者來說,最大耐受劑量為110 mg/m2[38]。但是,目前把miRNAs治療廣泛用于臨床還有一些問題需要解決:(1)載體問題。總所周知常規使用的慢病毒、腺病毒等病毒載體存在免疫原性,細胞毒性,甚至有促癌風險,而非病毒載體如脂質體和納米材料等,同樣存在無法細胞特異性輸送的問題;(2)miRNAs的多效性。由于miRNAs存在生物學多效性,而大多數體內研究僅是針對某個特定的器官進行的觀察,缺乏整體的探討,是否除了靶基因治療之外還存在其他的作用,值得深入探討。綜上所述,miRNAs的臨床治療已經開展,從目前的試驗結果看,miRNAs具有一定的臨床應用價值,然而在AS或是CHD的治療領域,將來還需要更多的研究加以證實其有效性和安全性。
我國新近研究表明,中國FH的人群患病率為0.31%,在CHD患者中更高,達到3.9%[39,40]。因此,應一方面大力宣傳FH,增加患者和醫生對該病的認識程度;一方面提倡早期篩查早期治療FH;另一方面應探尋新的FH治療方式,以減少FH疾病所帶來的巨大經濟負擔。隨著科技快速發展,新型技術的開展把醫學領域帶來了一場全新的革命,而轉化醫學的興起為基礎醫學研究指明了新的方向。隨著miRNAs研究的不斷深入,新技術的不斷發展,我們期待新型的miRNAs治療能成為FH患者的有效治療藥物之一,能使這些患者的LDL-C水平真正達到指南要求的目標值,從而延緩AS的進展,最終延長患者生命。

