黃芪甲苷對大鼠肝星狀細胞氧化損傷的作用研究
王 鍵,宋瑞鵬,孫 丹
肝臟氧化應激損傷能引起肝星狀細胞結構及功能改變,而肝星狀細胞活化是引起肝纖維化的主要原因[1]。故尋找能夠有效延緩或減輕肝星狀細胞氧化應激損傷的藥物是本領域研究的熱點。黃芪甲苷是從黃芪中提取的重要單體,具有改善血管內皮細胞功能,調節微循環,提高超氧化物歧化酶活性,穩定細胞膜的作用[2-5]。本研究探討黃芪甲苷對肝星狀細胞氧化應激損傷的作用及相關機制,以期為肝纖維化的治療開辟新的研究方向。
1 材料與方法
1.1主要材料與試劑 黃芪甲苷(Sigma公司,純度為97%),大鼠肝星狀細胞株HSC-T6 (中國科學院上海生命科學研究院細胞庫),H2O2(美國Sigma公司),RPMI 1640培養基(美國Hyclone公司),MTT試劑盒(上海伯奧生物科技有限公司),H2DCFDA染色試劑盒(上海貝博生物科技有限公司),Hoechst-PI雙染試劑盒(南京建成生物研究所),Caspase-3、Caspase-9抗體(上海碧云生物技術有限天公司)。
1.2方法
1.2.1細胞培養:肝星狀細胞培養在RPMI 1640培養基(含10%胎牛血清和1%雙抗)中,培養箱內溫度為37℃,CO2體積分數為5%;每天觀察細胞的生長狀態,2~3 d換液1次。
1.2.2藥物處理及實驗分組:對照組不做任何處理,氧化損傷組用100 μmol/L的H2O2孵育24 h,黃芪甲苷低濃度組用100 μmol/L黃芪甲苷孵育24 h后加入100 μmol/L 的H2O2孵育12 h,黃芪甲苷高濃度組用200 μmol/L黃芪甲苷孵育24 h后加入100 μmol/L的H2O2孵育12 h。
1.2.3MTT法測定細胞增殖情況:取處于對數生長期的肝星狀細胞接種于96孔板中,細胞密度為1×104個/L,每孔200 μl,向各孔細胞中加入10 μl MTT(5 g/L),4 h后吸出上清液,加入100 μl DMSO溶液,低速振蕩10 min后在酶聯免疫檢測儀上測定各孔570 nm的光密度(OD)值。
1.2.4流式細胞術檢測肝星狀細胞內活性氧(ROS)表達:肝星狀細胞接種于6孔培養板,0.1%胰酶消化各組細胞后制備細胞懸液。1000 r/min離心后收集細胞,加入5 μl H2DCFDA染料后充分混勻避光反應15 min,于1 h內用流式細胞儀檢測細胞內ROS表達量。
1.2.5Hoechst-PI染色觀察細胞凋亡:肝星狀細胞接種于12孔培養板,細胞經相應處理后用PBS洗滌2次,在150 μl的Binding Buffer中加入2 μl Hoechst-PI染液,避光、室溫反應5 min后置于熒光顯微鏡下觀察結果并拍照。細胞凋亡率=凋亡細胞數/總細胞數×100%。
1.2.6Caspase-3及Caspase-9含量檢測:用0.1%胰酶消化細胞,1200 r/min離心10 min,收集細胞并用PBS沖洗2次,加入30 μl細胞裂解液后冰上孵育20 min,10 000 r/min離心10 min,按試劑盒說明書,使用721 D分光光度計測定細胞內Caspase-3及Caspase-9含量。

2 結果
2.1肝星狀細胞活性變化 氧化損傷組經H2O2處理后,細胞活性為(30.00±3.50)%,對照組為(96.67±2.98)%。氧化損傷組的細胞活性低于對照組(P<0.01)。用不同濃度黃芪甲苷處理后,低濃度和高濃度組的細胞活性分別提高到(54.00±4.22)%和(68.00±3.60)%,均高于氧化損傷組(P<0.01)。不同濃度黃芪甲苷組細胞活性比較差異無統計學意義(P>0.05)。見圖1。
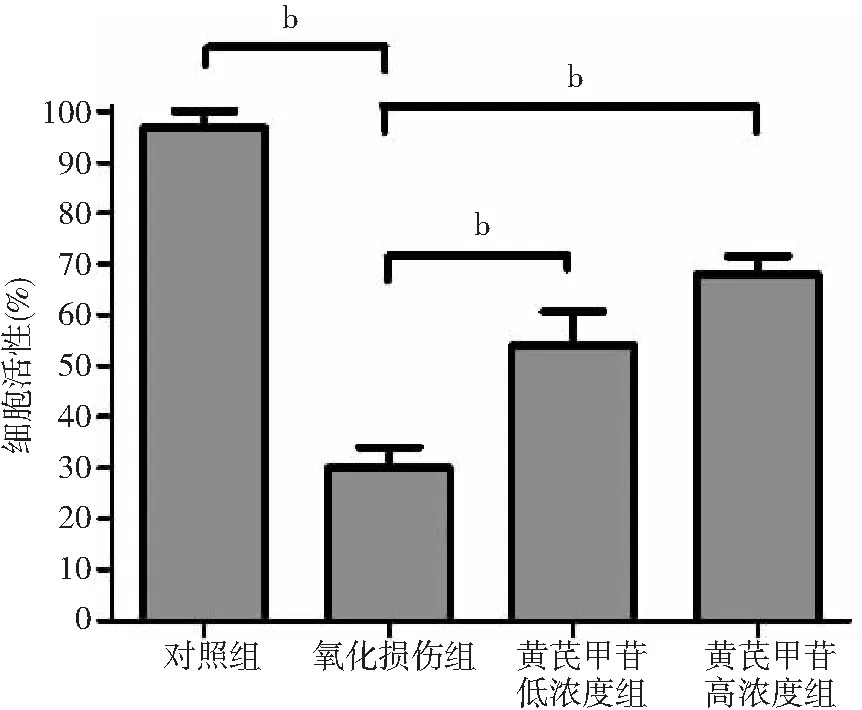
圖1黃芪甲苷對H2O2致肝星狀細胞活性的影響
注:與氧化損傷組比較,bP<0.01
2.2肝星狀細胞內ROS表達變化 對照組細胞內ROS表達均較低,氧化損傷組DCF熒光信號明顯增強,不同濃度黃芪甲苷干預后,熒光信號強度逐漸減弱。見圖2。
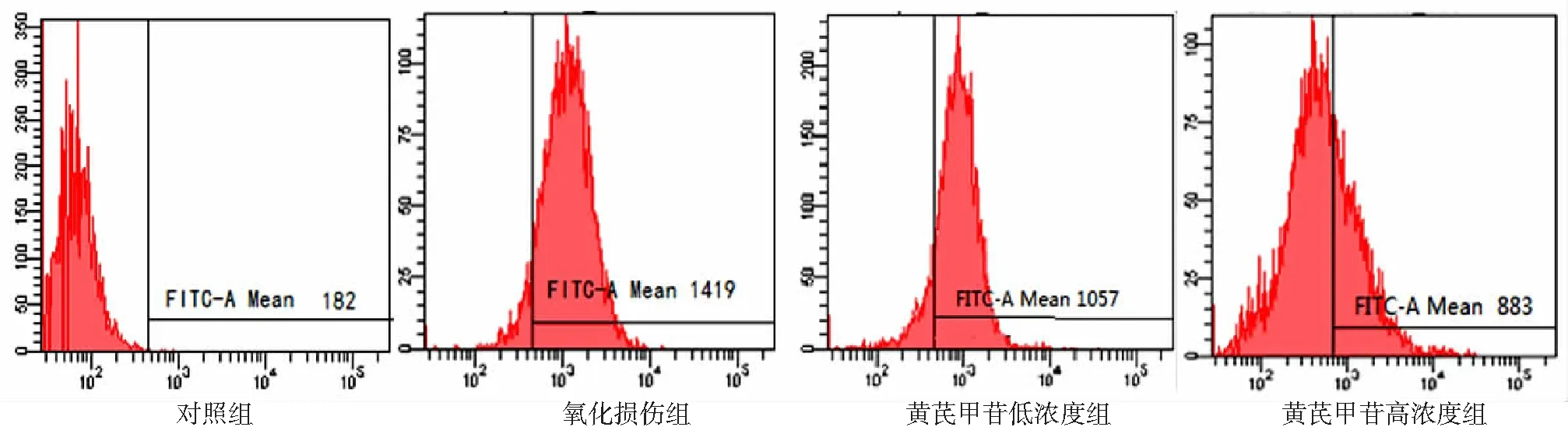
圖2 4組肝星狀細胞內活性氧含量流式細胞學檢測結果
2.3肝星狀細胞凋亡情況 未發生凋亡反應的細胞核為均勻一致的低藍色熒光,凋亡細胞為亮藍色熒光,壞死細胞為紅色熒光。熒光顯微鏡下可見正常細胞核內染色質濃縮、邊集,呈亮藍色高熒光。氧化損傷組凋亡細胞數量增多,甚至出現紅染的壞死細胞。氧化損傷組凋亡細胞比例為(68.00±3.56)%,對照組為(2.00±1.42)%。氧化損傷組凋亡細胞比例高于對照組(P<0.01)。黃芪甲苷干預后,凋亡及壞死細胞逐漸減少。黃芪甲苷低和高濃度組凋亡細胞比例分別為(51.67±4.86)%和(50.67±3.28)%,低于氧化損傷組(P<0.05,P<0.01)。不同濃度黃芪甲苷組凋亡細胞比例比較差異無統計學意義(P>0.05)。見圖3。
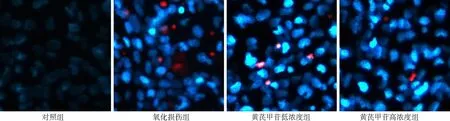
圖3 4組肝星狀細胞凋亡情況(Hoechst-PI染色 ×300)
2.4肝星狀細胞內Caspase-3及Caspase-9的含量變化 氧化損傷組肝星狀細胞內Caspase-3及Caspase-9表達高于對照組(P<0.05);黃芪甲苷干預后,肝星狀細胞內Caspase-3及Caspase-9表達水平低于氧化損傷組(P<0.01)。黃芪甲苷低濃度組與高濃度組肝星狀細胞內Caspase-3及Caspase-9含量比較差異無統計學意義(P>0.05)。見表1。
表1 黃芪甲苷對肝星狀細胞內Caspase-3及Caspase-9含量變化的影響
注:與對照組比較,aP<0.05;與氧化損傷組比較,bP<0.05
3 討論
為了研究肝纖維化病變的發生機制并探索出更多的治療性藥物,國內外學者嘗試了大量方法誘導肝星狀細胞凋亡,如:高糖、化學藥物、H2O2等[6-7]。為了能更接近人體環境,本研究模擬肝纖維化患者體內環境中肝星狀細胞的氧化應激狀態,利用100 μmol/L的H2O2建立細胞氧化損傷模型,觀察黃芪甲苷對肝星狀細胞的保護作用。
黃芪甲苷是黃芪的主要活性成分,具有提高記憶力、延緩衰老、調節免疫、抗腫瘤等作用,臨床主要用于糖尿病、心血管疾病的治療[8-10]。目前,臨床關于黃芪甲苷治療肝臟疾病的報道并不多,顧明等[11]通過制備大鼠肝臟缺血再灌注損傷模型后給予黃芪甲苷10~40 mg/(kg·d)腹腔注射進行干預后發現,黃芪甲苷通過抑制Caspase-3及Caspase-9表達,減輕大鼠肝臟缺血再灌注損傷。本研究采用100 μmol/L和200 μmol/L的黃芪甲苷處理鼠肝星狀細胞24 h,發現黃芪甲苷能夠有效抑制H2O2引起的肝星狀細胞內ROS增加,提示黃芪甲苷具有抑制細胞氧化損傷的作用。黃芪甲苷干預的肝星狀細胞活性增加,凋亡細胞比例降低,提示黃芪甲苷能夠抑制肝星狀細胞凋亡反應的發生。
細胞凋亡是指在病理或者生理因素的影響下,通過激活膜信號通路及啟動相關程序基因,在降解酶、蛋白酶、核酸酶的作用下,導致細胞按一定程序控制的破壞和死亡[12-15]。核酸內切酶首先被激活,引起細胞內基因組DNA的降解,產生大小不等的核苷酸片段等特征性改變[16]。線粒體與細胞凋亡密切相關,當線粒體內膜通透性改變時,細胞色素C從線粒體內膜脫落并流失到細胞質中,從而啟動了細胞的凋亡過程[17]。細胞色素C與細胞凋亡的關系十分密切,細胞色素C與凋亡蛋白酶激活因子-1和Caspase-9組成了凋亡復合體,共同活化Caspase-3,作用于不同的靶目標,最終引起細胞凋亡[18]。本研究中,黃芪甲苷作用于肝星狀細胞后,Caspase-3和Caspase-9表達相對于氧化損傷組均降低,提示黃芪甲苷通過改變抗凋亡因子表達抑制了肝星狀細胞凋亡。
綜上所述,黃芪甲苷有望成為治療肝臟纖維化的有效藥物,為該病的臨床治療提供新思路。

